Фармацевтическая композиция с мнемотропной активностью
Номер патента: 17222
Опубликовано: 30.06.2013
Авторы: Понтелеева Ирина Васильевна, Кравченко Елена Валериевна, Романовский Дмитрий Иосифович
Текст
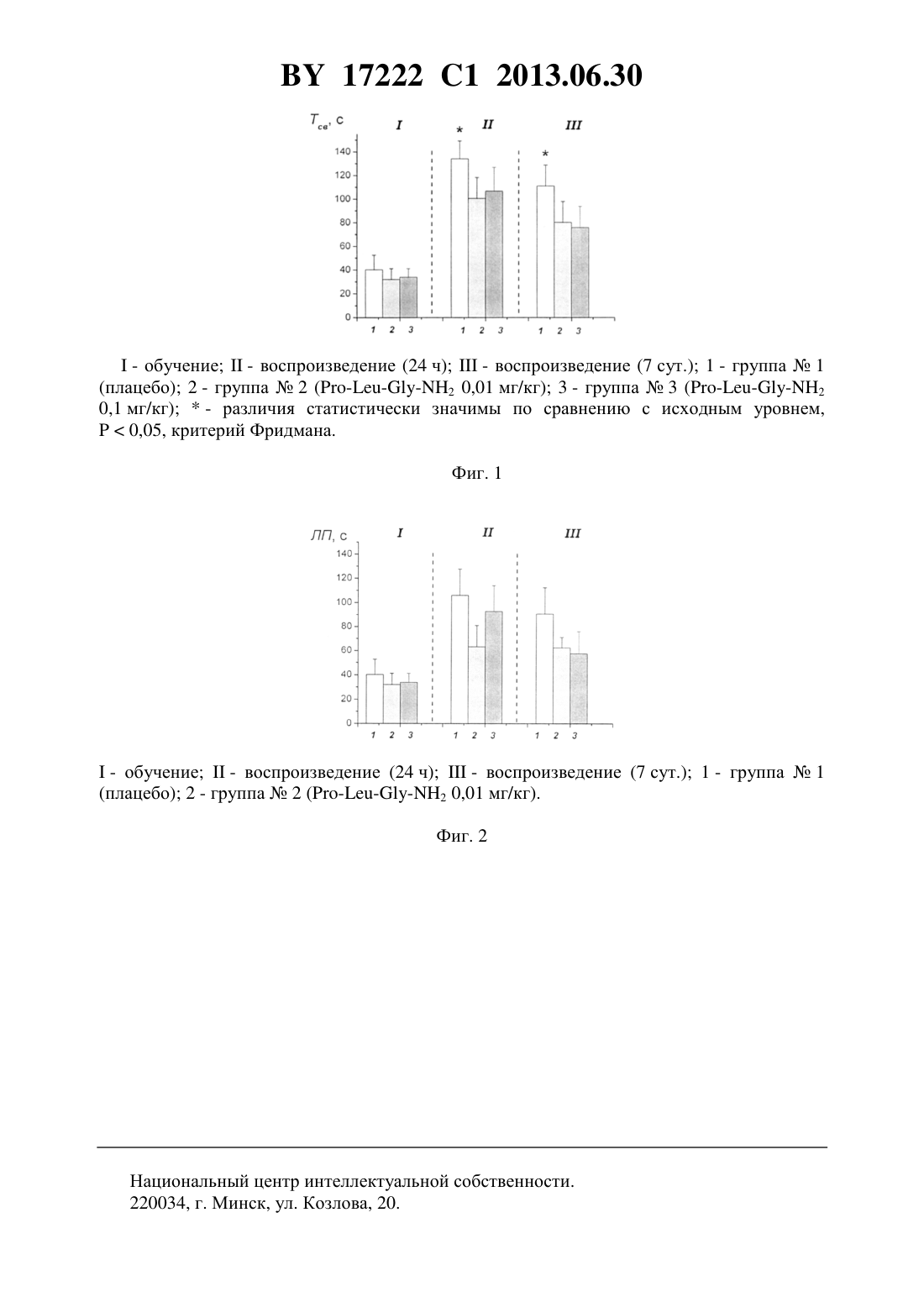
(51) МПК НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ(71) Заявитель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(72) Авторы Романовский Дмитрий Иосифович Кравченко Елена Валериевна Понтелеева Ирина Васильевна(73) Патентообладатель Государственное научное учреждение Институт биоорганической химии Национальной академии наук Беларуси(57) 1. Применение 2 в качестве средства для коррекции психосоматических нарушений, связанных с неприятными воспоминаниями после физической или психической травмы, в частности психогенных симптомов посттравматических расстройств. 2. Фармацевтическая композиция для профилактики или лечения психосоматических нарушений, связанных с неприятными воспоминаниями после физической или психической травмы, содержащая 2 в эффективном количестве и фармацевтически приемлемые вспомогательные вещества. 3. Фармацевтическая композиция по п. 2, отличающаяся тем, что предназначена для приема внутрь и выполнена в форме таблетки, капсулы, гранул или порошка. 4. Фармацевтическая композиция по п. 2, отличающаяся тем, что предназначена для парентерального введения и выполнена в форме раствора, лиофилизированного порошка,стерильной сухой рассыпки или назальных капель. 5. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в форме таблетки и имеет следующий состав, г 17222 1 2013.06.30 6. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в форме твердой желатиновой капсулы, содержащей гранулы следующего состава, г 2 0,000001-1,0 целлюлоза микрокристаллическая 0,015-0,450 лактоза 0,010-0,500 крахмал 0,010-0,450 аэросил 0,001-0,010 поливинилпирролидон 0,004-0,200 магния стеарат 0,0005-0,030. 7. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в форме мягкой желатиновой капсулы, содержащей следующий состав, г 2 0,000001-1,0 масло растительное 0,001-1,0 лецитин очищенный 0,001-1,0 воск пчелиный 0,001-1,0. 8. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в форме гранул для приема внутрь следующего состава, г 2 0,000001-1,0 целлюлоза микрокристаллическая 0,015-0,450 лактоза 0,010-0,500 крахмал 0,010-0,450 аэросил 0,001-0,010 поливинилпирролидон 0,004-0,200 магния стеарат 0,0005-0,030. 9. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в форме порошка для приема внутрь и имеет следующий состав, г 2 0,000001-1,0 лактоза 0,010-5,0. 10. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в форме раствора для инъекций и имеет следующий состав-маннит, г 0,005-50,0 вода для инъекций, мл до 1-1000. 11. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в форме лиофилизированного порошка для инъекций и имеет следующий состав, г-маннит 0,005-50,0. 12. Фармацевтическая композиция по п. 2, отличающаяся тем, что выполнена в форме назальных капель и имеет следующий состав 2, г 0,0001-1,0 нипагин, г 0,005-5,0 вода дистиллированная, мл до 1-1000. 13. Фармацевтическая композиция по п. 1, отличающаяся тем, что выполнена в форме стерильной сухой рассыпки для приготовления раствора для инъекций или инфузий и имеет следующий состав, г-маннит 0,005-50,0. Изобретение относится к области медицины (фармакологии, психиатрии) и фармацевтической промышленности. Предложена фармацевтическая композиция с мнемотропным 2 17222 1 2013.06.30 действием, включающая 2 и фармацевтически приемлемые вспомогательные вещества. Фармацевтическая композиция обладает способностью воздействовать на процессы памяти (ослаблять неприятные воспоминания) и может применяться, например,для коррекции психогенных симптомов посттравматических расстройств (после физической или психической травмы). Характеризуется низкой токсичностью, обеспечивает точность дозирования и удобство применения. В настоящее время в связи с огромным разнообразием источников психической травматизации индивида (травмирующее влияние со стороны сверстников, сексуальное и физическое насилие и др.) широко распространены психогенные симптомы посттравматических расстройств, обнаруживаемые у 50 населения 1. Чрезмерный стресс приводит к тяжелой психологической дезинтеграции, которая сопровождается неконтролируемыми актами насилия, апатией, ступором 1. В социальном плане подобные состояния отягощаются избыточным потреблением алкогольных напитков, наркотиков, суицидами - с целью забвения и ухода от беспокоящей проблемы. Медицинское решение проблемы является наиболее эффективным методом помощи больным с такими нарушениями. Для коррекции подобных состояний применяют препараты, которые обладают амнезирующей активностью, в частности диазепам 2. Способность диазепама ослаблять воспоминания пациентов о проведенной процедуре хирургического вмешательства (электроимпульсная терапия, катетеризация сердца, эндоскопические процедуры, перевязка ожоговых ран и др.) 2 может быть использована в медицинской практике. Диазепам (,Болгария, таблетки по 10 мг) (прототип) обладает анксиолитическим, противосудорожным, снотворным, седативным действием. Диазепам обладает выраженным побочным действием со стороны нервной системы и органов чувств (сонливость, снижение быстроты реакций и концентрации внимания), со стороны сердечно-сосудистой системы и крови,органов желудочно-кишечного тракта и др. Вызывает развитие привыкания, синдрома отмены, синдрома последействия (мышечная слабость, снижение работоспособности) 3. Относится к числу опасных психотропных веществ, требующих специального контроля за их хранением, отпуском и применением. Должен использоваться только под наблюдением врача 3. Диазепам противопоказан при целом ряде заболеваний, в том числе при острых заболеваниях печени и почек, выраженной печеночной недостаточности, тяжелой миастении, наркотической или алкогольной зависимости, выраженной дыхательной недостаточности и др. 3. В период лечения диазепамом недопустимо употребление алкогольных напитков 3. Не рекомендуется применять его водителям транспортных средств и людям,деятельность которых требует быстрой психической или физической реакции, а также связана с повышенной концентрацией внимания. В последнее время возрос интерес к разработке пептидных препаратов, влияющих на память и обучаемость, которые нашли применение в терапии когнитивных нарушений(ноопепт, семакс и др.) 4, 5, 6. Выраженным мнемотропным действием обладает окситоцин (, 2). С амнезирующим действиемсвязывают способность рожениц забывать перенесенную боль 7. Однако использованиекак лекарственного средства сопряжено с рядом побочных эффектов (гипертонус матки,внутриматочная гипоксия плода, тахикардия, кратковременная артериальная гипотензия,бронхоспазм и др.) и ограничено рядом факторов (низкая стабильность в условиях протеолиза в плазме крови и кишечном тракте, быстрая экскреция, плохое проникновение из кишечного тракта в системный кровоток, а затем в ЦНС). В связи с этим возрастает интерес к его активным фрагментам, которые легче, чем , проникают через гемато-энцефалический барьер (ГЭБ). Трипептид 2 (, , -1), соответствующий С-концевому фрагменту окситоцина (7-9) (формула , молекулярная формула 132443), имеет молекулярную массу 284,35, регистрационный номер соединения по- 2002-44-0. 3 2 обладает выраженным влиянием на активность ЦНС, включая обучение и память 8, и сравнительно легко проходит ГЭБ 8. В ряде поведенческих тестов выявлены психотропные эффекты 2,нашедшие клиническое подтверждение в отношении депрессии (60 и 75 мг/кг) и болезни Паркинсона. Вместе с тем не описаны полезные эффекты названного соединения, используемого в качестве амнезирующего средства, и соответствующие лекарственные формы не предложены. Поставленная задача решается тем, что в направленных фармакологических экспериментах по стандартным методикам выявлена мнемотропная активность 2 в экспериментах на животных разработана фармацевтическая композиция, предназначенная для применения с целью воздействия на процессы памяти (способная ослаблять неприятные воспоминания), например, для коррекции психогенных симптомов посттравматических расстройств (после физической или психической травмы), содержащая 2 в эффективном количестве, а также фармацевтически приемлемые вспомогательные вещества. Техническим результатом, достигаемым при реализации изобретения, является обнаружение способности у известного трипептида воздействовать на процессы памяти (ослаблять неприятные воспоминания), и получение лекарственной формы, характеризующейся низкой токсичностью, обеспечивающей точность дозирования и удобство применения. Фармацевтическая композиция содержит в качестве основного действующего вещества 2 в диапазоне доз 0,000001-1,0 г (предпочтительно 0,00005-0,05 г). Предпочтительно, чтобы три аминокислоты дипептида являлись -формами. Предпочтительно введение 2 в виде пероральной или инъекционной лекарственной формы, поскольку при этих способах введения обеспечивается наибольшая точность дозирования активного вещества. К числу пероральных лекарственных форм, содержащих 2, могут относиться таблетки, капсулы (в том числе мягкие и твердые), порошки и гранулы для орального применения. Инъекционной лекарственной формой, содержащей 2, может быть раствор для инъекций (инфузий), или лиофилизированный порошок для приготовления раствора для инъекций (инфузий), или стерильная сухая рассыпка для приготовления раствора для инъекций (инфузий). Кроме того, возможно применение композиции и в виде назальных капель. При этом фармацевтическая композиция может содержать одно или несколько разрешенных к медицинскому применению вспомогательных веществ (целевых добавок), способных улучшить фармацевтические характеристики заявляемой композиции. К числу предпочтительных вспомогательных веществ относятся целлюлоза микрокристаллическая, лактоза (наиболее предпочтительно в виде моногидрата), крахмал, аэросил, поливинилпирролидон, магния стеарат, -маннит. В отличие от диазепама, заявляемая композиция характеризуется безопасностью применения (отсутствие резко выраженных побочных эффектов и развития зависимости). Действующее вещество заявляемой композиции отличается от диазепама высокой активностью (в примере 1 показана эффективность трипептида в дозе 0,01 мг/кг, т.е. в 100-500 раз ниже, чем 17222 1 2013.06.30 у диазепама) и возможностью применения при острых заболеваниях печени и почек, выраженной печеночной недостаточности, тяжелой миастении, наркотической или алкогольной зависимости, выраженной дыхательной недостаточности и др., а также возможностью применения его водителям транспортных средств и людям, деятельность которых требует быстрой психической или физической реакции и связана с повышенной концентрацией внимания. Пример 1. Изучали эффективность 2 (здесь и далее использована субстанция производства фирмы -, США, 9887-1) у половозрелых (в возрасте 2-3 месяца,57, средняя масса 265,312,1 г) аутбредных крыс-самцов . Для оценки мнемотропной активности использовали метод условного рефлекса избегания (УРПИ) ударов электрического тока. При выработке УРПИ крыс поодиночке помещали в освещенный отсек камеры хвостом к отверстию. После перехода животного в темный отсек металлическую дверь закрывали и на лапы животного в течение 2 с подавали электрический ток (0,5 мА). Особей, не совершивших переход в темный отсек, исключали из эксперимента. Через 24 ч после обучения осуществляли проверку сохранности выработанной УР, при этом повторяли процедуру выработки навыка без болевого подкрепления. Проверку сохранности выработанной УР проводили через 24 ч и 7 суток после обучения. Основными критериями оценки уровня обученности при выработке УР являлись латентный период перехода (ЛП), время пребывания в светлом отсеке (Тсв) и доля животных в группе, совершивших переход в темный отсек. При воспроизведении УРПИ увеличение значений первых двух из названных показателей и снижение третьего на фоне введения тестируемого вещества трактовали как улучшение сохранения УРПИ, а противоположные изменения - как нарушение сохранения (амнезия) навыка. Мнестическую активность анализируемого соединения у исходно недоученных животных определяли по формуле ЛП ОПЛП К(1)100,180 ЛП К где М - мнестическая активность соединения, оцененная с учетом ЛП перехода животного в темный отсек, отражающая облегчение обучения ЛПОП - среднее латентное время перехода животных основой группы в темный отсек ЛПК - то же для контрольной группы, 180 - максимально возможный период перехода. Чем хуже животное воспроизводит УРПИ, тем ниже Ма. Во избежание артефактов, обусловленных способностью тестируемого соединения в дозах 1-10 мг/кг оказывать влияние на ноцицептивную систему, трипептид назначали в десяти- и стократно меньших дозах - 0,01 и 0,1 мг/кг. Животным основных групп 2(14) и 3 (14) двукратно с интервалом 24 ч (за 60 мин до помещения крыс в экспериментальную установку) при выработке и воспроизведении УР в/б применяли трипептид в дозах 0,01 и 0,1 мг/кг соответственно. Крысам контрольной группы (группа 1,14) в том же режиме вводили растворитель. Оценку статистической значимости результатов проводили с использованием методов параметрической и непараметрической статистики для множественных сравнений. На фиг. 1 и 2 показано амнезирующее влияние заявляемого соединения у крыс . При тестировании сохранности условнорефлекторной реакции спустя 24 ч и 7 суток после выработки УР 50,0 и 35,7 особей контрольной группы соответственно помнили об электроболевом раздражении и не совершали переход в темный отсек (различия с исходным уровнем достоверны,0,05, критерий доли , таблица). Кроме того, различия с исходными значениями у крыс контрольной группы были статистически значимыми по показателю Тсв (0,05, критерий Фридмана, фиг. 1). Таким образом, по указанным показателям в контроле отмечена выработка УРПИ. Вместе с тем, поскольку в эксперименте применяли режим низкоинтенсивной (0,5 мА) аверсивной стимуляции, у здоровых половозрелых крысотмечался статистически значимый дефицит обученности, проявля 5 17222 1 2013.06.30 ющийся отсутствием существенных различий значений показателя ЛП в указанные сроки от таковых на этапе выработки УР (0,05, критерий Фридмана, фиг. 2). Таким образом, достигнутый уровень обученности в контроле позволял зарегистрировать как ноотропные эффекты (проявляющиеся статистически значимым возрастанием ЛП), так и амнезирующее действие тестируемого соединения (обнаруживающееся утратой статистически значимых различий с исходным уровнем по критерию доли обучившихся животных в группе и Тсв). Введение крысам 2 в дозе 0,01 мг/кг способствовало развитию амнезии. Так, доля животных в группе 2, совершивших переход в предпочитаемый отсек при воспроизведении УРПИ через 24 ч и 7 суток после обучения, статистически значимо не отличалась от исходного уровня (0,05, критерий доли , таблица). Отрицательные значения Ма у особей, которым назначали 2 в дозе 0,01 мг/кг (-57,9 и -31,8 при воспроизведении УР спустя 24 ч и 7 суток после обучения соответственно, таблица), указывают на наличие у испытуемого соединения выраженной мнемотропной активности (амнезирующее действие). При назначении трипептида в дозе 0,1 мг/кг отмечена амнезия менее выраженная, чем наблюдаемая на фоне использования 2 в дозе 0,01 мг/кг. Спустя 24 ч (но не 7 суток) после обучения доля животных в группе 3, совершивших переход, была достоверно выше, чем при выработке УР (0,05, критерий доли , таблица). Вместе с тем в эти сроки у особей группы 3, в отличие от контроля, не было отмечено возрастания значений показателя Тсв относительно таковых при обучении (0,05, критерий Фридмана, фиг. 1), что указывает на отсутствие выработки УР по названному критерию у особей основной группы 3. Полученные результаты свидетельствуют о статистически значимом амнезирующем действии 2, вводимого в тестируемых дозах. Тот факт, что психотропное действие(0,01 мг/кг) отмечается как на фоне применения трипептида, так и после его отмены, свидетельствует об отсутствии обучения, зависящего от состояния 9 и, соответственно, об отсутствии стимульных свойств у тестируемого соединения 9. Пример 2. Было изучено влияние 2 на поведение белых половозрелых аутбредных крыс-самцов , а также его острая токсичность. Животным основных групп вводили трипептид внутрибрюшинно в терапевтической дозе (0,01 мг/кг) и в дозе, 50-кратно(0,5 мг/кг) превышающей терапевтическую. Мышам контрольной группы применяли плацебо. Визуальную и инструментальную оценку поведенческих реакций осуществляли в сроки до 24 ч после введения тестируемых образцов. Отмечали отсутствие/наличие изменений внешнего вида и шерстного покрова животных, а также диареи, нарушения реакции на тактильные раздражители, одышки, слюнотечения, гипотермии. Определяли число крыс, у которых введение 2 вызывало один из указанных характерных симптомов, а также отмечали выраженность этих симптомов в баллах по 4-балльной шкале 0 баллов отсутствие реакции, 1 - слабо выраженная реакция, 2 - отчетливая, умеренно выраженная реакция, 3 - сильно выраженная реакция. Проводили регистрацию отсутствия/наличия экзофтальма, птоза век, стереотипии (упорное повторение какого-либо сложного, но бессмысленного действия, которое каждый раз выполняется тем же самым способом, что и раньше), тремора и судорог у экспериментальных животных. При наличии судорог указывали, имеют ли место судороги клонические, тонические или клонико-тонические определяли время иммобилизации, латентный период наступления первой клонико-тонической судороги, количество приступов, время гибели. Интенсивность судорожного припадка оценивали по 5-балльной системе 0 баллов - отсутствие судорожных реакций, 1 - вздрагивания головы или отдельных мышц тела, 2 - отдельные повторные клонические вздрагивания всего тела, 3 - клонико-тонические судороги умеренной выраженности, 4 -клонико-тонические судороги с падением животного на бок, 5 - серийные клонико-тонические судороги 6 17222 1 2013.06.30 и смерть. Регистрировали отсутствие/наличие реакции Штрауба (ригидность хвоста у крыс,хвост запрокинут за спину и изогнут в виде буквы ). Оценивали наличие/отсутствие атаксии у экспериментальных животных регистрировали расстройства координации движений (непроизвольные движения, неуверенная шатающаяся походка, затруднения при ходьбе). Отмечали отсутствие/наличие релаксации и сна на фоне введения образца при возникновении бокового положения отмечали латентное время наступления и его продолжительность (время восстановления рефлекса переворачивания у животных), число животных, у которых вещество в исследуемой дозе вызывает характерный симптом (сон). Установлено, что 2-кратное введение 2 в дозе, 50-кратно превосходящей терапевтическую, не вызывает гибели белых аутбредных крыс-самцов, не нарушает общего состояния и не отражается на показателях двигательной активности, не влияет на поведенческие реакции. Полученные данные показывают, что использование заявляемой композиции даже в дозе, 50-кратно превосходящей терапевтическую, не влечет за собой моторно-координационных нарушений. Это подтверждает ее преимущества в сравнении с диазепамом(прототип), в частности возможность применения такой фармацевтической композиции водителям транспортных средств и людям, деятельность которых требует быстрой психической или физической реакции и связана с повышенной концентрацией внимания. Пример 3. Пероральная лекарственная форма в форме таблеток, г 2 0,0001 лактоза 0,185 микрокристаллическая целлюлоза 0,070 крахмал кукурузный 0,030 поливинилпирролидон 0,010 аэросил 0,0022 магния стеарат 0,0027. Таблетки, содержащие 2, могут быть получены из композиций данного изобретения любым подходящим способом получения таблеток (например, методом прямого прессования или путем таблетирования с предварительным влажным или сухим гранулированием). Лекарственную форму в форме таблеток можно, например, получать путем влажного гранулирования, что в последнем случае включает следующие операции просеивание и смешивание порошков, увлажнение порошков раствором связывающих веществ и их перемешивание, гранулирование влажной массы, сушка влажных гранул, обработка сухих гранул, таблетирование, фасовка и упаковка. Берут 0,0001 г 2 и смешивают с 10 раствором ранее просеянного поливинилпирролидона (0,010 г). 0,185 г лактозы, 0,040 г микрокристаллической целлюлозы,0,030 г кукурузного крахмала просеивают, загружают в чистый сухой смеситель, перемешивают 10-15 мин и увлажняют при перемешивании полученным раствором 2 с соблюдением необходимых технологических операций, обеспечивающих однородность содержания активного вещества в полупродукте. Наиболее предпочтительным является использование лактозы в виде моногидрата. Увлаженную смесь гранулируют, влажные гранулы раскладывают на лотки слоем 1,5-2 см и сушат в течение 10-12 ч, периодически помешивая, до остаточной влажности 3,00,5 . 0,030 г микрокристаллической целлюлозы, 0,0022 г аэросила и 0,0027 г магния стеарата просеивают, добавляют к сухому грануляту и перемешивают в течение 10-15 мин. Прессуют полученную смесь для получения таблеток (например, с использованием пресса для формования таблеток). Каждая таблетка весит 300 мг и содержит 0,1 мг с соблюдением необходимых технологических операций,обеспечивающих однородность содержания активного вещества в полупродукте. Пример 4. Пероральная лекарственная форма в форме твердых желатиновых капсул, г 7 2 0,0002 лактоза 0,0688 микрокристаллическая целлюлоза 0,030 крахмал кукурузный 0,010 поливинилпирролидон 0,004 аэросил 0,001 магния стеарат 0,001. Твердые желатиновые капсулы, содержащие 2, могут быть получены из композиций данного изобретения любым подходящим способом. Для лекарственной формы в форме твердых желатиновых капсул используют гранулят, получаемый аналогично способу, описанному в примере 3. Полученный гранулят (0,115 г) с содержанием 0,2 мг 2 капсулируют в твердые желатиновые капсулы. Пример 5. Инъекционная лекарственная форма в форме раствора для инфузий-маннит 5,0 г вода для инъекций до 100 мл. Проводят подготовку помещения, оборудования, очистку воздуха, водоподготовку подготовку флаконов или пластиковых пакетов к наполнению. Подготавливают, взвешивают и растворяют в воде для инъекций 0,001 г 2 и 5,0 г маннита. Полученный раствор фильтруют, проводят розлив во флаконы или пластиковые пакеты, укупоривают или запаивают, стерилизуют. Пример 6. Инъекционная лекарственная форма в форме раствора для инъекций-маннит 0,05 г вода для инъекций до 5 мл. Проводят подготовку помещения, оборудования, очистку воздуха, водоподготовку моют и стерилизуют ампулы. Подготавливают, взвешивают и растворяют в воде для инъекций 0,00005 г 2 и 0,05 г маннита. Полученный раствор фильтруют, ампулируют, стерилизуют. Пример 7. Сублимационно высушенная инъекционная лекарственная форма (для приготовления раствора для инъекций), г-маннит 0,08. Порошок лиофилизированный для приготовления раствора для инъекций готовят следующим образом. Проводят подготовку помещения, оборудования, очистку воздуха. Получают воду для инъекций, проводят мойку и стерилизацию ампул или флаконов. Подготавливают, взвешивают и растворяют в воде для инъекций (проводя стерильную фильтрацию) 0,0002 г 2 и 0,08 г маннита. Наполняют ампулы или флаконы полученным раствором, замораживают, проводят сублимацию. Осуществляют запайку ампул или укупорку флаконов с готовой продукцией. Раствор для инъекций готовят непосредственно перед применением с использованием стерильного растворителя, прилагаемого в упаковке(5 мл воды для инъекций). Пример 8. Сублимационно высушенная инъекционная лекарственная форма (для приготовления раствора для инфузий), г-маннит 5,0. Порошок лиофилизированный для приготовления раствора для инфузий получают следующим образом. Проводят подготовку помещения, оборудования, очистку воздуха. 8 17222 1 2013.06.30 Получают воду для инъекций, проводят мойку и стерилизацию флаконов. Подготавливают, взвешивают и растворяют в воде для инъекций (проводя стерильную фильтрацию) 0,0005 г 2 и 5,0 г маннита. Наполняют флаконы полученным раствором,замораживают, проводят сублимацию. Осуществляют укупорку флаконов с готовой продукцией. Раствор для инфузий готовят непосредственно перед применением с использованием стерильного растворителя, прилагаемого в упаковке (100 мл воды для инъекций). Пример 9. Инъекционная лекарственная форма в форме порошка (сухая стерильная рассыпка) для приготовления раствора для инъекций, г-маннит 0,05. Порошок для приготовления раствора для инъекций (стерильная рассыпка) получают следующим образом. Проводят подготовку помещения, оборудования, очистку воздуха подготовку флаконов к наполнению. Подготавливают, взвешивают и помещают во флаконы (с соблюдением требований стерильности) 0,00005 г 2 и 0,05 г маннита,укупоривают флаконы с готовой продукцией. Раствор для инъекций готовят непосредственно перед применением с использованием стерильного растворителя, прилагаемого в упаковке (5 мл воды для инъекций). Пример 10. Инъекционная лекарственная форма в форме порошка (сухая стерильная рассыпка) для приготовления раствора для инфузий, г-маннит 5,0. Порошок для приготовления раствора для инфузий (стерильная рассыпка) получают следующим образом. Проводят подготовку помещения, оборудования, очистку воздуха мойку и стерилизацию флаконов. Подготавливают, взвешивают и помещают во флаконы(с соблюдением требований стерильности) 0,003 г 2 и 5,0 г маннита. Помещают во флаконы 2 и маннит с соблюдением требований стерильности,укупоривают флаконы с готовой продукцией. Раствор для инфузий готовят непосредственно перед применением с использованием стерильного растворителя, прилагаемого в упаковке (100 мл воды для инъекций). Пример 11. Лекарственная форма в форме назальных капель 2 0,25 г нипагин 1,0 г вода дистиллированная до 1 л. Подготавливают, взвешивают 0,25 г 2, 1,0 г нипагина. Подготавливают необходимое количество воды дистиллированной. Раствор 2 готовят весообъемным способом с добавлением нипагина, используя в качестве растворителя воду для инъекций. Все описанные в примерах 3-11 лекарственные формы должны удовлетворять требованиям Государственной фармакопеи Республики Беларусь 10. В примерах описаны наиболее применяемые на практике варианты фармацевтических композиций, однако заявляемый дипептид в дозировках 0,0000005-1,0 г может быть включен и в другие фармацевтические композиции (не ограничиваясь приведенными примерами), в лекарственных формах, известных специалистам и описанных в Государственной фармакопее Республики Беларусь 10. В частности, с целью получения более стабильного фармацевтического продукта возможно введение в состав композиции антиоксидантов, стабилизаторов, других фармацевтически приемлемых веществ, повышающих устойчивость к действию повреждающих факторов (окисление, температурный фактор, действие светового излучения и прочие). 9 17222 1 2013.06.30 Влияние 2 на выработку УРПИ у половозрелых крыс(2 воспроизведение (24 ч) 57,1 (8/14) 17,9 0,1 мг/кг) воспроизведение (7 сут.) 78,6 (11/14) 37,3 Примечания- различия статистически значимы по сравнению с исходным уровнем,0,05, критерий долиа - мнестическая активность. Показаниями для применения фармацевтической композиции, содержащей 2, являются профилактика и лечение нарушений памяти и способности к обучению, интеллектуальных расстройств, развивающихся на фоне врожденной или приобретенной патологии,обусловливающей недостаточное восприятие информации (нарушенная сенсорная чувствительность, тугоухость, слабое зрение и т.д.) или без таковой. Лекарственные формы, содержащие 2, применяют 1-3 раза в сутки в течение 0,5-3 недель, при необходимости до 1-6 месяцев. Основываясь на имеющихся данных, для лечения вышеназванных расстройств могут применяться и другие фрагментыили производныеи его фрагментов. Учитывая,что олигопептиды на основе -производных аминокислот обладают биологической активностью, возможно применение фармацевтической композиции, содержащей в качестве основного вещества олигопептиды, состоящие из остатков аминокислот как в форме -,так и -стереоизомеров. Способ лечения такой композицией, ее состав и способы получения могут быть аналогичны таковым для композиции, содержащей 2 и разрешенные к медицинскому применению вспомогательные вещества. Показатель/группа,доза (мг/кг) Источники информации 1. Кровяков В.М. Психотравматология. - М. Наука, 2005. - 216 с. 2. Справочник лекарств РЛС. Диазепам инструкция и применение. 3. Регистр лекарственных средств России // Аптекарь. - 2007. -9. - С. 970. 4. Воронина Т.А. Исследование противогипоксических и антиамнестических свойств мексидола и семакса // Эксп. и клин, фармакол. - 2010. -4. - С. 2-7. 5. Островская Р.У., Гудашева Т.А., Воронина Т.А., Середенин С.Б. Оригинальный ноотропный и нейропротекторный препарат ноопепт // Эксп. и клин. фармакол. - 2002. Т. 65. -5. - С. 66-72. 6. Шабанов П.Д. и др. Психофармакологический профиль ноотропоподобных пептидов // Психофарм. и биол. наркол. - 2009. - Т. 9. - С. 2517-2523. 7..,.,// . . - 2001. - . 81. - . 629-683. 8..,-11. 2007. - . 28. - . 2411-2434. 9. Трофимов С.С. и др. Является ли скополаминовая амнезия у крыс результатом обучения, зависящего от состояния // ЖВНД. - 2000. - Т. 50. -2. - С. 252-260. 10. Государственная фармакопея Республики Беларусь (1 издание, тт. 1-3) / Ред. Годовальников Г.В., Шеряков А.А. - Минск, 2006-2009. 10(плацебо) 2 - группа 2 (2 0,01 мг/кг) 3 - группа 3 (2 0,1 мг/кг)- различия статистически значимы по сравнению с исходным уровнем,0,05, критерий Фридмана. Фиг. 1 Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 11
МПК / Метки
МПК: A61K 38/06, A61P 25/00
Метки: композиция, мнемотропной, активностью, фармацевтическая
Код ссылки
<a href="https://by.patents.su/11-17222-farmacevticheskaya-kompoziciya-s-mnemotropnojj-aktivnostyu.html" rel="bookmark" title="База патентов Беларуси">Фармацевтическая композиция с мнемотропной активностью</a>
Предыдущий патент: Состав для получения пластмассовых изделий по экструзионно-прессовой технологии
Следующий патент: Способ получения концентрата для напитков на основе картофельного и кукурузного сырья
Случайный патент: Аксиально-поршневая гидромашина