Пептид, способный модулировать пролиферацию клеток
Номер патента: 7720
Опубликовано: 28.02.2006
Авторы: ДЕЙГИН Владислав Исакович, КОРОТКОВ Андрей Марксович
Текст
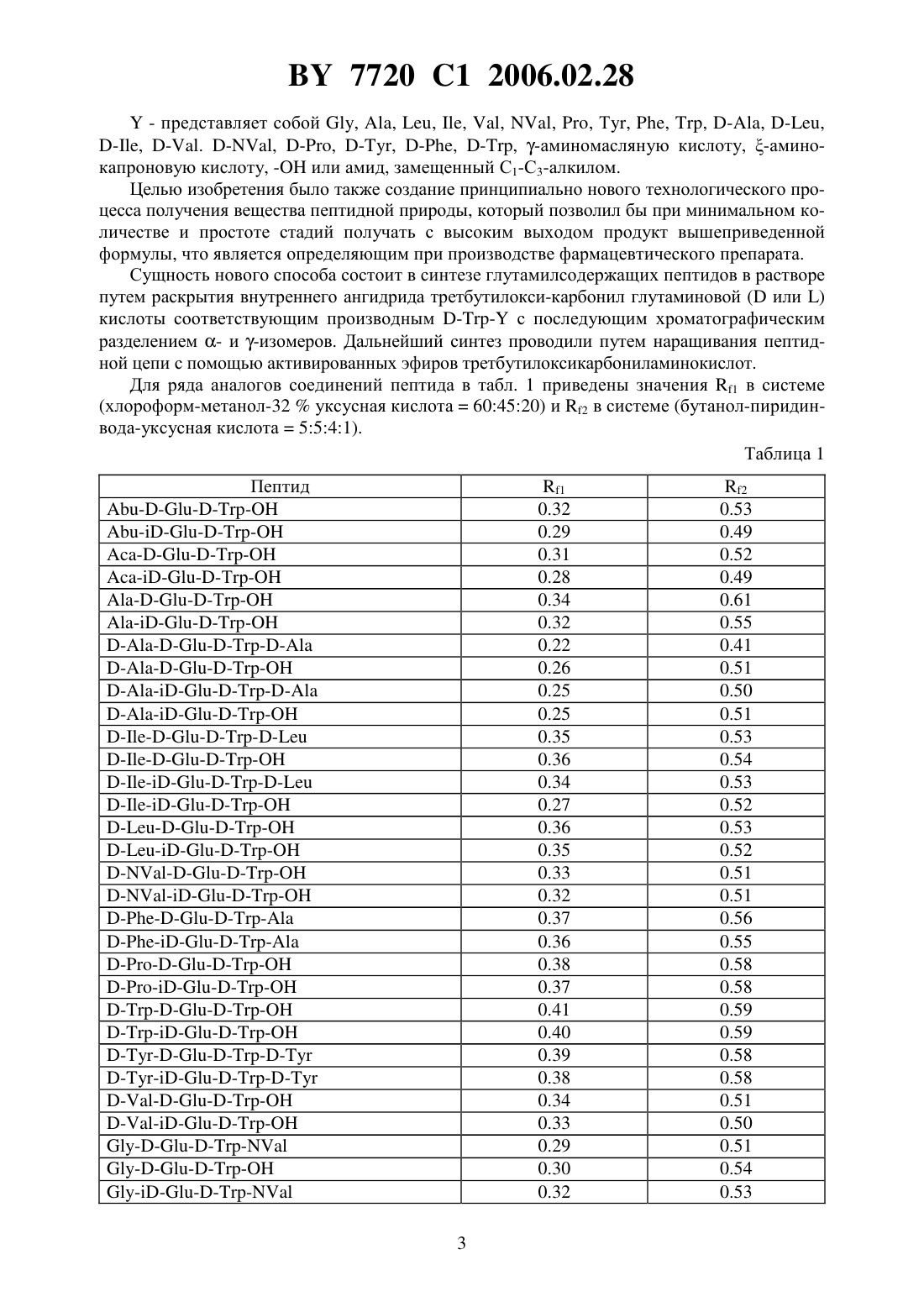
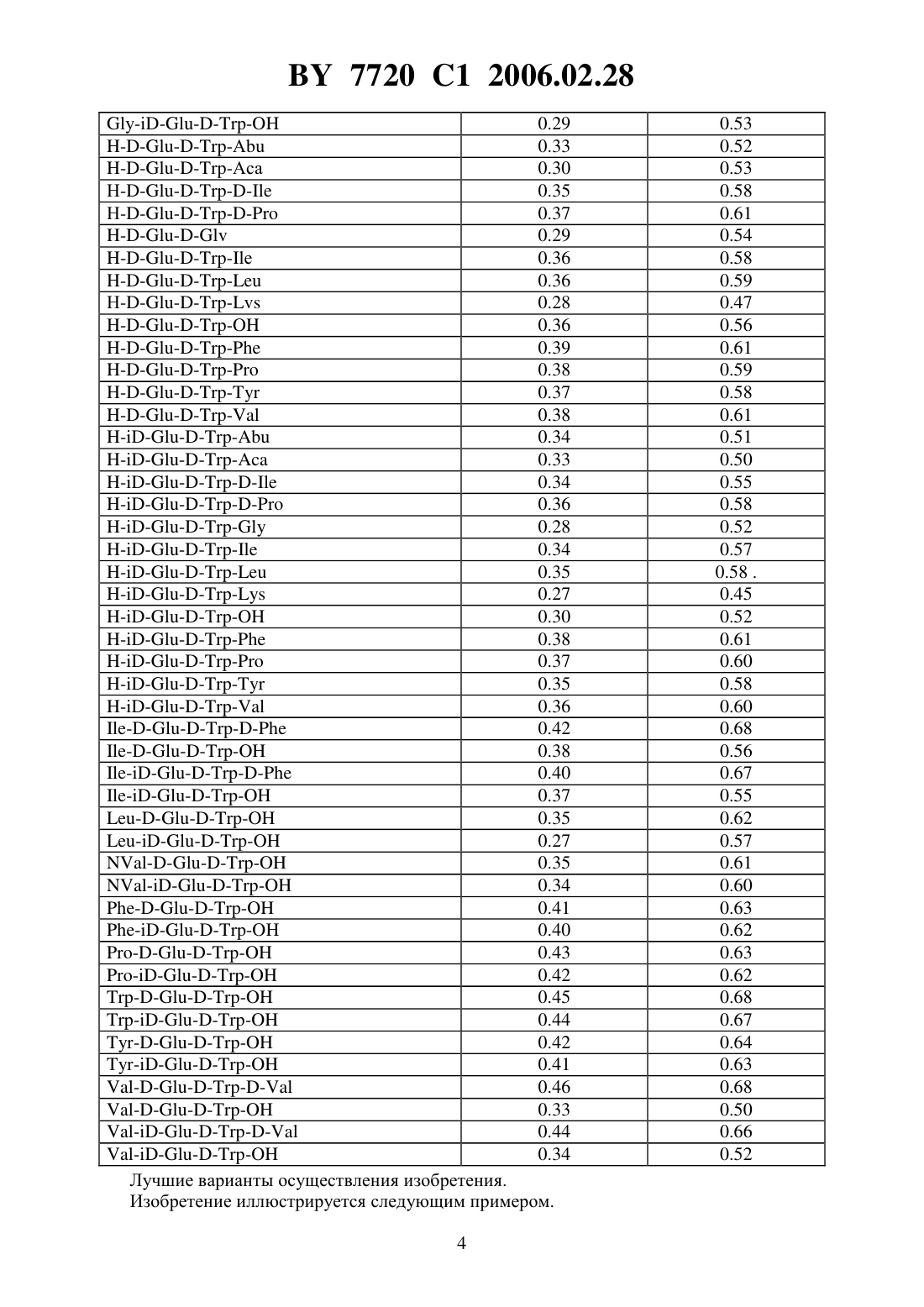
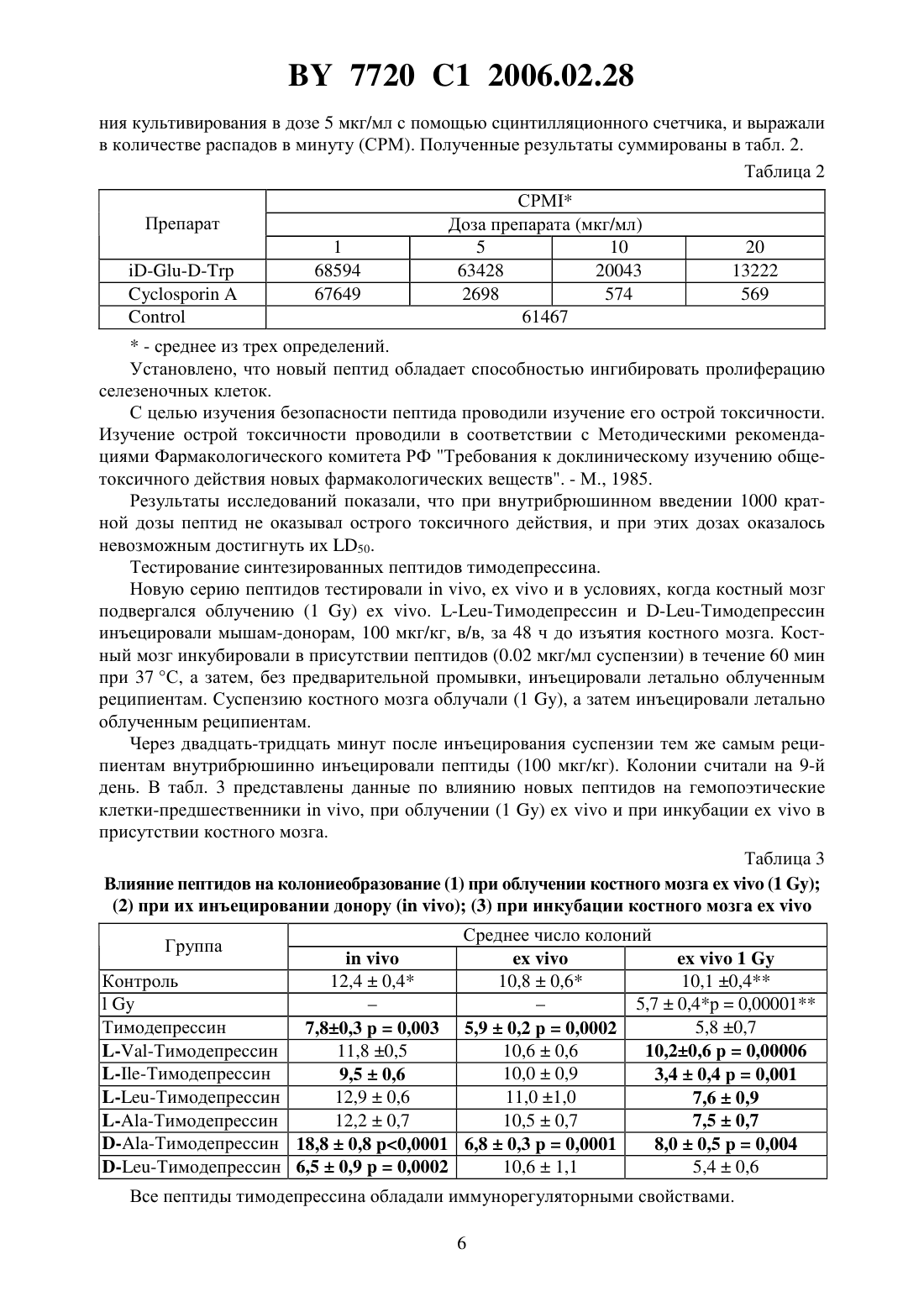
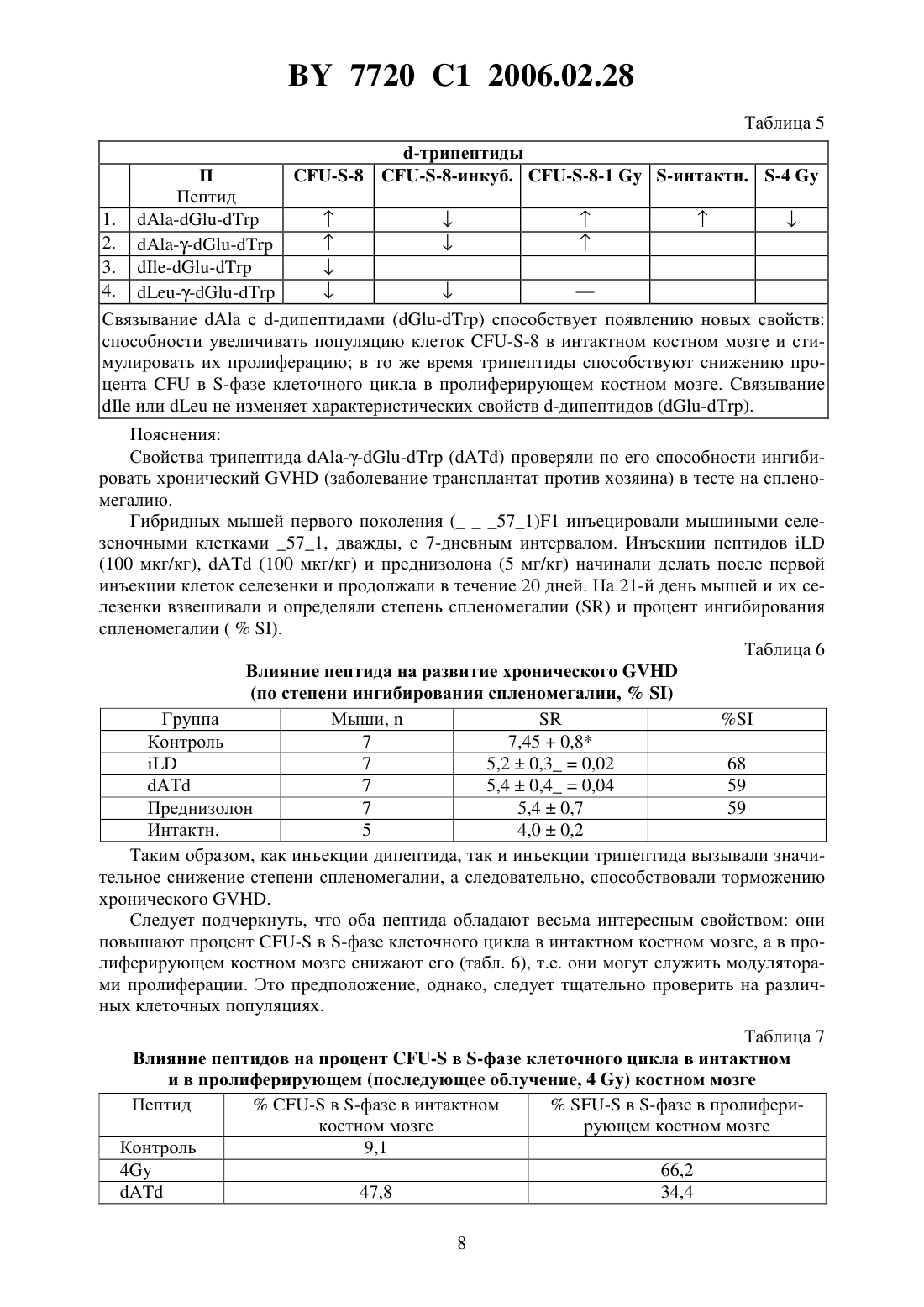
ПЕПТИД, СПОСОБНЫЙ МОДУЛИРОВАТЬ ПРОЛИФЕРАЦИЮ КЛЕТОК(71) Заявитель ИММУНОТЕХ ДЕВЕЛОПМЕНТС ИНК.(72) Авторы Дейгин Владислав Исакович Коротков Андрей Марксович(73) Патентообладатель ИММУНОТЕХ ДЕВЕЛОПМЕНТС ИНК.(57) 1. Пептид общей формулы ,где Х представляет собой водород, глицин, аланин, лейцин, изолейцин, валин, -валин,пролин, тирозин, фенилаланин, триптофан, -аланин, -лейцин, -изолейцин, -валин,валин, -пролин, -тирозин, -фенилаланин, -триптофан, -аминомасляную кислоту или -аминокапроновую кислоту А представляет собой -глутаминовую кислоту или -глутаминовую кислоту ипредставляет собой глицин, аланин, лейцин, изолейцин, валин, -валин, пролин,тирозин, фенилаланин, триптофан, -аланин, -лейцин, -изолейцин, -валин, -валин, -пролин, -тирозин, -фенилаланин, -триптофан, -аминомасляную кислоту,-аминокапроновую кислоту, гидроксил или амид, замещенный С 1-С 3-алкилом. 2. Пептид по п. 1, отличающийся тем, что Х представляет собой водород, -аланин, -лейцин, -изолейцин, -валин, валин,-пролин, -тирозин, -фенилаланин или -триптофан ипредставляет собой -аланин, -лейцин, -изолейцин, -валин, валин, пролин, -тирозин, -фенилаланин, -триптофан, гидроксил или амид, замещенный С 1 С 3-алкилом. 3. Пептид по п. 1, отличающийся тем, что Х представляет собой водород А представляет собой -глутаминовую кислоту ипредставляет собой гидроксил или амид, замещенный С 1-С 3-алкилом. 4. Пептид по п. 1, отличающийся тем, что представляет собой последовательность . 5. Пептид по п. 1, отличающийся тем, что представляет собой последовательность . 7720 1 2006.02.28 6. Пептид по п. 1, обладающий способностью модулировать пролиферацию клеток. 7. Пептид общей формулы ,где Х представляет собой водород, глицин, аланин, лейцин, изолейцин, валин, -валин,пролин, тирозин, фенилаланин, триптофан, -аланин, -лейцин, -изолейцин, -валин,валин, -пролин, -тирозин, -фенилаланин, -триптофан, -аминомасляную кислоту или -аминокапроновую кислоту А представляет собой -глутаминовую кислоту или -глутаминовую кислоту ипредставляет собой глицин, аланин, лейцин, изолейцин, валин, -валин, пролин,тирозин, фенилаланин, триптофан, -аланин, -лейцин, -изолейцин, -валин, -валин, -пролин, -тирозин, -фенилаланин, -триптофан, -аминомасляную кислоту,-аминокапроновую кислоту, гидроксил или амид, замещенный С 1-С 3-алкилом,обладающий способностью ингибировать пролиферацию клеток. Изобретение относится к медицине, а именно к способам получения биологически активных веществ, обладающих иммунорегулирующими свойствами, и может найти применение в медицине, ветеринарии, а также в экспериментальной биохимии. Предшествующий уровень техники. Актуальность разработки новых безвредных иммунорегулирующих пептидов, способных остановить прогрессирующий рост таких заболеваний, как злокачественные новообразования, сепсис, хронические и вялотекущие инфекции, развивающиеся на фоне иммунодефицитных состояний, подтверждается большим количеством исследований,проведенных в этой области. Наиболее распространенным способом выявления новых пептидов является выделение активных пептидных фракций из суммарных тканевых экстрактов, фракционированию и очистке вплоть до выделения индивидуального вещества и его идентификации 1600047,1638849,1737798. В практической медицине широко известны в качестве регуляторов иммунных процессов тимусные экстракты, в частности тимозин фракция 5,.,,,., тималин 659586. Эти экстракты состоят из комплекса веществ полипептидной природы и получение их из природных источников ограничено сложностью производства, малым выходом активных веществ и значительной вариабельностью их физико-химических характеристик и биологических свойств. Кроме того, из-за присутствия в природных препаратах тимуса балластных компонентов при их использовании у больных иногда возникают побочные явления. Последнее обстоятельство явилось стимулом для создания синтетических пептидных препаратов. В настоящее время осуществлен синтез ряда пептидов, обладающих иммунорегуляторными свойствами РСТ 089/06134,1541821,1518956, ЕР 230052, ЕР 406931,5021551,5013723. Каждый из полученных синтетических пептидов с ограниченным комплексом необходимых свойств обладает высокой активностью,низкой токсичностью, отсутствием побочных эффектов, которые определяют их возможное применение в медицине. Раскрытие изобретения. В основу изобретения положена задача создания нового синтетического биологически активного пептида, обладающего иммунорегулирующим свойством, формулы,где А - представляет собой - или- представляет собой водород, , , , , , , , , , , -,-. -. -, -, -, -, -, -, -аминомасляную кислоту или аминокапроновую кислоту 2 7720 1 2006.02.28- представляет собой , , , , , , , Т, , , -, -,-, -. -, -, -, -, -, -аминомасляную кислоту, -аминокапроновую кислоту, - или амид, замещенный С 1-С 3-алкилом. Целью изобретения было также создание принципиально нового технологического процесса получения вещества пептидной природы, который позволил бы при минимальном количестве и простоте стадий получать с высоким выходом продукт вышеприведенной формулы, что является определяющим при производстве фармацевтического препарата. Сущность нового способа состоит в синтезе глутамилсодержащих пептидов в растворе путем раскрытия внутреннего ангидрида третбутилокси-карбонил глутаминовой ( или ) кислоты соответствующим производным с последующим хроматографическим разделением - и -изомеров. Дальнейший синтез проводили путем наращивания пептидной цепи с помощью активированных эфиров третбутилоксикарбониламинокислот. Для ряда аналогов соединений пептида в табл. 1 приведены значения 1 в системе 0.34 Лучшие варианты осуществления изобретения. Изобретение иллюстрируется следующим примером. 4 и 1. Получение 14,7 (0.1 моля) растворяли 200 мм дистиллированной воды, одномолярным раствором КОН доводили рН до 10,2 и при интенсивном перемешивании добавляли раствор 33,0 г (0,3 моля) ВОС 2 О в диоксане. Следили за величиной рН на рН-стате. После окончания реакции смесь помещали в делительную воронку, экстрагировали из щелочной среды 3150 мм этилацетатом. Водную фазу медленно подкисляли 0,2 раствором серной кислоты до рН 3,0 и экстрагировали в органическую фазу (3 х 200 мм). Органический слой промывали 3200 мм насыщенным раствором 24 до нейтральной среды, сушили над 24. Упаривали в вакууме до маслообразного состояния. Выход 16,7 г (68 ). 2. Получение смеси и 16,7 г (0,068 моль) растворяли в 200 мл диметилформамида, охлаждали до 0 и при перемешивании добавляли раствор 20,6 г (0,1 моль) ,-дициклогексилкарбодиимида в 100 мл диметилформамида. Смесь перемешивали 4 ч при 4 С и оставляли на 8 ч при комнатной температуре. Выпавший осадок дициклогексилмочевины отфильтровывали, осадок промывали 250 мм диметилформамидом, фильтрат упаривали в вакууме до 1/2 объема и добавляли при охлаждении до 4 С и интенсивном перемешивании 24,3 (0,1 моль) . Раствор оставляли постепенно нагреваться до комнатной температуры. Об окончании реакции следили по ТСХ в системе (хлороформ этилацетат метанол 631) до исчезновения пятна внутреннего ангидрида кислоты. Остатки дициклогексил мочевины отфильтровывали, диметилформамид упаривали в вакууме. К маслообразному остатку добавляли 200 мм этилацетата и 200 мл 0.2 раствора серной кислоты. Органический слой отделяли, промывали до нейтральной среды насыщенным раствором 24, сушили над 24, этилацетатный раствор упаривали в вакууме. Полученный маслообразный осадок представлял собой смесь и . Общий выход масла составил 25.4 г (70 ). 3. Получение и 25,4 г (0,048 моля) смеси растворяли в 200 мл муравьиной кислоты, перемешивали при 40 С в течение 1 ч и упаривали в вакууме до маслообразного состояния. Разделение и очистку пептидов проводили с помощью ионообменной хроматографии на колонке с Сефадексом в градиенте 0,01-0,2 М пиридинацетатного буфера. Выход 5.7 г (35 ) и 5,7 г (35 ) . В результате изучения физико-химических свойств пептида были получены следующие его характеристики Первичная структура- и Брутто формула - 162035 Молекулярный вес - 334.35 Внешний вид - белый с желтоватым оттенком или серый порошок. Растворимость - легко растворим в воде, умеренно в спирте, практически не растворим в хлороформе. У.Ф.- спектр в области 250-300 нм имеет максимум 2802 мм, плечо 2872 нм. Биологическая активность нового пептида изучалась на мышах линии /. Клетки селезенки мышей суспендировали в среде 1640 с 2 мм глутамина и 5 инактивированной фатальной сыворотки и вносили в плоскодонные планшеты в количестве 100 мкл. соответственно, 200.000 клеток на лунку. Исследуемый препарат вносили в начале культивирования. В качестве митогена использовали конканавалин А в конечной концентрации 2 мкг на лунку. Планшеты инкубировали при 37 С и 5 СО в течение 48 ч. Пролиферацию клеток оценивали по включению 3 Н-тимидина, вносимого за 24 ч до оконча 5 7720 1 2006.02.28 ния культивирования в дозе 5 мкг/мл с помощью сцинтилляционного счетчика, и выражали в количестве распадов в минуту (СРМ). Полученные результаты суммированы в табл. 2. Таблица 2 Препарат СРМ Доза препарата (мкг/мл) 5 10 63428 20043 2698 574 61467- среднее из трех определений. Установлено, что новый пептид обладает способностью ингибировать пролиферацию селезеночных клеток. С целью изучения безопасности пептида проводили изучение его острой токсичности. Изучение острой токсичности проводили в соответствии с Методическими рекомендациями Фармакологического комитета РФ Требования к доклиническому изучению общетоксичного действия новых фармакологических веществ. - М., 1985. Результаты исследований показали, что при внутрибрюшинном введении 1000 кратной дозы пептид не оказывал острого токсичного действия, и при этих дозах оказалось невозможным достигнуть их 50. Тестирование синтезированных пептидов тимодепрессина. Новую серию пептидов тестировали,и в условиях, когда костный мозг подвергался облучению (1 ). Тимодепрессин и Тимодепрессин инъецировали мышам-донорам, 100 мкг/кг, в/в, за 48 ч до изъятия костного мозга. Костный мозг инкубировали в присутствии пептидов (0.02 мкг/мл суспензии) в течение 60 мин при 37 С, а затем, без предварительной промывки, инъецировали летально облученным реципиентам. Суспензию костного мозга облучали (1 ), а затем инъецировали летально облученным реципиентам. Через двадцать-тридцать минут после инъецирования суспензии тем же самым реципиентам внутрибрюшинно инъецировали пептиды (100 мкг/кг). Колонии считали на 9-й день. В табл. 3 представлены данные по влиянию новых пептидов на гемопоэтические клетки-предшественники, при облучении (1 )и при инкубациив присутствии костного мозга. Таблица 3 Влияние пептидов на колониеобразование (1) при облучении костного мозга ех(1 )(2) при их инъецировании донору ( ) (3) при инкубации костного мозгаГруппа КонтрольТимодепрессин Среднее число колоний 112,40,4 10,80,6 10,1 0,4 Все пептиды тимодепрессина обладали иммунорегуляторными свойствами. 6 7720 1 2006.02.28 Как с очевидностью следует из данных, приведенных в табл. 3, все пептиды тимодепрессина обладают иммунорегуляторными свойствами. Действие пептидов из группы с присоединенным -аминокислотным остатком (, , ) приводит к восстановлению колониеобразующей способности костного мозга после его облучения (1 ). Исключение составляет трипептид е-тимодепрессин инъекция этого пептида способствовала уменьшению количества колоний, образуемых облученным костным мозгом. Что касается пептидов с присоединенным -аминокислотным остатком, было показано, что Тимодепрессин оказывает стимулирующее действие на популяцию коммитированных колониеобразующих клеток интактного костного мозга, также как и облученных (1 ) клеток костного мозга. Инкубирование суспензии в присутствии пептида приводит к снижению числа колоний по сравнению с таковым при действии тимодепрессина. Тимодепрессин и Тимодепрессин обладают сходными свойствами (исключение составляет случай, когда костный мозг подвергают облучению). Результаты исследования. По своему действию на популяцию колониеобразующих клеток селезенки (-) пептиды были разделены на следующие группы 1. -дипептиды 2. -трипептиды Изучались следующие свойства какое действие оказывают пептиды, инъецированные интактным донорам за 2 дня до извлечения костного мозга, на популяцию клеток 8 (8) влияние пре-инкубации костного мозга с пептидами на популяцию клеток 8(8-инкубация) влияние пептидов на восстановление колониеобразующей способности костного мозга, облученного (1 )(8-1 ) влияние пептидов на процент клеток -, находящихся в -фазе клеточного цикла в костном мозге интактных доноров (пептид инъецировали донору, и через 48 ч определяли процент клеток -, находящихся в -фазе клеточного цикла (-интакт.) влияние пептидов на процент клеток -, находящихся в -фазе клеточного цикла в костном мозге облученных (4 ) доноров (пролиферирующие -) (-4 ). Обозначенияотсутствие эффектаповышениеснижение Таблица 4-содержащие -дипептиды способствуют уменьшению популяции клеток - в костном мозге интактных доноров ингибированию колониеобразующей способности костного мозга, преинкубированного с пептидами снижению пролиферации - как в быстро пролиферирующем, так и в интактном костном мозге. Замена - на - не изменяет характеристических свойств -содержащих дипептидов. Связываниес -дипептидами (-) способствует появлению новых свойств способности увеличивать популяцию клеток 8 в интактном костном мозге и стимулировать их пролиферацию в то же время трипептиды способствуют снижению процентав -фазе клеточного цикла в пролиферирующем костном мозге. Связываниеилине изменяет характеристических свойств -дипептидов (-). Пояснения Свойства трипептида проверяли по его способности ингибировать хронический(заболевание трансплантат против хозяина) в тесте на спленомегалию. Гибридных мышей первого поколения (571)1 инъецировали мышиными селезеночными клетками 571, дважды, с 7-дневным интервалом. Инъекции пептидов(100 мкг/кг),(100 мкг/кг) и преднизолона (5 мг/кг) начинали делать после первой инъекции клеток селезенки и продолжали в течение 20 дней. На 21-й день мышей и их селезенки взвешивали и определяли степень спленомегалиии процент ингибирования спленомегалии . Таблица 6 Влияние пептида на развитие хронического 7 5,40,40,04 59 Преднизолон 7 5,40,7 59 Интактн. 5 4,00,2 Таким образом, как инъекции дипептида, так и инъекции трипептида вызывали значительное снижение степени спленомегалии, а следовательно, способствовали торможению хронического . Следует подчеркнуть, что оба пептида обладают весьма интересным свойством они повышают процент - в -фазе клеточного цикла в интактном костном мозге, а в пролиферирующем костном мозге снижают его (табл. 6), т.е. они могут служить модуляторами пролиферации. Это предположение, однако, следует тщательно проверить на различных клеточных популяциях. Таблица 7 Влияние пептидов на процент - в -фазе клеточного цикла в интактном и в пролиферирующем (последующее облучение, 4 ) костном мозге Пептид- в -фазе в интактном- в -фазе в пролиферикостном мозге рующем костном мозге Контроль 9,1 4 66,2 7720 1 2006.02.28 Как показано методом проточной цитофлуориметрии, в костном мозге мышей, предварительно обработанных пептидомза 48 ч до анализа, процент клеток, несущих маркер 25 (показатель фактора роста -2), был увеличен (18.1 против 11.0 в контроле),а процент клеток, несущих маркер 69, являющийся показателем активации Т-лимфоцитов, был снижен (0.26 против 0.78 в контроле). Это предполагает, что пептид стимулирует клеточную пролиферацию и в то же время снижает число активированных Т-лимфоцитов. Далее, проверяли способность новых пептидов В- и усиливать образование колоний в селезенке, когда их инъецируют донору костного мозга за 48 ч до экстракции костного мозга. Было обнаружено, что оба пептида статистически значимо снижают количество колоний в костном мозге. Таблица 8 Пептид Счет колоний Контроль 10,40,5 7,20,60,0009-6,40,50,00006 Тестирование иммуносупрессивных свойствна модели локального . Мышам-реципиентам (1) инъецировали 20 млн. клеток селезенки мышей СВА под апоневротическую пластинку с тыльной стороны лапки (опытная задняя лапа) другую лапу (контрольная задняя лапа) инъецировали таким же количеством сингенных клеток.вводили реципиентам в дозе 100 мкг/кг, в/б, 4 раза, причем первую инъекцию производили через 1 ч после инъекции клеток селезенки, а затем ежедневно. Контрольные мыши получали физиологический раствор. На 6-й день извлекали подколенные лимфатические узлы, получали суспензии и собирали нуклеированные клетки. О тяжестисудили по соотношению между счетом клеток в лимфатических узлах опытной задней конечности к таковому в лимфатических узлах контрольной задней конечности (увеличение отношения . Наличиедостоверно определяли при 1.2. Как видно из данных, представленных в табл. 8, обработка реципиентовспособствует элиминации . Ни у одного из обработанных пептидом тестированных животныхне превысило 0.85, что указывает на отсутствие заболевания трансплантатпротив-хозяина Таблица 9 Влияниена манифестацию локальногоОбработка реципиента 6 Повышение соотношения между лимфатическими узламиКонтроль В этой тест-системевызывает супрессию развитияв значительно большей степени, чем . Комбинированное действиеи Неогена или Тимогена на образование колоний в селезенке. Постановка эксперимента была такой же, как и в предшествующем преднизолоновом тесте. Мышей-доноров инъецировали пептидом , 100 мкг/кг, в/б, за 48 ч до изъятия костного мозга. Неоген или Тимоген (10 мкг/кг, в/б) инъецировали летально облученным реципиентам за 30-40 мин до инъекции суспензии костного мозга. 9 7720 1 2006.02.28 Как видно из табл. 10, инъекции тимогена реципиентам статистически значимо снижали число колоний - доноров, обработанных пептидом . Неоген на этот параметр никоим влиял. Таким образом, при такой постановке эксперимента комбинированное действие пептидаи тимогена оказалось почти таким же, как и действие преднизолонатимогена. Таблица 10 Влияние комбинациии Неогена или Тимогена на образование колоний в селезенке Средний счет колоний 10.20.6 14,1 0.5 0.0001 14.2 0.7 0.0001 11.9 0.5 0.009- по сравнению с контролем /значимость вычислена против контроля- по сравнению с . / значимость вычислена противПромышленная применимость. Пептид, обладающий биологической активностью, может найти широкое применение в медицине и ветеринарии. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: A61P 43/00, C07K 5/04
Метки: пептид, пролиферацию, модулировать, способный, клеток
Код ссылки
<a href="https://by.patents.su/10-7720-peptid-sposobnyjj-modulirovat-proliferaciyu-kletok.html" rel="bookmark" title="База патентов Беларуси">Пептид, способный модулировать пролиферацию клеток</a>
Предыдущий патент: Пептид и способ его получения
Следующий патент: Железный порошок , содержащий кремний и способ его получения
Случайный патент: Способ получения производных таксана