Трансдермальный препарат продленного действия с антиостеопоротической активностью
Номер патента: 4001
Опубликовано: 30.09.2001
Авторы: Михаель Ёттель, Вальтер Эльгер, Михаель Эрнст, Дорис Хюблер, Биргитт Шнейдер, Михаель ДИТТГЕН
Текст
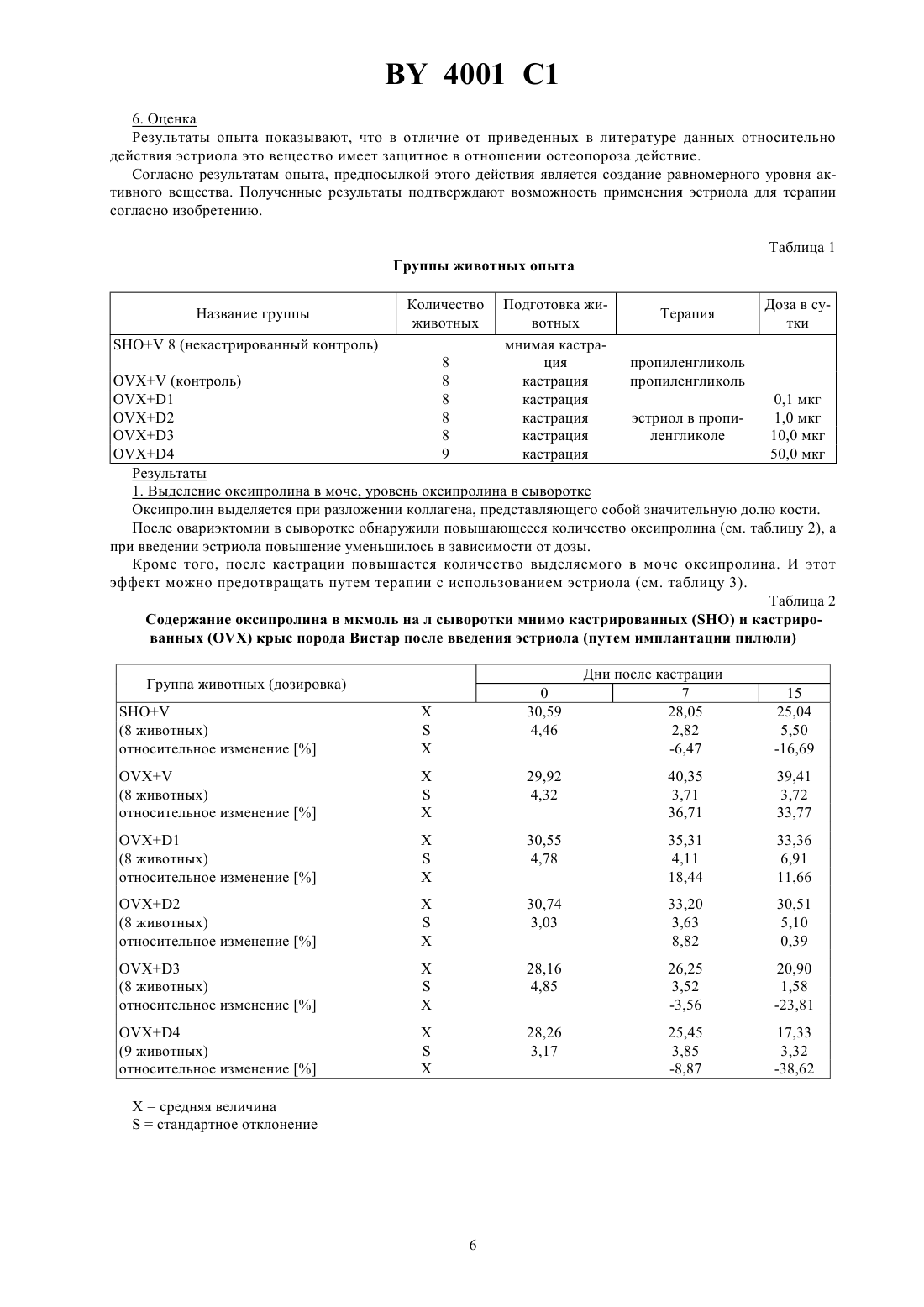
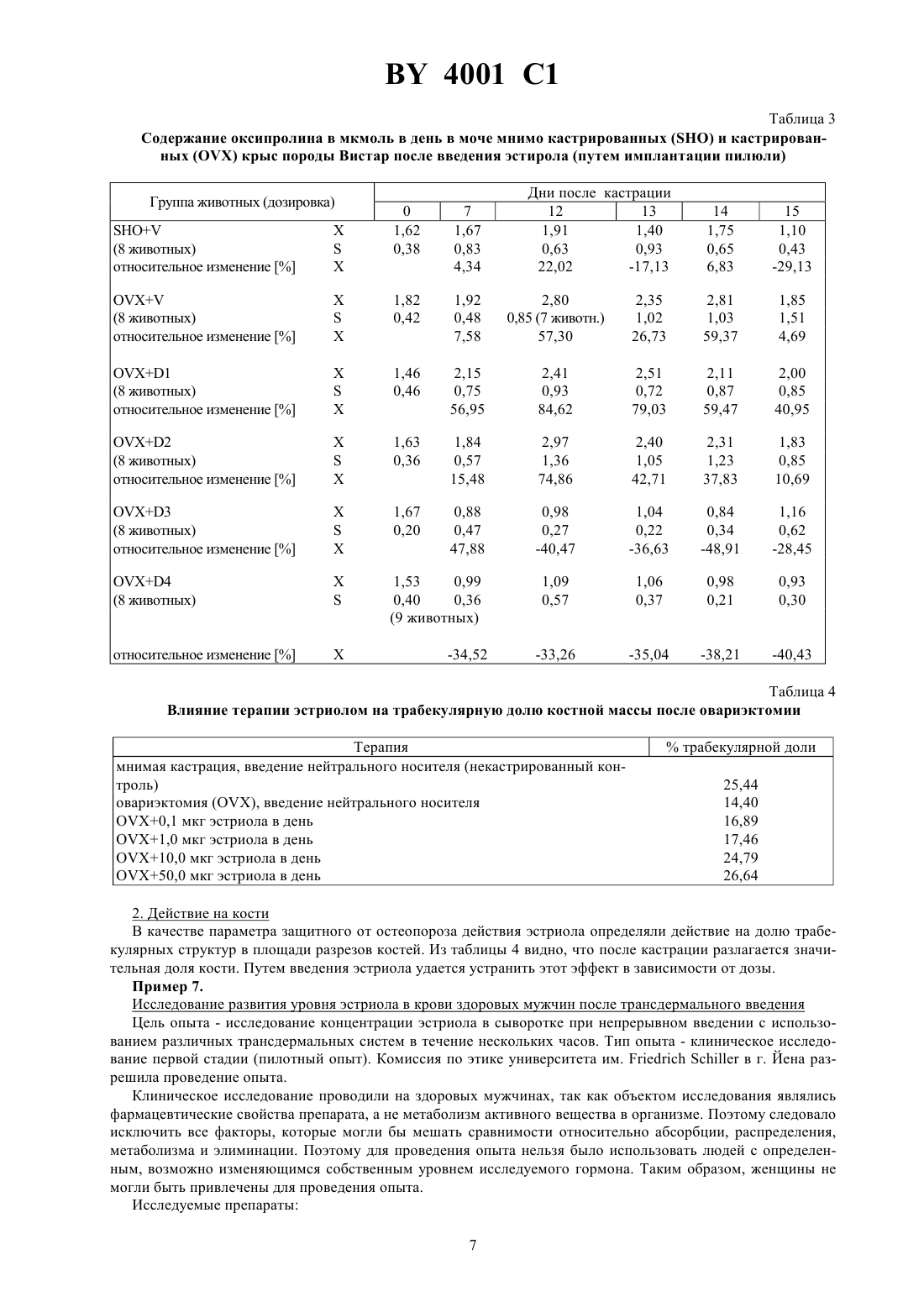
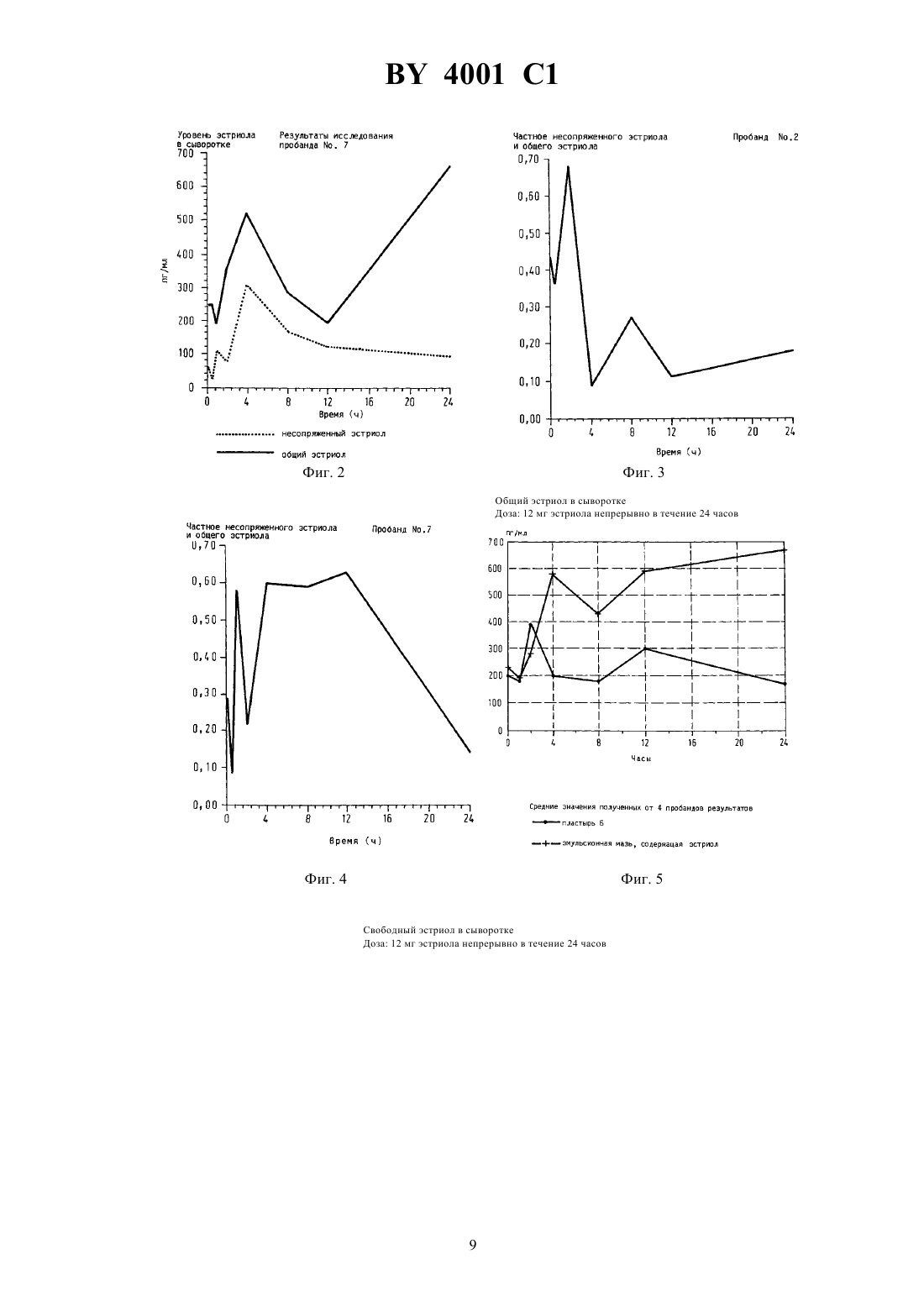
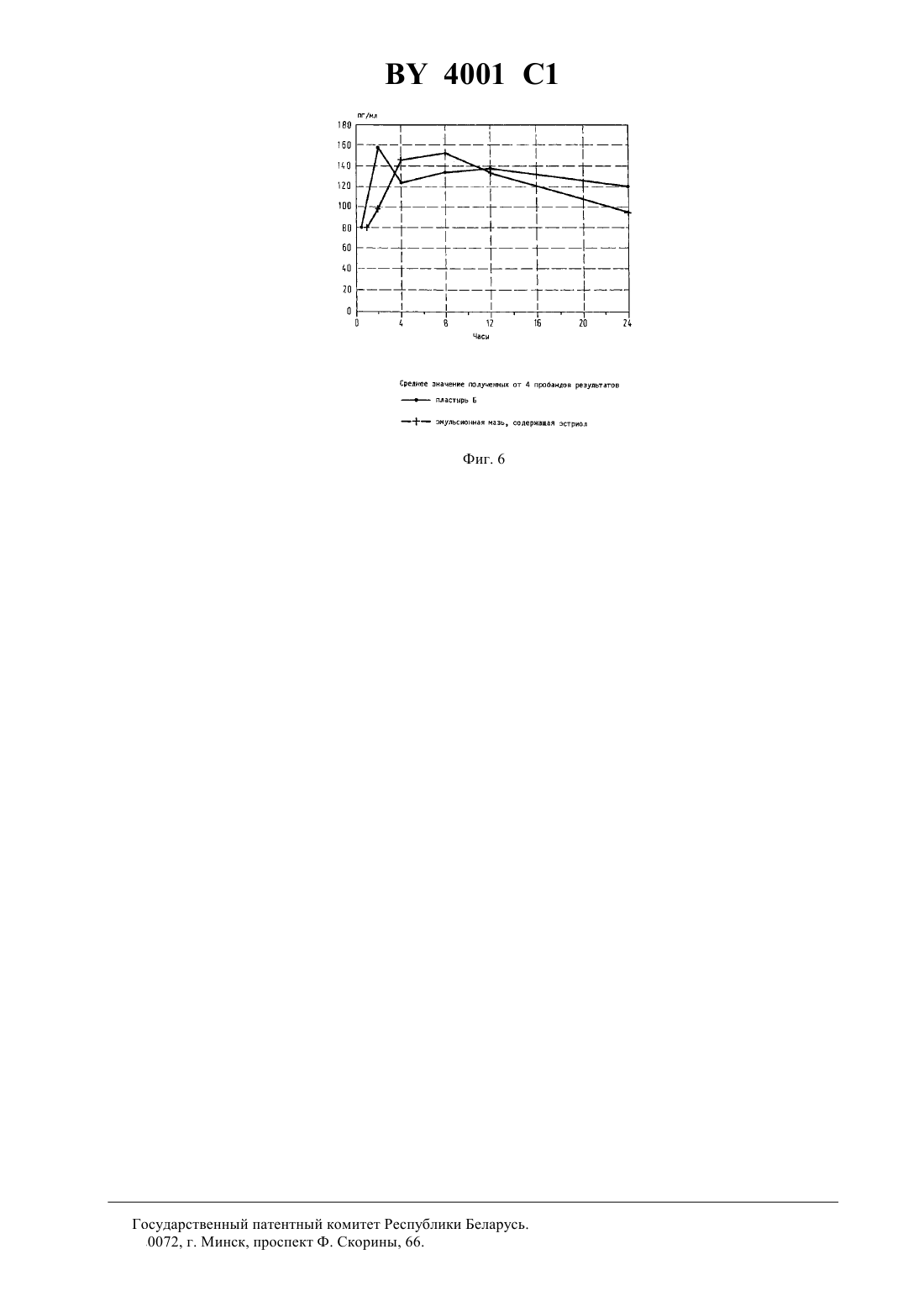
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ ТРАНСДЕРМАЛЬНЫЙ ПРЕПАРАТ ПРОДЛЕННОГО ДЕЙСТВИЯ С АНТИОСТЕОПОРОТИЧЕСКОЙ АКТИВНОСТЬЮ(71) Заявитель ЭнТек Гезельшафт фюр эндокринологише Технологи мбХ(73) Патентообладатель ЭнТек Гезельшафт фюр эндокринологише Технологи мбХ(57) 1. Трансдермальный препарат продленного действия с антиостеопоротической активностью, содержащий эстроген в качестве активного вещества и по меньшей мере один носитель или вспомогательное вещество,обеспечивающие непрерывное выделение эстрогена в течение по меньшей мере 24 часов, отличающийся тем, что в качестве эстрогена он содержит эстриол в эффективном количестве. 2. Препарат по п. 1, отличающийся тем, что он выполнен в виде пластыря. 3. Препарат по п. 1, отличающийся тем, что он выполнен в виде пластыря, непрерывно выделяющего 525 мг эстриола по меньшей мере в течение 24 часов. 4. Препарат по п. 1, отличающийся тем, что он выполнен в виде мази. 5. Препарат по п. 1, отличающийся тем, что он выполнен в виде мази, непрерывно выделяющей 5-25 мг эстриола по меньшей мере в течение 24 часов. Изобретение относится к области терапии климактерического остеопороза, в частности к трансдермальному препарату продленного действия с антиостеопоротической активностью. Известен трансдермальный препарат продленного действия с антиостеопоротической активностью, содержащий эстриол и, по меньшей мере, один носитель или вспомогательное вещество 1. Недостаток известного трансдермального препарата продленного действия для терапии или профилактики климактерического остеопороза заключается в том, что он может оказывать побочные действия - может вызывать рак матки (карцинома эндометрия) или рак груди. В связи с этим известны решения, в которых предлагается для снижения опасности возникновения рака использовать эстрадиол в сочетании с гестагеном. Однако, соответствующее сочетание эстрогена и гестагена не проявляет положительный эффект в отношении опасности возникновения карциномы молочной железы (см. ,, -,, 592, стр. 357-362, 1990 г., и ,ипод редакцией . , .и . , ., 592, стр. 286-294, 1990 г.). Задача изобретения заключается в создании трансдермального препарата продленного действия с антиостеопоротической активностью, позволяющего эффективно бороться с климактерическим остеопорозом без возникновения повышенной опасности заболевания раком, в частности раком груди. Указанная задача решается в предлагаемом трансдермальном препарате продленного действия с антиостеопоротической активностью, содержащем эстроген в качестве активного вещества и, по меньшей мере,один носитель или вспомогательное вещество, обеспечивающие непрерывное выделение эстрогена в течение, по меньшей мере, 24 часов, при этом в качестве эстрогена он содержит эстриол в эффективном количестве. Согласно предпочтительной форме реализации изобретения, предлагаемый препарат продленного действия выполнен в виде пластыря. Данный пластырь предпочтительно содержит непроницаемый несущий слой,на который нанесен слой продленного действия, содержащий эстриол в эффективном количестве, например,1-60 мас. , причем несущий слой выполнен клейким или снабжен адгезионным слоем, и снимаемый защитный слой, перекрывающий слой продленного действия и адгезионный слой. При этом пластырь может содержать способствующее пенетрации вещество. При этом слой продленного действия и возможно имеющийся адгезионный слой предпочтительно выполнены с обеспечением непрерывного выделения эстриола в количестве 5-25 мг в течение, по меньшей мере, 24 часов. Несущий слой выполнен предпочтительно в качестве алюминиевой фольги. Пластырь можно получать,например, следующим образом Раствор или суспензию 1-60 мас.активного вещества, максимум 45 мас. , способствующего пенетрации вещества и 30-70 мас.клея на основе полиакрилата перерабатывают в пластырь. При этом может использоваться клей на основе полиакрилата или в растворенном в соответствующем летучем растворителе виде, или в диспергированном в воде виде. Смесь активного вещества, способствующего пенетрации вещества и клея наносят на плоскую непроницаемую фольгу, сушат и снабжают снимаемым защитным слоем,выполненным, например, из силиконизированной ткани или бумаги, снабженной слоем из фторполимера. В том случае, если используется полиакрилат и после сушки системы не достигается эффект прилипания к коже, то перед нанесением снимаемого защитного слоя систему можно дополнительно покрывать адгезионным клеем. Обычно в качестве такого адгезионного клея также используют полиакрилат. Этот способ имеет то преимущество, что при изготовлении или при дополнительном связывании под давлением (с помощью каландра) слои системы можно приводить в тесный контакт друг с другом. Таким образом получают слоистую систему (ламинат), в которой и из которой может диффундировать активное вещество. Однако, аналогичным образом в качестве материалов слоя продленного действия и адгезионного слоя можно также использовать силиконы, полиуретаны и натуральные и синтетические каучуки. В качестве добавок к слою продленного действия могут использоваться также целлюлозы и/или их производные, поливинильные соединения, силиконы или силикаты. Согласно другой предпочтительной форме выполнения изобретения, предлагаемый препарат продленного действия выполнен в качестве мази. Мазь предпочтительно представляет собой эмульсионную систему воды в масле. Это означает, что активное вещество в виде водного раствора, который в случае необходимости может содержать способствующее пенетрации вещество, добавляют к обычно используемой в фармации основе типа воды в масле. Готовую мазь обычно помещают в емкости объемом одной отдельной дозы, на 2 4001 1 пример в углубления, выполненные в пригодной пленке, предпочтительно в пластмассовой пленке. Углубления, заполненные мазью, далее закрывают снимаемым защитным слоем, причем готовая упаковка подобна упаковке типа . В качестве простой основы типа воды в масле в рамках настоящего изобретения может применяться, например, мазь на основе спирта шерстяного воска. При использовании соответствующего эмульгатора могут использоваться сложные эмульсии. Возможно использование систем масло-вода-масло или вода-масловода-масло, если они обеспечивают выполнение задачи изобретения, а именно непрерывное выделение эстриола, по меньшей мере, в течение 24 часов, предпочтительно в количестве 5-25 мг. Иногда эмульсия может не обеспечивать эффективное прилипание к коже и/или проникновение в нее. В таком случае можно добавлять дополнительные пригодные вещества, способствующие адгезии или пенетрации. Например, в качестве способствующего пенетрации вещества используют одно- или многовалентный спирт. Для приготовления мази можно использовать раствор или суспензию активного вещества, содержащий(ую) 1-50 мас.эстриола, причем раствор или суспензия может быть сгущен(а) стабилизатором в количестве примерно до 12 мас. . В качестве стабилизатора может быть использован, например, стеарат алюминия, бентонит, кремневая кислота или двуокись кремния. Высокая антиостеопоротическая активность, достигаемая с помощью предлагаемого трансдермального препарата продленного действия, является неожиданной потому, что в официальном докладе общества(Немецкое общество по вопросам эндокринологии) специально указывается на отсутствие эффективности эстриола относительно профилактики остеопороза (см.-, 85, стр. 1322-1325, в частности стр. 1325, левая колонка, 1988 г.). Кроме того, из опытов, проведенныхи др. (. , .М. , . , . , А.С. С и . , 1979 г.,,1, стр. 179) в течение 2 лет на 80 женщинах в периоде после наступления менопаузы, вытекает, что при пероральном введении в дозах, составляющих 12 мг в день, эстриол не проявлял никакого защитного действия против остеопороза. Отсутствие эффективности эстриола против остеопороза в качестве общедоступного знания вошло в учебники (см., например,. ,, издательство, 1992 г., где на стр. 356 дословно написано Эстриол не имеет никакого действия при профилактике остеопороза, но, однако, пригоден для лечения психовегетативных симптомов и локальных симптомов на генитальных органах). В отличие от уровня техники изобретение основывается на неожиданных результатах исследований, показывающих, что при непрерывном введении эстриола в количестве 5-25 мг, предпочтительно 10-15 мг, в течение, по меньшей мере, 24 часов возникает неожиданный эффект относительно содержания активного вещества в крови. Эстрогены, в том числе и эстриол, дезактивируются в печени путем связывания с глюкуроновой кислотой или сульфатом. Все полученные ранее результаты указывают на чрезвычайно быструю дезактивацию эстриола (см. . ,,12, стр. 171-197, в частности, фиг. 4, стр. 178, 1990 г.). Однако, согласно изобретению, выявлено, что при непрерывном введении данного активного вещества устанавливается в основном неизменное содержание в крови его активной формы. Очевидно, оно независимо от общего количества свободного и связанного вещества (см. ниже) и регулируется эндогенным установочным механизмом, активируемым непрерывным введением. Таким образом, при трансдермальном введении в рамках исследований, проведенных на людях (см. пример 7), получили неожиданный результат после повышения концентрации неметаболизированного гормона в крови,наблюдаемого в начале исследования, концентрация далее оставалась практически неизменной в течение 24 часов. В то же время, общее количество свободного активного вещества и неактивного метаболита значительно изменялось (см. рис. 1 и 2). При этом измеряемые концентрации свободного эстриола в крови находились в пределах, соответствующих физиологическим концентрациям эстрогенных гормонов в цикле женщины (примерно 50-350 мг на мл). Поэтому такая концентрация пригодна для оптимального устранения нехватки эстрогена. Ввиду неизменной концентрации свободного эстриола при изменяющейся концентрации общего количества эстриола полагается, что при непрерывном введении часть метаболизированного эстриола вновь превращается в исходную форму, причем такое превращение видимо регулируется с обеспечением в конечном итоге неизменной концентрации. Дополнительное доказательство того, что наблюдаемый согласно изобретению эффект не линейно зависим от концентрации, а является результатом активного установочного механизма, представляет значительно изменяющееся частное несвязанного эстриола и общего эстриола (см. рис. 3 и 4). В рамках настоящего изобретения это можно рассматривать как механизм защиты организма против передозировки. Достигаемый с помощью изобретения эффект и преимущества предлагаемого препарата подтверждаются результатами исследований, проведенных с использованием предпочтительных трансдермальных форм (см. примеры). В то время, как общее количество свободного и метаболизированного активного вещества изменялось на величину, находящуюся между 2 и 3 в зависимости от системы, совершенно неожиданным обра 3 4001 1 зом наблюдался практически неизменный уровень свободного эстриола, который является решающим для антиостеопоротического действия (см. рис. 5 и 6). Благодаря достигаемому с помощью изобретения эффекту, возможно также применение предлагаемого препарата для или в рамках постоянной гормонозамещающей терапии. Поскольку при постоянном введении с одной стороны эффективно осуществляется лечение или профилактика остеопороза, а с другой стороны наблюдаемое при введении обычных эстрогенов канцерогенное действие не проявляется, более того, можно даже ожидать антиканцерогенную активность. Изобретение поясняется нижеследующими примерами. Пример 1. Получение пластыря трансдермального действия Пластырь получают из двух исходных жидкостей, которые имеют нижеуказанный состав Исходная смесьКомпоненты количество (мг) на один пластырь эстриол 12 этанол 70 вода 18 Исходная смесьКомпоненты количество (мг) на один пластырь 1001) 14100 14 краситель 2 глицерол 5 вода 65 1)(торговый продукт) представляет собой производные полиметакриловой кислоты, причемлегко растворим в кишечном соке,мало растворим в кишечном соке. Смешивают исходные смесии , и полученную таким образом смесь известным способом, например путем наливания или с помощью ракеля, тонким слоем наносят на алюминиевую фольгу и сушат до получения пленки. На высушенную пленку тонким слоем наносят соответствующее адгезионное вещество (например, изторговый продукт, представляющий собой полиакрилат), в результате чего получают ламинат, который затем вновь сушат. Также можно получить ламинат посредством так называемого метода переноса путем каландрирования пленки, содержащей лекарственные средства, с соответствующим адгезионным слоем. До применения трансдермального пластыря адгезионный слой известным способом может быть покрыт защитной фольгой. Трансдермальный пластырь хорошо прилипает к коже человека, даже если она имеет незначительный волосяной покров. Содержащиеся в таком пластыре активные вещества могут диффундировать через адгезионный слой, проникать в кожу и действовать согласно системе. Пример 2. Получение пластыря трансдермального действия Повторяют пример 1 с той разницей, что вместо 100 и 100 используют 34 М 15/3 А в общем количестве, составляющем 28 г ( - торговый продукт, содержит триглицериды с 30 каприловой кислоты, 18 каприновой кислоты, 12 лауриновой кислоты и 40 стеариновой кислоты). Пример 3. Получение эмульсионной мази трансдермального действия Непроницаемую фольгу подвергают деформации путем воздействия тепла и/или растяжения до получения углублений емкостью 0,1-3,0 мл. Углубление заполняют мазью, содержащей раствор или суспензию активного вещества в концентрации 12 мг эстриола на 0,5 г мази. Мазь получают нижеописанным образом из двух разных исходных смесей. Исходная смесьКомпоненты количество (мг) на 0,5 г мази эстриол 12 этанол 7 вода 81 Исходная смесьКомпоненты количество (мг) на 0,5 г мази вода 30 глицерол 15 триглицериды со средней длиной цепи 55 мазь на основе спирта шерстяного воска 400 4001 1 Смесьгомогенизируют и нагревают до температуры 60 С на водяной бане. Затем смесь , также нагретую при температуре 60 С, порциями смешивают со смесью . В углубления, выполненные в фольге вышеуказанным образом, помещают по 0,5 г мази и закрывают снимаемым защитным слоем. Препараты, согласно примерам 1-3, обеспечивают непрерывное выделение содержащегося в них эстриола в течение, по меньшей мере, 24 часов. Препараты нижеследующих примеров 4 и 5 тоже выполняют указанные условия. Пример 4 (мазь). Состав мази Компоненты количество (мг) в 1 г мази эстриол 20 диспергатор 80 лиофильная основа 250 вода до 1 г Пример 5 (пластырь). Состав пластыря Компоненты количество (мг) в один пластырь эстриол 20 диспергатор 50 эмульгатор 40 полиакрилат 150 Пример 6. Исследование действия эстриола на остеопороз у крыс после овариэктомии 1. Цель исследования В течение 2 недель после овариэктомии крысы-самки породы Вистар возрастом 11 недель теряют значительную часть массы костей. Цель исследований - проверить, возможно ли предотвратить это явление путем введения эстриола. При этом данный гормон необходимо было вводить с обеспечением равномерного уровня гормона в течение всего периода исследования. В основу такого опыта была положена гипотеза, что наблюдаемое до сих пор отсутствие действия эстриола на кости обусловлено тем, что количество эстриола в крови при двухкратном дневном введении, например перорально, находилось на критическом уровне. Кроме того, необходимо было проверить, обладает ли эстриол как частичный антагонист эстрогена недостаточным действием на кости. 2. Животные и метод В лабораторию поставлялись крысы-самки породы Вистар возрастом 9-10 недель, которых содержали в пластмассовых емкостях, закрытых решеткой из стальной проволоки, в обычных условиях при температуре 22 С 4 С и при следующем световом режиме 14 часов светло, 10 часов темно. Животных кормили стандартным кормом (рецептура 13) и обеспечивали питьевой водой по желанию. Опыт начали при достижении животными возраста 11 недель, причем их вес составил примерно 220 г. 3. Введение исследуемого соединения Подкожная установка осмотических насосов типа 2002 емкостью резервуара 200 мкл, расход 0,5 мл в час. Раствор исследуемого соединения в пропиленгликоле. Общий период исследований - 3 недели, а именно неделя до овариэктомии и 2 недели (15 дней) после нее. В течение недели до овариэктомии, то есть перед потерей костной ткани, в качестве исходных величин определяли характерные параметры, а именно содержание оксипролина в суточной моче, а также содержание оксипролина и концентрацию эстриола в сыворотке. Для определения содержания оксипролина в моче собирали мочу в течение суток. Для этого животных раз в неделю отсаживали в специальные клетки, позволяющие собирать достаточно чистую мочу, отделенную от помета. Затем определяли содержание оксипролина в собранной моче каждого отдельного животного. Кроме того, определяли содержание оксипролина и эстриола в сыворотке, получаемой путем взятия крови из ретробульбарного венозного сплетения в день овариэктомии, а также на 7-ой и 14-ый день после овариэктомии. 4. Исследование действия эстриола на кости В конце опыта животных умерщвляли, и для гистологического исследования фиксировали бедренную кость, резали посредством микротома и исследовали качественно и количественно относительно морфологических признаков. 5. Результаты опыта Результаты опыта приведены в таблицах 1-4. 5 4001 1 6. Оценка Результаты опыта показывают, что в отличие от приведенных в литературе данных относительно действия эстриола это вещество имеет защитное в отношении остеопороза действие. Согласно результатам опыта, предпосылкой этого действия является создание равномерного уровня активного вещества. Полученные результаты подтверждают возможность применения эстриола для терапии согласно изобретению. Таблица 1 Группы животных опыта Название группы Подготовка животных мнимая кастрация кастрация кастрация кастрация кастрация кастрация 8 пропиленгликоль(контроль) 8 пропиленгликоль 1 8 0,1 мкг эстриол в пропи 2 8 1,0 мкг ленгликоле 3 8 10,0 мкг 50,0 мкг 4 9 Результаты 1. Выделение оксипролина в моче, уровень оксипролина в сыворотке Оксипролин выделяется при разложении коллагена, представляющего собой значительную долю кости. После овариэктомии в сыворотке обнаружили повышающееся количество оксипролина (см. таблицу 2), а при введении эстриола повышение уменьшилось в зависимости от дозы. Кроме того, после кастрации повышается количество выделяемого в моче оксипролина. И этот эффект можно предотвращать путем терапии с использованием эстриола (см. таблицу 3). Таблица 2 Содержание оксипролина в мкмоль на л сыворотки мнимо кастрированныхи кастрированныхкрыс порода Вистар после введения эстриола (путем имплантации пилюли) Группа животных (дозировка) Дни после кастрации 7 28,05 2,82 4001 1 Таблица 3 Содержание оксипролина в мкмоль в день в моче мнимо кастрированныхи кастрированныхкрыс породы Вистар после введения эстирола (путем имплантации пилюли) Группа животных (дозировка) Дни после кастрации 12 13 1,91 1,40 0,63 0,93 22,02 Таблица 4 Влияние терапии эстриолом на трабекулярную долю костной массы после овариэктомии Терапия мнимая кастрация, введение нейтрального носителя (некастрированный контроль) овариэктомия , введение нейтрального носителя 0,1 мкг эстриола в день 1,0 мкг эстриола в день 10,0 мкг эстриола в день 50,0 мкг эстриола в день 2. Действие на кости В качестве параметра защитного от остеопороза действия эстриола определяли действие на долю трабекулярных структур в площади разрезов костей. Из таблицы 4 видно, что после кастрации разлагается значительная доля кости. Путем введения эстриола удается устранить этот эффект в зависимости от дозы. Пример 7. Исследование развития уровня эстриола в крови здоровых мужчин после трансдермального введения Цель опыта - исследование концентрации эстриола в сыворотке при непрерывном введении с использованием различных трансдермальных систем в течение нескольких часов. Тип опыта - клиническое исследование первой стадии (пилотный опыт). Комиссия по этике университета им.в г. Йена разрешила проведение опыта. Клиническое исследование проводили на здоровых мужчинах, так как объектом исследования являлись фармацевтические свойства препарата, а не метаболизм активного вещества в организме. Поэтому следовало исключить все факторы, которые могли бы мешать сравнимости относительно абсорбции, распределения,метаболизма и элиминации. Поэтому для проведения опыта нельзя было использовать людей с определенным, возможно изменяющимся собственным уровнем исследуемого гормона. Таким образом, женщины не могли быть привлечены для проведения опыта. Исследуемые препараты 7 4001 1 Исследовали три разных трансдермальных препарата, каждый из которых содержал 12 мг эстриола. Эти препараты представили собой 1. Тип -22 (пластырь А) Пластырь диаметром 32 мм, защитный слой из алюминия, носитель эстриола и адгезионный слой из полиакрилата (носительторговый продукт фирмыполиакрилат, адгезионный слойторговый продукт фирмыполиакрилат). Эстриол был распределен в носителе и отчасти в адгезионном слое в молекулярно дисперсном виде. 2. Тип -34 (пластырь Б) Пластырь диаметром 56 мм, защитный слой из ткани, имеющей цвет кожи, в центре - носитель эстриола в форме диска диаметром 36 мм, состоит из губкообразного материала (34 М 15/3 А), в котором эстриол содержится в мелкораспределенном виде. Адгезионный слой состоит из обычно используемого для пластырей клея. 3. Тип эстриол- (эмульсионная мазь, содержащая эстриол) Мазь с концентрацией активного вещества, составляющей 12 мг эстриола на 0,5 г. Вид и объем опыта Составили 3 группы здоровых мужчин в возрасте от 18 до 55 лет, причем в каждую группу вошли 4 человека. Каждому из пробандов в каждой из групп вводили один из указанных исследуемых препаратов, причем пластыри наклеили в зоне ягодичной мышцы, а мазь втирали на лбу. Исследуемые препараты вводили одновременно, и группы составили по случайным номерам, присвоенным пробандам по очереди прибытия. Кровь брали при введении и через 0,5 1, 2, 4, 8, 12 и 24 часа после введения. Проведение опыта Исследуемые препараты ввели пробандам в день проведения опыта в 8 часов утра. Для определения уровня эстриола через указанные выше промежутки времени взяли по 10 мл крови, путем центрифугирования отделили сыворотку, которую до определения концентрации гормона хранили при -20 С. Определение содержания гормона Определение общего содержания эстриола и эстриола, имеющегося в свободном виде, осуществляли методом(-) в соответствующей лаборатории больницыг.. Для определения общего эстриола сыворотки вначале инкубировали в среде глюкорондиазы и сульфатазы, а выделившийся двусопряженный эстриол экстрагировали простым эфиром. Определение поосуществляли на имеющихся в буфере экстрактах. Свободный эстриол сразу выделяли из необработанных проб,и его количество определяли описанным методом. Оценка Определяли концентрацию свободного эстриола и общее содержание эстриола в сыворотке пробандов. Общий эстриол включает свободный и метаболизированный эстриол. У каждого пробанда определяли следующие параметры- площадь под кривой концентрации в зависимости от промежутка времени, причем данную площадь рассчитывают с помощью трапецеидального правила (в промежутках 0-24 часов после введения) С - максимальная концентрация Т - время, проходящее до достижения максимальной концентрации. Результаты Неожиданный результат опыта заключался в том, что кривая общего количества активного вещества в крови и метаболизированного активного вещества (общий эстриол в сыворотке) после трансдермального введения посредством всех систем имеет неравномерную форму (см. рис. 1 и 2 для пробандов 2 и 7). При этом абсолютно неожиданно после повышения в начале опыта концентрация терапевтически активного неметаболизированного гормона (несопряженного эстриола) оставалась почти неизменной в течение суток(см. рис. 1 и 2 для пробандов 2 и 7), а частное свободного (несопряженного) эстриола и общего эстриола сильно колебалось (см. рис. 3 и 4 для пробандов 2 и 7). При этом интересно, что определяемые концентрации свободного эстриола в крови соответствовали естественной концентрации эстрогенных гормонов в цикле женщины (примерно 50-350 пг на мл). Поэтому следует исходить из того, что все исследуемые трансдермальные системы годятся для оптимального устранения нехватки эстриола. Это верно тем более, что разные препараты вызвали разные концентрации общего эстриола в сыворотке(см. рис. 5), причем концентрации, достигаемые при использовании трансдермальной эмульгированной мази продленного действия, в 2-3 раза выше концентрации, достигаемой при применении пластыря 34 (пластыря Б), но неожиданно наблюдался практически одинаковый уровень того эстриола, который важен в организме (несопряженного эстриола в сыворотке) (см. рис. 6). Результат вышеописанного опыта дает основания полагать, что при непрерывном введении эстриола эндогенные механизмы регулируют уровень эстриола в крови, что приводит к преимуществам использования эстриола при гормонозамещающей терапии, в частности при терапии климактерического остеопороза, так как, например, передозировка практически исключена. 8 Фиг. 3 Общий эстриол в сыворотке Доза 12 мг эстриола непрерывно в течение 24 часов Фиг. 5 Свободный эстриол в сыворотке Доза 12 мг эстриола непрерывно в течение 24 часов Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66. 10
МПК / Метки
МПК: A61K 9/70, A61K 9/06, A61K 31/565
Метки: трансдермальный, продленного, антиостеопоротической, действия, препарат, активностью
Код ссылки
<a href="https://by.patents.su/10-4001-transdermalnyjj-preparat-prodlennogo-dejjstviya-s-antiosteoporoticheskojj-aktivnostyu.html" rel="bookmark" title="База патентов Беларуси">Трансдермальный препарат продленного действия с антиостеопоротической активностью</a>
Предыдущий патент: Состав аэрозоля, находящийся под давлением
Случайный патент: Механизм для преобразования возвратно-поступательного движения во вращательное или наоборот