Гелевая форма фармацевтической композиции, обладающей антагонистической активностью в отношении гонадотропин-высвобождающего гормона, и способ ее получения
Номер патента: 12818
Опубликовано: 28.02.2010
Авторы: БАУЭР, Хорст, РОМАЙС, Петер, РЁСЛЕР, Бертхольд, РАЙССМАНН, Томас
Текст
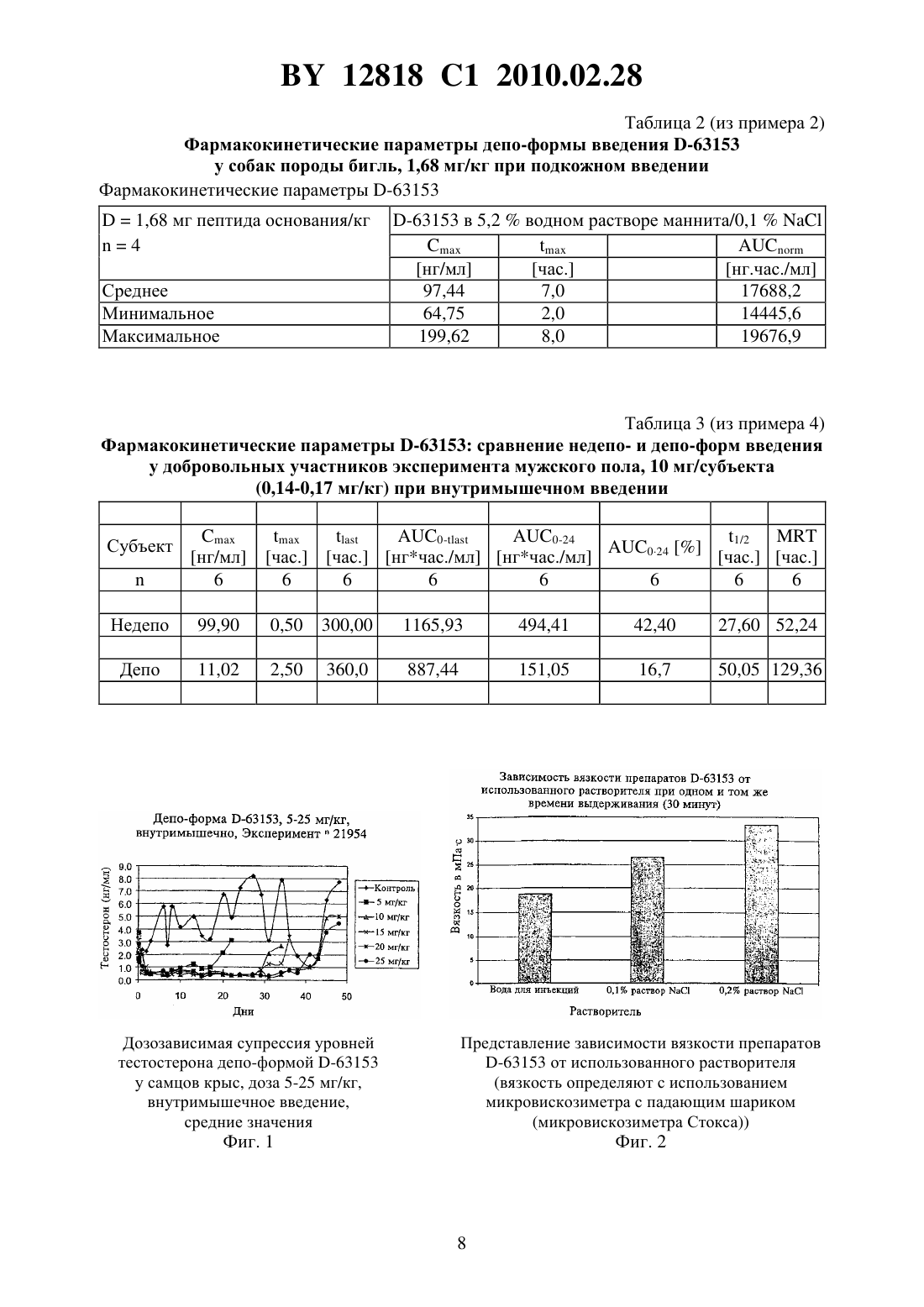
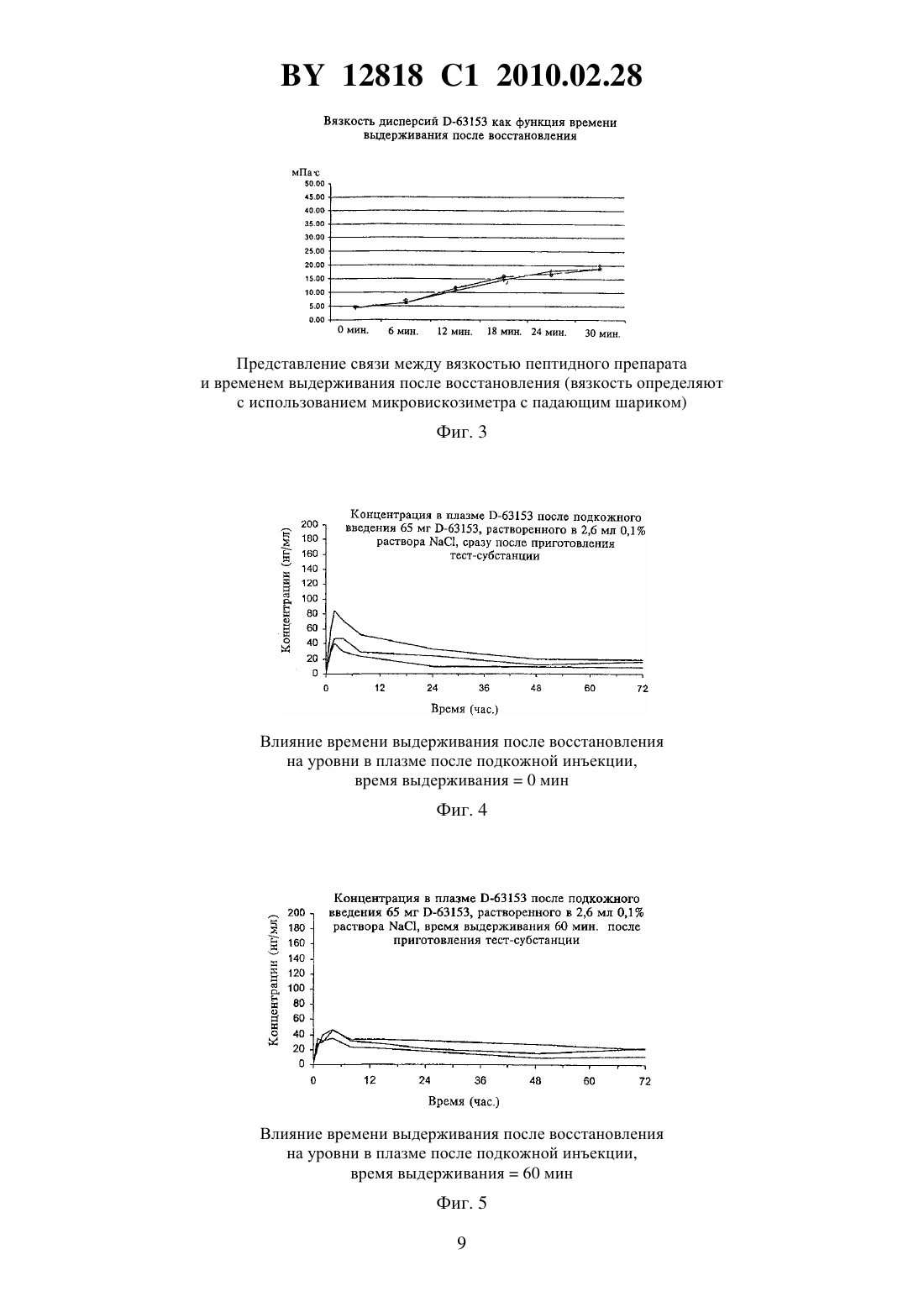
(51) МПК (2006) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ГЕЛЕВАЯ ФОРМА ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ,ОБЛАДАЮЩЕЙ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ГОНАДОТРОПИН-ВЫСВОБОЖДАЮЩЕГО ГОРМОНА, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ(57) 1. Гелевая форма фармацевтической композиции, обладающей антагонистической активностью в отношении гонадотропин-высвобождающего гормона, полученная в период 120 мин до или непосредственно перед введением путем смешивания фармацевтически активного лиофилизированного ионного пептида -63153 в количестве 25 мг/мл композиции и 0,1 водного раствора . 2. Гелевая форма фармацевтической композиции по п. 1, отличающаяся тем, что получена в период от 10 до 120 мин перед введением. 3. Гелевая форма фармацевтической композиции по п. 1, отличающаяся тем, что получена в период от 15 до 60 мин перед введением. 4. Способ получения гелевой формы фармацевтической композиции по п. 1, заключающийся в том, что смешивают лиофилизированный ионный пептид -63153 в количестве 25 мг/мл композиции и 0,1 водный раствор . Изобретение относится к фармацевтическим формам для введения с замедленным высвобождением активного ингредиента, содержащим по меньшей мере один фармакологически активный пептид, и способу их получения. Известны следующие фармацевтические формы для введения с замедленным высвобождением фармацевтически активного пептида 1. Фармацевтические формы для введения с микроинкапсулированными и/или инкорпорированными, и/или конъюгированными фармацевтически активными пептидами в биоразрушаемой полимерной матрице, ., 6, 167-76,1987,,., . ., 1, 2-10, 1984, патент 9832423, патент 2001078687. 2. Фармацевтические формы для введения, включающие плохорастворимые в воде комплексы фармацевтически активного пептида и органической молекулы носителя, такие как, например, полисахариды патент 20000473234. 12818 1 2010.02.28 В обоих случаях ферментное разложение матрицы или комплекса приводит к замедленному высвобождению пептида. Изготовление известных микрокапсул или частиц и нерастворимых комплексов пептидных соединений требует очень сложных процедур, направленных на получение форм для введения с замедленным высвобождением активного ингредиента. Обычно нерастворимые и плохорастворимые соединения получают путем осаждения пептидного соединения с помощью противоиона. Осадок собирают фильтрацией и центрифугированием,промывают водой и высушивают. В большинстве случаев твердый материал затем превращают в порошок. Все отдельные стадии способа получения должны осуществляться в условияхв асептическом рабочем помещении, чтобы было возможно таким образом обеспечить стерильность конечного продукта. В способах получения микрокапсул используют более или менее токсичные органические растворители с целью растворения разрушаемой полимерной матрицы. Затем растворенную активную субстанцию и полимеры матрицы эмульгируют. После выпаривания органического растворителя частицы или микрокапсулы отделяют, промывают и высушивают. Было обнаружено, что формы для введения с замедленным высвобождением активного ингредиента для фармацевтически активных пептидов получаются при восстановлении лиофилизированного пептидного соединения с помощью низкоконцентрированного раствора неорганической соли перед введением, причем количество лиофилизированного пептидного соединения выбирается таким образом, чтобы раствор или суспензия пептида после восстановления были высококонцентрированными. В качестве возможного объяснения допускают, что в данных условиях происходит контролируемое образование агрегатов пептидных соединений, который или которые демонстрируют задержанное растворение. Результатом этого является обнаруженное замедленное высвобождение данного активного ингредиента в систему кровообращения. В этом случае образование агрегатов приводит к формированию коллоидной дисперсии, на вязкость которой влияют концентрация пептидного соединения, концентрация соли и время выдерживания после восстановления. Согласно данному изобретению, фармацевтические гелевые препараты, включающие по меньшей мере одно фармацевтически активное ионное пептидное соединение, смешивают в заданном количестве величины(в мг пептида/мл препарата) с водным раствором соли неорганической или уксусной кислоты в заданной концентрации величины(в мас./об. ), причем показано, что введение возможно сразу после смешивания или после периода выдерживания до приблизительно 120 минут, и величинаможет быть выбрана тест-способом А, включающим стадии применения различных количеств Х (число различных количеств , где 1) (в мг) пептида в виде смеси с изотоническим водным раствором маннита на или в тест-системе и выбора количества(в мг пептида/мл смеси), которое обеспечивает в эксперименте наиболее благоприятные уровни пептида в плазме крови в тест-системе относительно С (максимальная концентрация в плазме крови) и(время до достижения Сах), и концентрацияможет быть выбрана тест-способом В, включающим стадии применения количества(в мг пептида/мл смеси) пептида в виде смеси с водными растворами, которые отличаются по концентрации(число различных концентраций , где 1) (в мас./об. ) на или в тест-системе, и выбор концентрации(в мас./об. ) определен как концентрация, при которой эксперимент приводит в результате к самому высокому значению для концентрации в плазме, , где С(самая низкая концентрация пептида в плазме, при которой пептид еще имеет адекватный фармацевтический эффект в эксперименте). В то же самое время это влияет на времядо тех пор, пока не будет достигнута самая высокая концентрация в плазме, при которой получают. 2 12818 1 2010.02.28 В рамках данного изобретения фармацевтически активное ионное пептидное соединение может быть одно-, двух- или поливалентным катионным или анионным пептидом,или одно-, двух- или поливалентным амфолитическим пептидом. Фармацевтически активное ионное пептидное соединение может иметь длину от 5 до 20 аминокислот, предпочтительно от 8 до 12 аминокислот. Фармацевтически активное ионное пептидное соединение по изобретению представляет собой аналог(рилизинг-гормон гонадотропина), предпочтительно антагонист . Фармацевтически активное ионное пептидное соединение может быть выбрано из группы, состоящей из цетрореликса, тевереликса, абареликса, ганиреликса, азалина В, антида, детиреликса, рамореликса, дегареликса, -63153 или их фармацевтически активных солей или смесей. Неорганическая соль или соль уксусной кислоты представляет собой физиологически переносимую соль. Водная неорганическая соль или соль уксусной кислоты может быть выбрана из группы, состоящей из хлорида натрия, хлорида кальция, хлорида магния, ацетата натрия, ацетата кальция и ацетата магния. Смесь фармацевтически активного ионного пептидного соединения и водного раствора неорганической соли или соли уксусной кислоты представляет собой жидкую суспензию или полутвердую дисперсию. Количествофармацевтически активного ионного пептидного соединения должно лежать в интервале от приблизительно 5 до приблизительно 50 мг/мл общего количества фармацевтического препарата или от приблизительно 10 до приблизительно 50 мг/мл общего количества фармацевтического препарата. Предпочтительно количествофармацевтически активного ионного пептидного соединения лежит в интервале от приблизительно 20 до приблизительно 30 мг/мл общего количества фармацевтического препарата и наиболее предпочтительно находится в области приблизительно 25 мг/мл. Концентрацияводного раствора соли неорганической или уксусной кислоты равна или меньше 0,9(мас./об.) или лежит в интервале от приблизительно 0,01 до приблизительно 0,9(мас./об.), предпочтительно в интервале от приблизительно 0,05 до приблизительно 0,5(мас./об.), а наиболее предпочтительно составляет приблизительно 0,1(мас./об.). Объектом изобретения является гелевая форма фармацевтической композиции, обладающей антагонистической активностью в отношении гонадотропин-высвобождающего гормона, полученная в период 120 мин до или непосредственно перед введением путем смешивания фармацевтически активного лиофилизированного ионного пептида -63153 в количестве 25 мг/мл композиции и 0,1 водного раствора . Гелевую форму фармацевтической композиции по изобретению предпочтительно получают в период от 10 до 120 мин перед введением, наиболее предпочтительно в период от 15 до 60 мин перед введением. В рамках настоящего изобретения способ получения гелевой формы фармацевтической композиции включает стадии А) объединения количества(в мг/мл конечного препарата) по меньшей мере одного фармацевтически активного ионного пептидного соединения в лиофилизированной форме и водного раствора соли неорганической или уксусной кислоты в концентрации со значением(мас./об. ) и В) смешивания компонентов. Объектом изобретения является способ получения гелевой формы фармацевтической композиции по изобретению, заключающийся в том, что смешивают лиофилизированный ионный пептид -63153 в количестве 25 мг/мл композиции и 0,1 водный раствор . Способ получения гелевой формы фармацевтической композиции далее может включать стадию стерилизации пептидного препарата путем облучения -лучами или пучком электронов. Кроме того, способ осуществляется с использованием асептических процедур. 3 12818 1 2010.02.28 Изобретение также может быть осуществлено в виде набора для получения гелевой формы фармацевтической композиции, включающего предварительно заданное количество(в мг/мл конечного препарата) фармацевтически активного ионного пептидного соединения в лиофилизированной форме и водный раствор соли неорганической или уксусной кислоты в предварительно заданной концентрации(мас./об.). В частности, набор представляет собой активное пептидное соединение -63153 в лиофилизированной форме, причем лиофилизат -63153 может дополнительно содержать манит и хлорид натрия. Гелевая форма фармацевтической композиции по изобретению предназначена для лечения пациента путем ее введения пациенту подкожно или внутримышечно с помощью шприца. Способ лечения пациента с помощью гелевой формы фармацевтической композиции по изобретению демонстрирует замедленную фармацевтическую активность в течение по меньшей мере 4 недель или 8 недель и даже 12 недель. Настоящее изобретение особенно актуально для осуществления способов лечения гормонозависимых нарушений у пациентов, а также способов лечения рака простаты, рака молочной железы, миом матки, эндометриоза, преждевременного полового созревания,для модификации репродуктивной функции у пациентов посредством подкожного или внутримышечного введения гелевой формы фармацевтической композиции, соответствующей вышеописанному изобретению, нуждающемуся в этом пациенту. Смесь фармацевтически активного ионного пептидного соединения и водного раствора неорганической соли или соли уксусной кислоты является молекулярно дисперсионной или коллоидной смесью, которая может иметь жидкую или полутвердую консистенцию. Коллоидная дисперсия образуется посредством восстановления, путем хранения или выдерживания после восстановления, и изменения ее вязкости как функции времени, и при этом улучшается воспроизводимость задержанного высвобождения активного ингредиента. Вследствие парентерального введения необходимо, чтобы пептидное соединение в виде порошка и раствор для восстановления были стерильными. Данное изобретение делает возможным легко получить суспензии с замедленным высвобождением активного ингредиента пептидного соединения, предпочтительно антагониста . Их получают посредством восстановления высококонцентрированного лиофилизата пептидного соединения, содержащего маннит, с использованием разбавленного раствора неорганической соли (например, раствора хлорида натрия). Образование фармацевтического препарата, соответствующего изобретению, кроме того, зависит от следующих параметров 1). концентрация пептидного соединения в растворе после восстановления 2). концентрация неорганической соли в растворе, используемом для восстановления 3). время выдерживания раствора после восстановления и полученная при этом степень агрегации, которая отражается в повышении вязкости. Высокая концентрация пептидного соединения приводит к его агрегации, которая может контролироваться добавлением раствора неорганической соли. Растворимость пептидного соединения снижается по мере повышения концентрации соли. Коллоидные свойства становятся более преобладающими, чем свойства раствора, как это ясно из повышения вязкости даже в такой степени, что приводит к образованию геля. Гель в этой связи представляет собой бикогерентную систему, состоящую из агрегата пептида в качестве твердой фазы и воды в качестве жидкой фазы. Соответствующие изобретению формы для введения для фармацевтически активных пептидов с замедленным высвобождением активного ингредиента всегда перед введением находятся в форме геля. 4 12818 1 2010.02.28 При идеальном интервале концентрации соли в комбинации с подходящим количеством пептидных соединений может быть получено замедленное высвобождение активного ингредиента в течение 4 недель или больше. Для получения раствора неорганической соли можно использовать любую физиологически переносимую неорганическую соль, предпочтительно хлорид натрия. Восстановление происходит при использовании низкоконцентрированного раствора соли. В данном случае концентрация должна быть равна или меньше приблизительно 0,9(мас./об.), предпочтительно находиться в интервале от приблизительно 0,01 до приблизительно 0,9 , особенно предпочтительно в интервале от приблизительно 0,05 до приблизительно 0,5(мас./об.), очень предпочтительно составлять приблизительно 0,1(мас./об.). Низкоконцентрированный раствор хлорида натрия с концентрацией хлорида натрия,лежащей в интервале от приблизительно 0,05 до приблизительно 0,5(мас./об.), предпочтительно приблизительно 0,1(мас./об.) является предпочтительным. Пептид в препарате представляет собой соединение фармакологически активного пептида, который может быть одно-, двух- или поливалентным катионным или анионным пептидом. Пептид может состоять из от 5 до 20 аминокислот в длину, более предпочтительно из 8-12 аминокислот в длину. Более конкретно пептидное соединение представляет собой аналог , и аналогявляется антагонистом . Примерами аналоговявляются цетрореликс, тевереликси соавт.,, 47,107, 1993, абареликси соавт.,, 2, 265, 1998, ганиреликси соавт., . . ., 35, 3942, 1992, азалии В, антид, А-75998 и соавт.,. . ., 84, 953, 1995, детереликси соавт., . . . ., 74,399, 1992, -68439, рамореликси , .. . ., 119,457, 1993, дегареликс.,и соавт., , 301, 95), -63153 (международная заявка РСТЕР 00/02165. Структуры вышеупомянутых аналоговприведены, например, в вышеупомянутых ссылках и следующих обзорных статьяхи соавт. Обзор по антагонистам,2,,и соавт., . ., 109, 2240,(1997). Соединение -63153 описано в числе других в немецкой патентной заявке 199 11 771.3. Физико-химические данные сведены на фиг. 6. Концентрация фармацевтически активного пептида может лежать в интервале от приблизительно 5 мг/мл до приблизительно 50 мг/мл, предпочтительно от приблизительно 10 мг/мл до приблизительно 50 мг/мл, особенно предпочтительно от приблизительно 20 мг/мл до приблизительно 30 мг/мл и очень особенно предпочтительно составлять приблизительно 25 мг/мл (млобщий объем конечной формы для введения). Все фармацевтически активные пептиды могут быть использованы в указанных концентрациях. Пептид -63153 является особенно предпочтительным. В соответствии со способом получения форм для введения для фармацевтически активных пептидов с замедленным высвобождением активного ингредиента по изобретению соль уксусной кислоты основания пептидного соединения полностью растворяют в водном растворе уксусной кислоты до образования прозрачного раствора. Раствор разбавляют водой для инъекций, которая содержит необходимое количество маннита для того,чтобы образовался изотонический раствор, который можно вводить. После стерилизации путем фильтрования раствора его разливают во флаконы и лиофилизируют. Раствор хлорида натрия (например, 0,1 ) используют для восстановления перед введением для того, чтобы, таким образом, контролировать агрегацию пептида и, вследствие этого, также растворимость. Восстановление осуществляют по мере необходимости при осторожном кручении или встряхивании, что нужно для того, чтобы избежать вспенивания. 5 12818 1 2010.02.28 Фармацевтические формы для введения, соответствующие изобретению, обеспечивают замедленную доставку пептидного соединения после введения формы для введения субъекту. Продолжительность и степень доставки можно варьировать путем изменения концентраций пептидного соединения и концентрации используемой соли. Время выдерживания после восстановления также является важным в плане высвобождения пептидного активного ингредиента. Время выдерживания составляет от приблизительно 0 до приблизительно 120 минут, предпочтительно от приблизительно 10 до приблизительной 120 минут, особенно предпочтительно от приблизительно 15 до 60 минут. Было обнаружено, что коллоидная система образуется путем изменений агрегации в период времени выдерживания и что повышается вязкость. При времени выдерживания,превышающем приблизительно 120 минут, никакого существенного дальнейшего изменения вязкости не наблюдается. Фармацевтические формы для введения, соответствующие изобретению, могут быть предпочтительно введены подкожно или внутримышечно . В случае внутримышечного введения инъекцию осуществляют, например, в большую ягодичную мышцу,предпочтительно в верхний наружный квадрант большой ягодичной мышцы. В случае подкожного введения инъекцию делают, например, в подкожный слой живота. Данное изобретение описано в деталях в примерах 1-7 без ограничения этим изобретения. Пример 1. 200 г чистого -63153 (в пересчете на свободное основание) растворяют в 3386,7 г водного раствора уксусной кислоты концентрации 30 с образованием прозрачного раствора. Добавляют 438,4 г маннита и растворяют при перемешивании. Раствор доводят до общего количества 20320 г водой для инъекций. После стерилизации раствора фильтрованием его разливают порциями по 10 мл во флаконы для лиофилизации. В результате, согласно способу, каждый флакон содержит 100 мг -63153 (свободного основания) и 109,6 мг маннита. Лиофилизат восстанавливают добавлением 4 мл раствора хлорида натрия в концентрации 0,1 и осторожно встряхивают (избегая вспенивания) для того, чтобы получить суспензию концентрации 25 мг/мл. Пример 2. Получают лиофилизаты, которые содержат 75 мг -63153 и восстанавливают 3 мл растворителя (25 мг -63153/мл). Восстановление осуществляют стерильной водой для инъекций (недепо-форма для введения, см. табл. 1) или 0,1(депо-форма для введения, см. табл. 2). Дозу для однократного введения 1,68 мг/кг инъецируют подкожно собакам породы бигль. Уровни -63153 в плазме измеряют в различные периоды времени после введения. Путем использования депо-форм для введения можно снизить максимальные уровни в плазме (Стах), тогда как площадь под кривой в основном поддерживается на стабильном уровне, что в результате приводит к депо-эффекту. Абсолютная биодоступность сохраняется в основном без изменений и по расчетам составляет 62 для недепо-форм для введения и 64,3 для депо-форми , 1991. Пример 3. Для тестирования -63153-депо в отношении активности супрессии тестостерона его инъекционно вводят в 5 различных дозах (5-25 мг/кг) внутримышечно самцам крыс. Депо-форму для введения получают путем ресуспендирования лиофилизата -63153 в стерильном растворев концентрации 0,1 . Уровень тестостерона измеряют до введения лекарственного препарата и в каждом случае через 4 часа, 8 часов и 24 часа после введения. Кроме того, уровень тестостерона определяют один раз в день в первую неделю после инъекции, а затем через день, в каждом случае до тех пор, пока уровень тестостеро 6 12818 1 2010.02.28 на не возвратится в пределы нормы. Контрольной группе вводят только раствор носителя фиг. 1). Во всех группах определяют дозозависимую супрессию уровней тестостерона. Супрессия продолжается от 17 дней (5 мг/кг) до 43 дней (20 мг/кг). Затем уровни тестостерона в течение нескольких дней входят в пределы нормы. Пример 4. 10 мг лиофилизатов -63153 восстанавливают в 4 мл стерильной воды для инъекций(недепо-форма для введения, 2,5 мг/мл -63153, клиническая фаза 1 а) и 100 мг лиофилизатов -63153 растворяют в 4 мл 0,1(депо-форма для введения, 25 мг/мл -63153,клиническая фаза 1). Добровольным участникам эксперимента мужского пола делают внутримышечные инъекции по 10 мг/субъекта. Уровни -63153 в плазме измеряют в различные периоды времени после введения (табл. 3). Результаты показывают, что депо-эффект может быть подтвержден как посредством более низких уровней Сах и 0.24 в плазме, так и посредством удлинения периода, 1/2 и, в особенности, увеличения(среднего времени удержания). Депо-форма для введения имеет почти такое же время 0, как недепо-форма для введения(887,44 нгчас./мл по сравнению с 1165,93 нгчас./мл), демонстрируя таким образом, что две композиции имеют близкую биодоступность. Высвобождение из депо-формы для введения замедлено, на что указывают более низкий уровень Сах и значение , которое более чем в два раза выше. Пример 5. Получают лиофилизаты, содержащие 65 мг и 100 мг -63153, и восстанавливают их растворителем с образованием в результате раствора, который имеет концентрацию 25 мг-63153/мл. Используемые растворители представлены водой для инъекций, 0,1 раствороми 0,2 раствором . Степень изменений коллоидных свойств растворов исследуют по их вязкости. Результаты суммируют на фиг. 2. Пример 6. Получают лиофилизаты, содержащие 100 мг -63153, и восстанавливают их растворителем с образованием в результате раствора, который имеет концентрацию 25 мг/мл. С целью описания изменения коллоидной системы, которая образуется после восстановления, на фиг. 3 приведена вязкость как функция времени выдерживания или времени хранения после восстановления. Пример 7. Получают лиофилизаты, содержащие 65 мг -63153, и восстанавливают их 2,6 мл раствораконцентрации 0,1 , и полученный раствор в одном случае подкожно вводят собакам сразу (время выдерживания 0 минут) (фиг. 4) и в другом случае подкожно вводят собакам (фиг. 5) через один час после восстановления (время выдерживания 60 минут). Уровни -63153 измеряют в течение 72 часов. Коллоидную систему получают путем изменений агрегации в течение времени выдерживания, за которое его вязкость возрастает. Это связано с небольшим изменением в графиках уровней в плазме и в результате приводит к тому, что максимальная концентрация в плазме снижается и воспроизводимость графиков уровней в плазме улучшается. Таблица 1 (из примера 2) Фармакокинетические параметры недепо-формы введения -63153 у собак породы бигль, 1,68 мг/кг при подкожном введении Фармакокинетические параметры -631531,68 мг пептида основания/кг 4 Среднее Минимальное Максимальное-63153 в 5,2 водном растворе маннита ах 12818 1 2010.02.28 Таблица 2 (из примера 2) Фармакокинетические параметры депо-формы введения -63153 у собак породы бигль, 1,68 мг/кг при подкожном введении Фармакокинетические параметры -631531,68 мг пептида основания/кг 4 Среднее Минимальное Максимальное Таблица 3 (из примера 4) Фармакокинетические параметры -63153 сравнение недепо- и депо-форм введения у добровольных участников эксперимента мужского пола, 10 мг/субъекта(0,14-0,17 мг/кг) при внутримышечном введении Субъект Дозозависимая супрессия уровней тестостерона депо-формой -63153 у самцов крыс, доза 5-25 мг/кг,внутримышечное введение,средние значения Представление зависимости вязкости препаратов Представление связи между вязкостью пептидного препарата и временем выдерживания после восстановления (вязкость определяют с использованием микровискозиметра с падающим шариком) Влияние времени выдерживания после восстановления на уровни в плазме после подкожной инъекции,время выдерживания 0 мин Влияние времени выдерживания после восстановления на уровни в плазме после подкожной инъекции,время выдерживания 60 мин Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 10
МПК / Метки
МПК: A61K 38/08, A61P 5/00, A61K 9/06
Метки: фармацевтической, форма, композиции, гормона, активностью, получения, обладающей, гелевая, отношении, способ, гонадотропин-высвобождающего, антагонистической
Код ссылки
<a href="https://by.patents.su/10-12818-gelevaya-forma-farmacevticheskojj-kompozicii-obladayushhejj-antagonisticheskojj-aktivnostyu-v-otnoshenii-gonadotropin-vysvobozhdayushhego-gormona-i-sposob-ee-polucheniya.html" rel="bookmark" title="База патентов Беларуси">Гелевая форма фармацевтической композиции, обладающей антагонистической активностью в отношении гонадотропин-высвобождающего гормона, и способ ее получения</a>
Предыдущий патент: Скользящая стенка или скользящая дверь
Следующий патент: Способ создания смешанного культурфитоценоза в санитарно-защитной зоне промышленного предприятия
Случайный патент: Способ моделирования гнойно-некротического парапанкреатита в эксперименте