Фармакологический препарат для коррекции иммунной системы организма
Текст
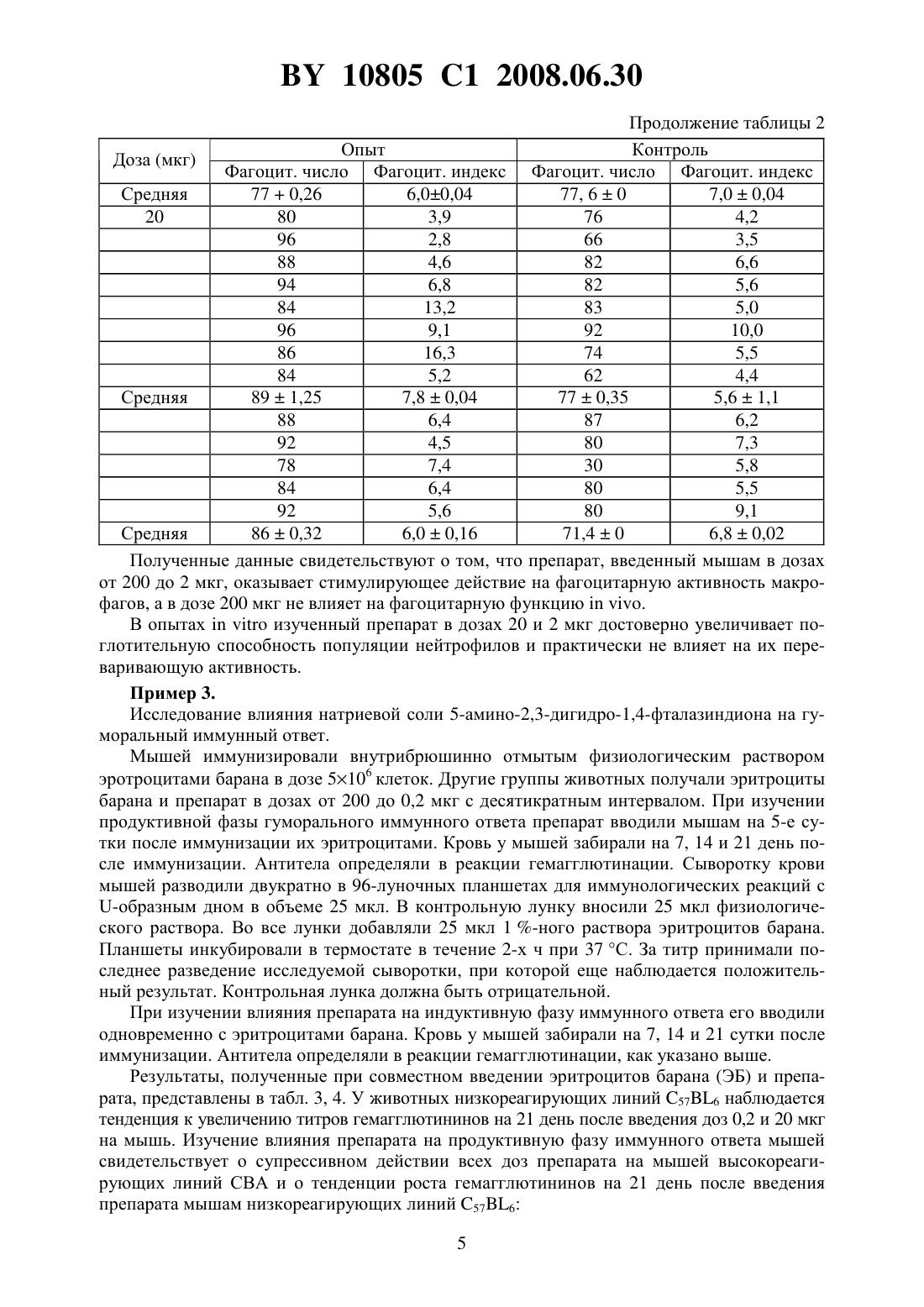
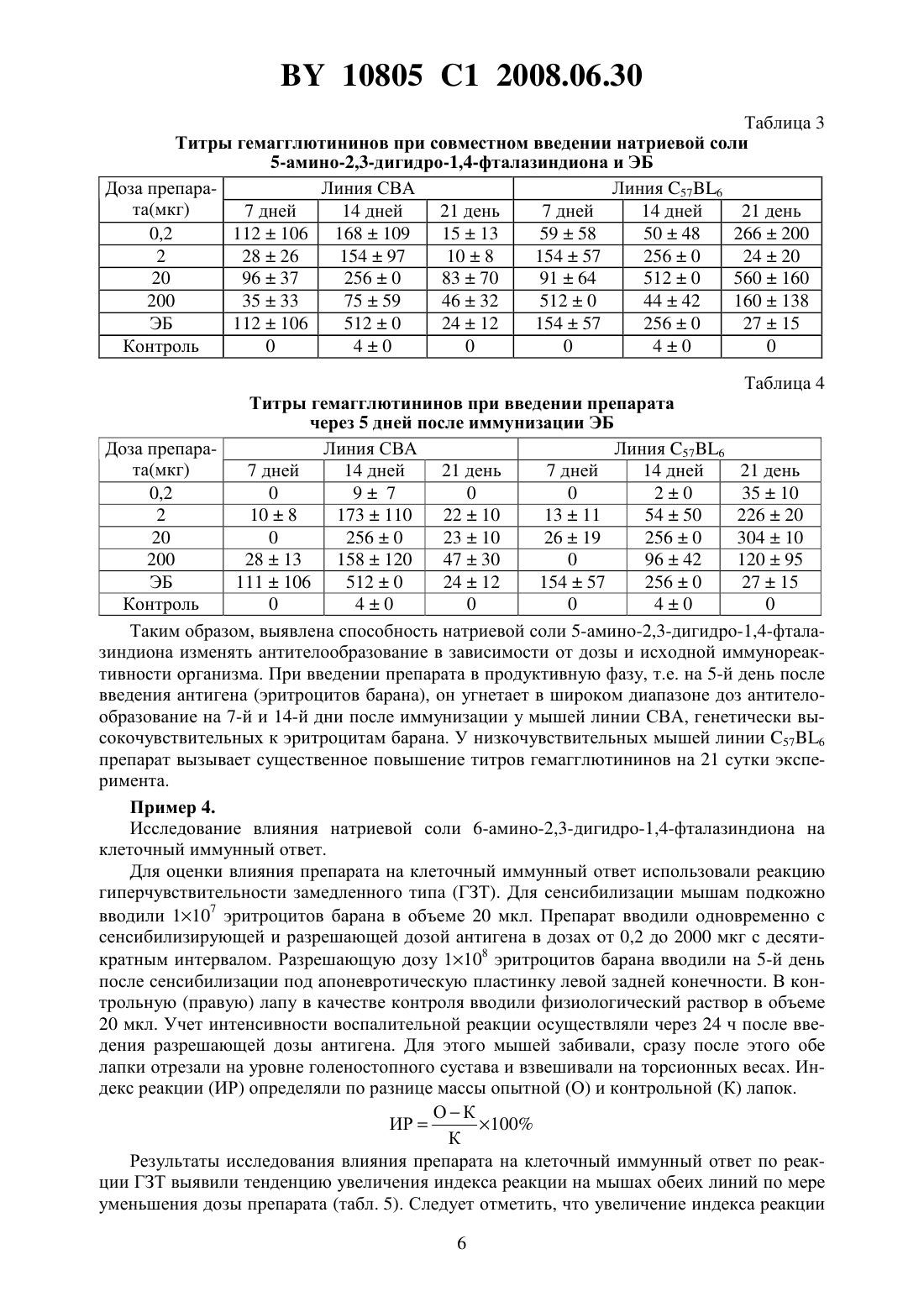
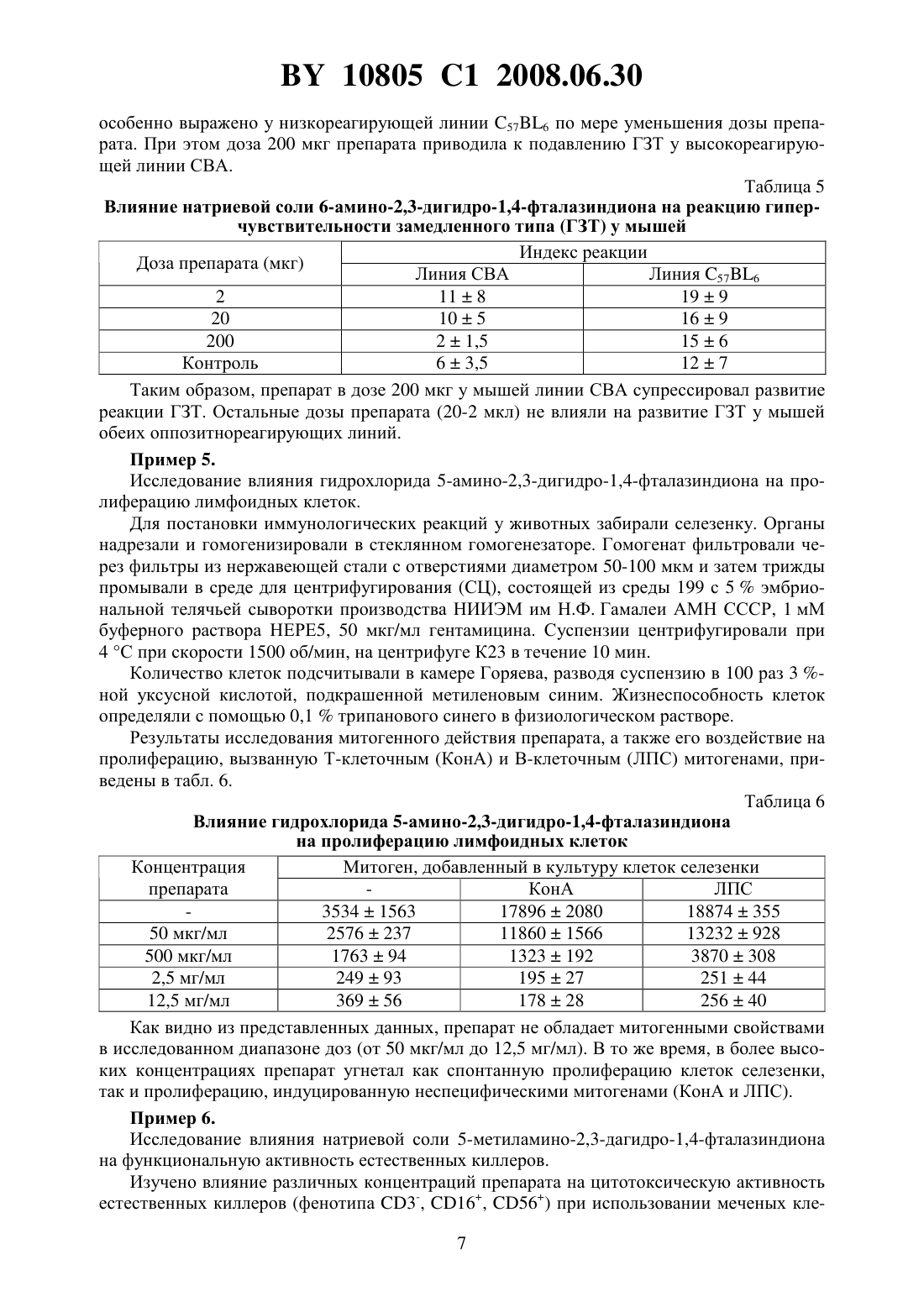
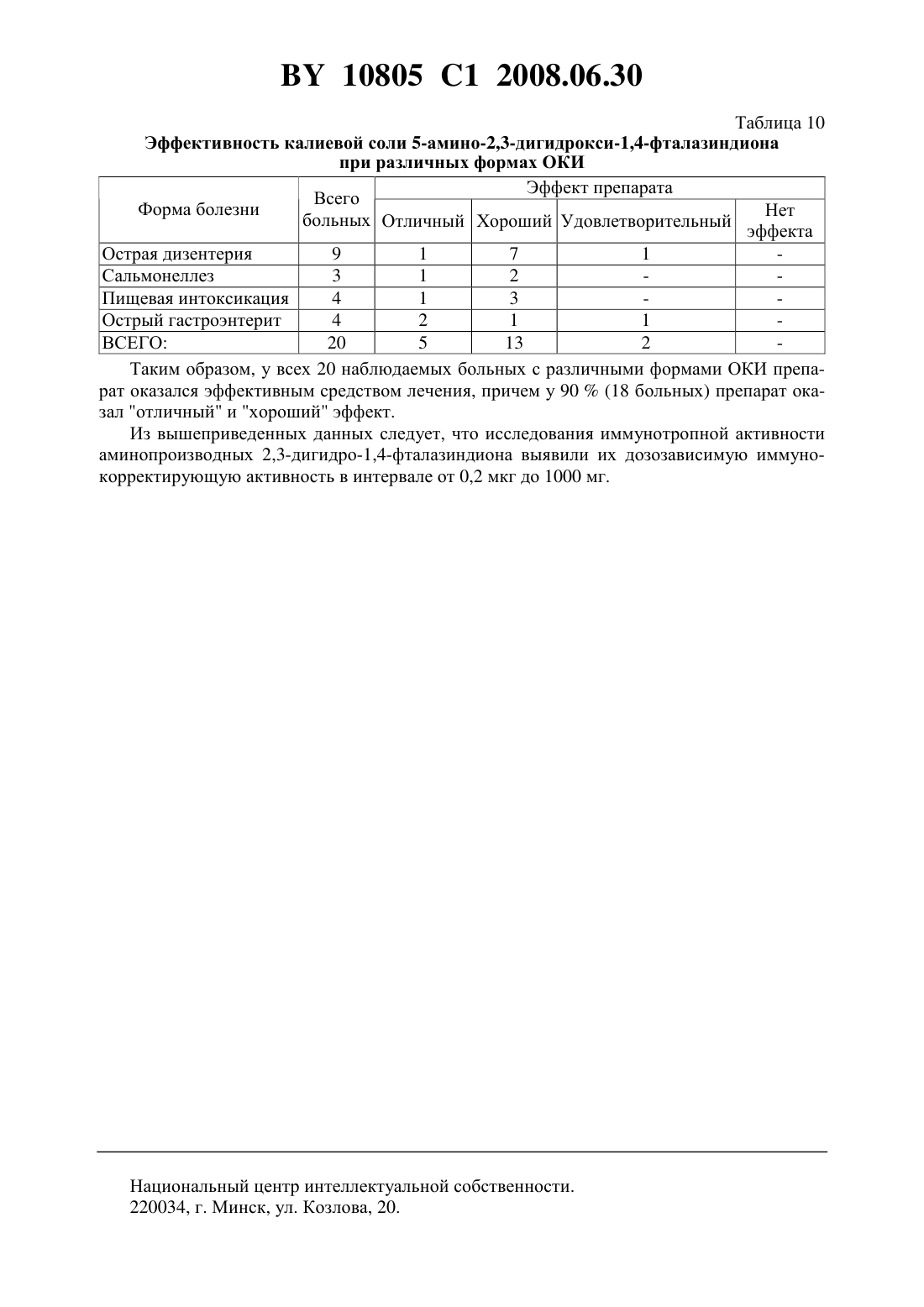
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ФАРМАКОЛОГИЧЕСКИЙ ПРЕПАРАТ ДЛЯ КОРРЕКЦИИ ИММУННОЙ СИСТЕМЫ ОРГАНИЗМА(71) Заявители Закрытое акционерное общество Центр современной медицины Медикор Жилов Валерий Хажмуратович(72) Автор Жилов Валерий Хажмуратович(73) Патентообладатели Закрытое акционерное общество Центр современной медицины Медикор Жилов Валерий Хажмуратович(57) 1. Фармакологический препарат для коррекции иммунной системы организма, отличающийся тем, что содержит аминопроизводное 2,3-дигидрофталазин-1,4-диона общей формулы где 1, 2 - водород, С 1-С 6-алкил или фенил,или его фармакологически приемлемую соль. 2. Фармакологический препарат по п. 1, отличающийся тем, что содержит литиевую,калиевую, натриевую, кальциевую, бариевую, магниевую соль или соль серебра 5-амино 2,3-дигидрофталазин-1,4-диона. 3. Фармакологический препарат по п. 1, отличающийся тем, что содержит литиевую,калиевую, натриевую или кальциевую соль 6-амино-2,3-дигидрофталазин-1,4-диона. 4. Фармакологический препарат по п. 1, отличающийся тем, что содержит гидрохлорид 5-амино-2,3-дигидрофталазин-1,4-диона. 5. Фармакологический препарат по п. 1, отличающийся тем, что содержит 5-метиламино-2,3-дигидрофталазин-1,4-дион или 6-метиламино-2,3-дигидрофталазин-1,4-дион. 6. Фармакологический препарат по п. 1, отличающийся тем, что содержит 5-диметиламино-, 5-дибутиламино-, 6-диэтиламино- или 6-дипропиламино-2,3-дигидрофталазин-1,4-дион или его фармакологически приемлемую соль. 7. Фармакологический препарат по п. 1, отличающийся тем, что содержит натриевую соль 6-фениламино-2,3-дигидрофталазин-1,4-диона. 10805 1 2008.06.30 8. Способ коррекции иммунной системы организма, отличающийся тем, что вводят фармакологический препарат по любому из пп. 1-8 в дозе от 0,2 мкг до 1000,0 мг. Изобретение относится к новой современной области медицины и ветеринарии - иммунологии и может быть применено для профилактики и лечения различных заболеваний,называемых иммунопатологией, в частности, таких, как токсикоинфекционные, онкологические, аллергические и другие. Известен широкий круг различных препаратов, обладающих иммуностимулирующей либо иммунодепрессивной активностью. В частности, к иммуностимулирующим препаратам относятся такие известные препараты как тактивин, декарис, дибазол и др., к иммунодепрессивным - меркаптопурин, циклофосфамид и др. Однако большинство известных препаратов обладает однонаправленным действием на иммунную систему. Известно, что иммуномодулирующей активностью обладает 2-амино-1,2,3,4-тетрагидрофталазин-1,4-диона натриевая соль дигидрат, которая вводится пациентам при слабой реакции клеточного иммунитета, например, при наличии злокачественных новообразований, вызывая активацию макрофагов, интерлейкинов и других острофазных белков. Данный препарат применяется в диапазоне дозировок 10-1000 мг и вводится в виде инъекций,например, по 100 мг в 1 мл воды либо перорально, например, по 1000 мг препарата в изотоническом растворе патент РФ 2113222, МПК А 61 К 31/04, 1998. Настоящее изобретение представляет собой фармакологический препарат для коррекции иммунной системы организма с применением широкой группы фармакологически приемлемых солей аминопроизводных 2,3-дигидро-1,4-фталазин-диона в эффективной дозе,составляющей 0,2 мкг - 1000 мг. Новое изобретение отличается от прототипа тем, что увеличивает число иммунокорректирующих аминофталазиндионовых соединений и значительно расширяет их область применения как иммунодепрессантов, так и иммуностимуляторов в медицине и ветеринарии при использовании значительно более широкого, чем в прототипе, интервала эффективных доз, как иммунодепрессантов. В качестве иммунокорректоров в настоящем изобретении используются известные фармакологически приемлемые химические соединения, применяемые ранее по другому назначению, например фунгициды патент США 2,654,689, НПК 514-248, 1953), имеющие следующую общую формулу где,- водород, С 1-С 6-алкил или фенил. К таким иммуноактивным соединениям данной группы, например, относятся, К, ,соли 6-амино-2,3-дигидрофталазина -1,4-диона 5-амино-2,3-дигидрофталазина-1,4-диона гидрохлорид 5-метиламино-2,3-дигидрофталазин-1,4-дион или 6-метиламино-2,3-2,3-дигидрофталазин-1,4-дион 5-диметиламино-, 5-дибутиламино-, 6-диэтиламино- или 6-дипропиламино- 2,3-дигидрофталазин-1,4-дион или его фармакологически приемлемую соль 6-фениламино-2,3-дигидрофталазин-1,4-диона. 2 10805 1 2008.06.30 Эффективный интервал доз от 0,2 мкг до 1000 мг подбирался экспериментальным путем. Выбор в конкретном случае той или иной эффективной дозы в указанном интервале зависит от характера заболевания, веса, возраста пациента (человека либо животного), что подтверждается нижеприведенными примерами и таблицами. Иммунокорректоры могут вводиться в организм в виде инъекций, перорально либо в составе наружных средств. Оценка иммуногенных и аллергенных свойств предлагаемых соединений проводилась в соответствии с методическими рекомендациями Экспериментальное изучение иммунотропной активности фармакологических препаратов, Минздрава России Хаитов Р.М.,Гущин И.С., Пинегин Е.В., Зебрев А.И. // Ведомости фармакологического комитета. - 1999.1. - . 31-36. В работе были использованы мыши различных линий, в зависимости от применяемого метода исследования. Все мыши были получены из питомника Столбовая АМН РФ. При изучении образования антител и антителообразующих клеток использовали мышей линии СВА и С 576 весом 16-18 г. Действие соединенийна пролиферацию лимфоидных клеток и индукцию интерлейкина-2 оценивали, используя мышей линии /с, весом 16-18 г. Животные в контрольных и опытных группах были одного пола, одного веса. Каждая доза препарата испытывалась на 10 животных, всего было использовано более 800 мышей. Оценку аллергизирующего действия препаратов проводили на морских свинках, самках весом 250-300 г, полученных из Центрального питомника лабораторных животных АМН РФ. Всего использовано 70 морских свинок. Препараты вводили животным внутрибрюшинно и подкожно. Образование антител и антителообразующих клеток исследовали на модели бараньих эритроцитов, находящихся в растворе Олсвера. Эритроциты получены из питомника института полимиелита и вирусных энцефалитов им. М.П. Чумакова. Изобретение иллюстрируется следующими примерами Пример 1. Исследование влияния кальциевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона на неспецифическую резистентность организма. Мышам линии 576 вводили препарат внутрибрюшинно в дозах от 200 до 0,2 мкг с десятикратным интервалом в 0,5 мл физиологического раствора за 2 ч до заражения мышей. Мышей заражали / в дозе 1104 микробных клеток, другую группу животных заражали . шт. 264 в дозе 1108 микробных клеток. Контролем служили мыши, зараженные той же дозой микробной культуры, но не получавшие препарата. Гибель мышей учитывали ежедневно в течение 10 дней. В результате эксперимента было установлено, что влияние препарата на неспецифическую резистентность мышей линии 576 зависело от введения дозы и инфекционной модели. При заражении мышей . препарат в дозе от 200 до 2 мкг на мышь не влияет на резистентность организма мышей, и продолжительность жизни их была такой же, как и в контроле (табл. 1). Таблица 1 Оценка влияния кальциевой соли 5-амино-2,3-дигидрофталазиндиона на неспецифическую резистентность мышей, зараженных . Доза Число мышей Гибель мышей (дни) Средняя про 1 2 3 4 5 6 7 препарадолжительность Заражение . шт. 264. доза 108 микр. клеток та (мкг) жизни 200 10 10 1,0 20 10 10 1,0 2 10 10 1,0 0,2 10 4 6 2,2 Контр. 10 10 1,0 3 10805 1 2008.06.30 Таким образом, доза 0,2 мкг обеспечивает достоверное (в 2,2 раза) увеличение продолжительности жизни экспериментальных животных при заражении Пример 2. Исследование влияния калиевой соли 5-амино-2,3-дигидрофталазин-1,4-диона на фагоцитози. Мышам линии 576 вводили различные дозы препарата от 200 до 2 мкг на мышь и через 24 ч их брали в опыт. Животным вводили внутрибрюшинно 3 мл 3 -ного раствора пептона и через 2 ч их умерщвляли с помощью хлороформа. Животных вскрывали в асептических условиях. Из брюшной полости отсасывали жидкость с помощью пастеровской пипетки, помещали ее в центрифужные пробирки и центрифугировали в течение 10 мин при 1000 об/мин. Осадок ресуспендировали в среде 199, подсчитывали число клеток в камере Горяева и доводили их до концентрации 2 млн/мл по нейтрофилам. К клеткам добавляли равный объем . шт. 1991 в соотношении 110 и инкубировали при 37 С в течение 30 мин. После инкубации делали мазки на предметном стекле, фиксировали в метаноле 20 мин и окрашивали краской Романовского-Гимза в течение 30 мин. Для изучения фагоцитарной активности макрофагов животных брали в опыт на 3 сутки после введения пептона. Далее опыт проводили, как в опыте с нейтрофилами. Учет результатов осуществляли под микроскопом при увеличении 90 раз. Подсчитывали фагоцитарный индекс и фагоцитарное число. Результаты эксперимента показали, что препарат в дозе 200 мкг не оказывает стимулирующего действия на фагоцитирующие клетки, а в дозах 2 мкг и 20 мкг - достоверно усиливал поглотительную способность клеток. Для оценки препарата на фагоцитозбрали кровь у донора из кубитальной вены в пробирку с гепарином из расчета 10 ЕД на 1 мл крови. К 2 мл крови приливали 0,8 мл 3 -ного раствора желатины, приготовленной на среде 199. Инкубировали пробирки в термостате 20 мин при 37 С. Затем в центрифужную пробирку отсасывали надосадочный слой, содержащий клеточные элементы. Клетки 2 раза промывали средой 199 центрифугированием при 1000 об/мин. К осадку добавляли 1 мл среды 199, подсчитывали в камере Горяева нейтрофилы, затем готовили на среде 199 клеточную суспензию, содержащую 2 млн. нейтрофилов в 1 мл. Одновременно готовили взвесь . в концентрации 20 млн/мл. Стафилококковую взвесь предварительно опсонизировали равным объемом пуловой сыворотки человека в течение 20 мин в термостате при 37 С, затем центрифугировали и отмывали средой 199. К смеси нейтрофилов и стафилококка (в равных объемах) добавляли препарат в концентрациях 200, 20 и 2 мкг на 1 мл, в контрольные пробирки - среду 199. После инкубации в термостате 30 мин при 37 С пробирки центрифугировали и готовили препараты по описанной выше методике. Сравнивали в опыте и контроле фагоцитарный индекс и фагоцитарное число. Полученные результаты представлены в табл. 2. Таблица 2 Влияние различных доз калиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона на фагоцитоз нейтрофиловОпыт Контроль Доза (мкг) Фагоцит. число Фагоцит. индекс Фагоцит. число Фагоцит. индекс 1 2 3 4 5 200 78 5,6 77 6,1 85 4,7 86 5,1 84 9,1 85 8,7 71 6,4 72 7,2 67 7,4 68 8,1 4 10805 1 2008.06.30 Продолжение таблицы 2 Опыт Контроль Доза (мкг) Фагоцит. число Фагоцит. индекс Фагоцит. число Фагоцит. индекс Средняя 770,26 6,00,04 77, 60 7,00,04 20 80 3,9 76 4,2 96 2,8 66 3,5 88 4,6 82 6,6 94 6,8 82 5,6 84 13,2 83 5,0 96 9,1 92 10,0 86 16,3 74 5,5 84 5,2 62 4,4 Средняя 891,25 7,80,04 770,35 5,61,1 88 6,4 87 6,2 92 4,5 80 7,3 78 7,4 30 5,8 84 6,4 80 5,5 92 5,6 80 9,1 Средняя 860,32 6,00,16 71,40 6,80,02 Полученные данные свидетельствуют о том, что препарат, введенный мышам в дозах от 200 до 2 мкг, оказывает стимулирующее действие на фагоцитарную активность макрофагов, а в дозе 200 мкг не влияет на фагоцитарную функцию. В опытахизученный препарат в дозах 20 и 2 мкг достоверно увеличивает поглотительную способность популяции нейтрофилов и практически не влияет на их переваривающую активность. Пример 3. Исследование влияния натриевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона на гуморальный иммунный ответ. Мышей иммунизировали внутрибрюшинно отмытым физиологическим раствором эротроцитами барана в дозе 5106 клеток. Другие группы животных получали эритроциты барана и препарат в дозах от 200 до 0,2 мкг с десятикратным интервалом. При изучении продуктивной фазы гуморального иммунного ответа препарат вводили мышам на 5-е сутки после иммунизации их эритроцитами. Кровь у мышей забирали на 7, 14 и 21 день после иммунизации. Антитела определяли в реакции гемагглютинации. Сыворотку крови мышей разводили двукратно в 96-луночных планшетах для иммунологических реакций с-образным дном в объеме 25 мкл. В контрольную лунку вносили 25 мкл физиологического раствора. Во все лунки добавляли 25 мкл 1 -ного раствора эритроцитов барана. Планшеты инкубировали в термостате в течение 2-х ч при 37 С. За титр принимали последнее разведение исследуемой сыворотки, при которой еще наблюдается положительный результат. Контрольная лунка должна быть отрицательной. При изучении влияния препарата на индуктивную фазу иммунного ответа его вводили одновременно с эритроцитами барана. Кровь у мышей забирали на 7, 14 и 21 сутки после иммунизации. Антитела определяли в реакции гемагглютинации, как указано выше. Результаты, полученные при совместном введении эритроцитов барана (ЭБ) и препарата, представлены в табл. 3, 4. У животных низкореагирующих линий 576 наблюдается тенденция к увеличению титров гемагглютининов на 21 день после введения доз 0,2 и 20 мкг на мышь. Изучение влияния препарата на продуктивную фазу иммунного ответа мышей свидетельствует о супрессивном действии всех доз препарата на мышей высокореагирующих линий СВА и о тенденции роста гемагглютининов на 21 день после введения препарата мышам низкореагирующих линий 576 5 10805 1 2008.06.30 Таблица 3 Титры гемагглютининов при совместном введении натриевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона и ЭБ Доза препараЛиния СВА Линия 576 та(мкг) 7 дней 14 дней 21 день 7 дней 14 дней 21 день 0,2 112106 168109 1513 5958 5048 266200 2 2826 15497 108 15457 2560 2420 20 9637 2560 8370 9164 5120 560160 200 3533 7559 4632 5120 4442 160138 ЭБ 112106 5120 2412 15457 2560 2715 Контроль 0 40 0 0 40 0 Таблица 4 Титры гемагглютининов при введении препарата через 5 дней после иммунизации ЭБ Доза препараЛиния СВА Линия 576 та(мкг) 7 дней 14 дней 21 день 7 дней 14 дней 21 день 0,2 0 9 7 0 0 20 3510 2 108 173110 2210 1311 5450 22620 20 0 2560 2310 2619 2560 30410 200 2813 158120 4730 0 9642 12095 ЭБ 111106 5120 2412 15457 2560 2715 Контроль 0 40 0 0 40 0 Таким образом, выявлена способность натриевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона изменять антителообразование в зависимости от дозы и исходной иммунореактивности организма. При введении препарата в продуктивную фазу, т.е. на 5-й день после введения антигена (эритроцитов барана), он угнетает в широком диапазоне доз антителообразование на 7-й и 14-й дни после иммунизации у мышей линии СВА, генетически высокочувствительных к эритроцитам барана. У низкочувствительных мышей линии 576 препарат вызывает существенное повышение титров гемагглютининов на 21 сутки эксперимента. Пример 4. Исследование влияния натриевой соли 6-амино-2,3-дигидро-1,4-фталазиндиона на клеточный иммунный ответ. Для оценки влияния препарата на клеточный иммунный ответ использовали реакцию гиперчувствительности замедленного типа (ГЗТ). Для сенсибилизации мышам подкожно вводили 1107 эритроцитов барана в объеме 20 мкл. Препарат вводили одновременно с сенсибилизирующей и разрешающей дозой антигена в дозах от 0,2 до 2000 мкг с десятикратным интервалом. Разрешающую дозу 1108 эритроцитов барана вводили на 5-й день после сенсибилизации под апоневротическую пластинку левой задней конечности. В контрольную (правую) лапу в качестве контроля вводили физиологический раствор в объеме 20 мкл. Учет интенсивности воспалительной реакции осуществляли через 24 ч после введения разрешающей дозы антигена. Для этого мышей забивали, сразу после этого обе лапки отрезали на уровне голеностопного сустава и взвешивали на торсионных весах. Индекс реакции (ИР) определяли по разнице массы опытной (О) и контрольной (К) лапок. ОК ИР 100 К Результаты исследования влияния препарата на клеточный иммунный ответ по реакции ГЗТ выявили тенденцию увеличения индекса реакции на мышах обеих линий по мере уменьшения дозы препарата (табл. 5). Следует отметить, что увеличение индекса реакции 6 10805 1 2008.06.30 особенно выражено у низкореагирующей линии 576 по мере уменьшения дозы препарата. При этом доза 200 мкг препарата приводила к подавлению ГЗТ у высокореагирующей линии СВА. Таблица 5 Влияние натриевой соли 6-амино-2,3-дигидро-1,4-фталазиндиона на реакцию гиперчувствительности замедленного типа (ГЗТ) у мышей Индекс реакции Доза препарата (мкг) Линия СВА Линия 576 2 118 199 20 105 169 200 21,5 156 Контроль 63,5 127 Таким образом, препарат в дозе 200 мкг у мышей линии СВА супрессировал развитие реакции ГЗТ. Остальные дозы препарата (20-2 мкл) не влияли на развитие ГЗТ у мышей обеих оппозитнореагирующих линий. Пример 5. Исследование влияния гидрохлорида 5-амино-2,3-дигидро-1,4-фталазиндиона на пролиферацию лимфоидных клеток. Для постановки иммунологических реакций у животных забирали селезенку. Органы надрезали и гомогенизировали в стеклянном гомогенезаторе. Гомогенат фильтровали через фильтры из нержавеющей стали с отверстиями диаметром 50-100 мкм и затем трижды промывали в среде для центрифугирования (СЦ), состоящей из среды 199 с 5 эмбриональной телячьей сыворотки производства НИИЭМ им Н.Ф. Гамалеи АМН СССР, 1 мМ буферного раствора НЕРЕ 5, 50 мкг/мл гентамицина. Суспензии центрифугировали при 4 С при скорости 1500 об/мин, на центрифуге К 23 в течение 10 мин. Количество клеток подсчитывали в камере Горяева, разводя суспензию в 100 раз 3 ной уксусной кислотой, подкрашенной метиленовым синим. Жизнеспособность клеток определяли с помощью 0,1 трипанового синего в физиологическом растворе. Результаты исследования митогенного действия препарата, а также его воздействие на пролиферацию, вызванную Т-клеточным (КонА) и В-клеточным (ЛПС) митогенами, приведены в табл. 6. Таблица 6 Влияние гидрохлорида 5-амино-2,3-дигидро-1,4-фталазиндиона на пролиферацию лимфоидных клеток Концентрация Митоген, добавленный в культуру клеток селезенки препарата КонА ЛПС 35341563 178962080 18874355 50 мкг/мл 2576237 118601566 13232928 500 мкг/мл 176394 1323192 3870308 2,5 мг/мл 24993 19527 25144 12,5 мг/мл 36956 17828 25640 Как видно из представленных данных, препарат не обладает митогенными свойствами в исследованном диапазоне доз (от 50 мкг/мл до 12,5 мг/мл). В то же время, в более высоких концентрациях препарат угнетал как спонтанную пролиферацию клеток селезенки,так и пролиферацию, индуцированную неспецифическими митогенами (КонА и ЛПС). Пример 6. Исследование влияния натриевой соли 5-метиламино-2,3-дагидро-1,4-фталазиндиона на функциональную активность естественных киллеров. Изучено влияние различных концентраций препарата на цитотоксическую активность естественных киллеров (фенотипа 3-, 16, 56) при использовании меченых кле 7 10805 1 2008.06.30 ток мышей миелобластоидной линии К-562, а также мононуклеарные клетки 10 здоровых доноров крови и 10 больных различной патологией с низкими и высокими уровнями цитотоксичности. Для этого исследовали клетки линий К-562 в соотношении клетки эффекторы 125 (по 100 мкл меченых клеток и 100 мкл мононуклеаров). Исследования проводили в 96 луночных планшетах, в течение 16-24 ч инкубировали в 2-инкубаторе при 37 С. Затем переносили содержимое лунок на фильтры, промывали, высушивали, помещали в раствор со сцинтилляторной жидкостью и определяли показатель на -счетчике. Цитотоксический индекс вычисляли по формуле АВ ЦИ 1100 ,СВ где А - радиоактивность клеток-мишеней в присутствии клеток-эффекторов В - радиоактивность оставшихся после обработки клеток трибоном Х-100 (максимальный выход) С - радиоактивность клеток-мишеней в отсутствие клеток-эффекторов. Полученные результаты представлены в табл. 7, 8 Таблица 7 Влияние различных концентраций натриевой соли 5-метиламино-2,3-дигидро-1,4 фталазиндиона на цитотоксический индекс в зависимости от уровня ЦИ контроля Концентрация препарата,ЦИ,мкг/мл Контроль 41,03,0 2,5 41,92,8 5,0 38,83,1 10,0 40,83,0 25,0 41,43,0 50,0 39,14,0 75,0 37,74,1 150,0 41,03,5 300,0 39,03,1 Полученные результаты свидетельствуют о том, что при нормальном уровне ЦИ концентрации препарата (в диапазоне 2,5-300 мкг/мл) существенно не модифицируют цитотоксичность естественных киллеров. Таблица 8. Влияние низких концентраций натриевой соли 5-метиламино-2,3-дигидро 1,4-фталазиндиона на цитотоксический индекс в зависимости от его уровня в контроле Концентрация препарата, мкг/мл Контроль 2,5 5,0 Число наблюдений Из табл. 8 следует, что при исходном высоком уровне ЦИ препарат в дозах 2,5 и 5,0 мкг/мл достоверно подавляет цитотоксичность, а при исходных низких показателях достоверно стимулирует функциональную активность естественных киллеров, то есть проявляет способность модулировать цитотоксичность, в зависимости от ее исходного уровня. 8 10805 1 2008.06.30 Пример 7. Исследование анафилактогенной активности натриевой соли 5-амино-2,3-дигидро-1,4 фталазиндиона. Морским свинкам 3-х групп вводили исследуемый препарат по схеме 1-ая инъекция подкожно в количестве 0,1 мл различными дозами (1 мкг, 10 мкг, 100 мкг), 2-ая инъекция через день внутримышечно в область бедра 0,1 мл препарата и еще через день третья инъекция в количестве 0,1 мл. На 21-й день проводилась разрешающая инъекция основного фармакологического действия при однократном использовании. Результаты приведены в табл. 9. Таблица 9 Выраженность анафилактического шока. Сенсибилизация Разрешающая Кол-во Выраженность анафилактического шока Индекс препаратом (мкг) инъекция(мкг) животных Вейгла 100 100 10 5 1 1 0,3 10 100 10 7 2 0,2 1,0 100 10 10 Таким образом, анафилактическая активность изученного препарата выражена очень слабо и только в высоких дозах. Кроме рассмотренных выше исследований, проводимых на животных, были проведены клинические исследования иммунокорректирующей активности аминопроизводных 2,3-дигидро-1,4-фталазиндиона на примере натриевой соли 5-амино-2,3-дигидро-1,4 фталазиндиона при лечении ряда заболеваний у людей, в частности, как противовоспалительное иммунокорректирующее средство при лечении язвенных заболеваний. Результаты клинических исследований проиллюстрированы примерами 8-9 Пример 8. Больная К. 35 лет. Хронически рецидивирующая язва на передней стенке луковицы размерами около 1,5 см диаметром, глубиной около 0,5 см, на противоположной стенке целующаяся язва 0,3 см диаметром. Сопутствующий катаральный бульбит. Полудомашний режим. Лечение инъекция 100 мг натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона периульцерально. Повторная инъекция препарата на 7-ой день. Прием препарата в суспензии альмагеля, с 7-го дня в маалоксе (в связи с запорами). Омепразол по схеме. С 7-го дня Де-нол с трихополом. Значительное ослабление болей на 2-ой день лечения, полное исчезновение болей на 7-ой день. Уменьшение размеров язвы на 1/3 и очищение дна язвенного дефекта на 7-ой день. Эпителизация язвы на верхней стенке и уменьшение явлений бульбита на 7-ой день. На 15 день лечения - уменьшение размеров язвенного дефекта на 2/3. Полное рубцевание язвы на 21 день. В течение всего курса лечения больной было принято 1000 мг препарата. Пример 9. Исследование эффективности каливой соли 5-амино-2,3-дигидро-1,4-фталазиндиона при лечении острых кишечных инфекций (ОКИ). Эффективность препарата в отношении снижения тяжести проявления разных форм ОКИ оценивалась по предлагаемой программе исследования по 3-х бальной шкале. У 19 из 20 больных интоксикационный синдром исчез в течение 1 - 3-х дней болезни, что позволило оценить как полное снижение тяжести болезни, у одного больного как незначительное снижение в первые дни и полное снижение к 5 дню лечения. По окончании исследования была проведена общая оценка клинической эффективности и безопасности препарата по 4-х балльной шкале, в зависимости от нозологических форм, результаты которой представлены в табл. 10. 9 10805 1 2008.06.30 Таблица 10 Эффективность калиевой соли 5-амино-2,3-дигидрокси-1,4-фталазиндиона при различных формах ОКИ Эффект препарата Всего Форма болезни Нет больных Отличный Хороший Удовлетворительный эффекта Острая дизентерия 9 1 7 1 Сальмонеллез 3 1 2 Пищевая интоксикация 4 1 3 Острый гастроэнтерит 4 2 1 1 ВСЕГО 20 5 13 2 Таким образом, у всех 20 наблюдаемых больных с различными формами ОКИ препарат оказался эффективным средством лечения, причем у 90(18 больных) препарат оказал отличный и хороший эффект. Из вышеприведенных данных следует, что исследования иммунотропной активности аминопроизводных 2,3-дигидро-1,4-фталазиндиона выявили их дозозависимую иммунокорректирующую активность в интервале от 0,2 мкг до 1000 мг. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 10
МПК / Метки
МПК: A61K 31/502, A61P 37/00
Метки: коррекции, препарат, организма, иммунной, фармакологический, системы
Код ссылки
<a href="https://by.patents.su/10-10805-farmakologicheskijj-preparat-dlya-korrekcii-immunnojj-sistemy-organizma.html" rel="bookmark" title="База патентов Беларуси">Фармакологический препарат для коррекции иммунной системы организма</a>