Жидкие композиции, содержащие человеческий хорионический гонадотропин (hCG)
Текст
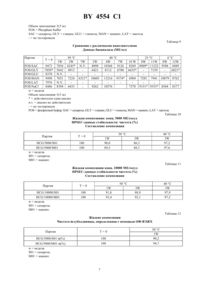
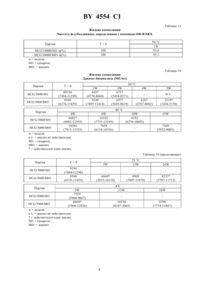
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ ЖИДКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЧЕЛОВЕЧЕСКИЙ ХОРИОНИЧЕСКИЙ ГОНАДОТРОПИН(71) Заявитель Апплайд Резч Системз АРС Холдинг Н.В.(73) Патентообладатель Апплайд Резч Системз АРС Холдинг Н.В.(57 1. Стабильная жидкая фармацевтическая композиция гонадотропина, содержащая рекомбинантный человеческий хорионический гонадотропин , стабилизирующее количество маннита и буферный раствор. 2. Фармацевтическая композиция по п. 1, отличающаяся тем, что указанным раствором является забуференный водный раствор. 3. Фармацевтическая композиция по п. 2, отличающаяся тем, что указанный буферный раствор выбирают из группы, включающей ацетатный, сукцинатный и фосфатный буфер. 4. Фармацевтическая композиция по п. 3, отличающаяся тем, что указанным буфером является фосфатный буфер. 5. Фармацевтическая композиция по любому из пп. 2-4, отличающаяся тем, что рН буферного раствора составляет 7,00. 6. Фармацевтическая композиция по любому из пп. 2-4, отличающаяся тем, что указанным буферным раствором является 0,01 М буферный раствор. 7. Фармацевтическая композиция по п. 1, отличающаяся тем, что содержит от 1000 до 4000 ед/мли от 10 до 180 мг/л маннита в 0,01 М фосфатном буфере при рН равном 7,00. 8. Способ получения жидкой фармацевтической композиции по п. 1, включающий разведение исходного рекомбинантногов буферном растворе, содержащем маннит. Настоящее изобретение относится к жидким фармацевтическим композициям, содержащим гонадотропин. Более конкретно, настоящее изобретение относится к жидким препаратам человеческого хорионического гонадотропина , стабилизированного многоатомным спиртом или нередуцирующим сахаром. Известно, что высокоочищенные белки легко подвергаются деградации даже при контакте с атмосферными агентами. Это свойство еще более присуще белкам, продуцированным с помощью техники рекомбинантных ДНК. Такие белки обычно стабилизируют сахаридами, такими как лактоза, либо маннитом либо белками или аминокислотами такими как альбумин и глицин. Инъецируемые стабилизированные препараты гонадотропинов изготавливают способом, который во всех случаях включает стадию лиофилизации с получением сухого порошка, причем полученные таким способом стабилизированные композиции могут сохраняться в течение длительного периода времени, даже при хранении их в условиях комнатной температуры. В 93/11788 описаны лиофилизованные гонадотропинсодержащие фармацевтические композиции,стабилизированные сахарозой, взятой отдельно или в комбинации с другими стабилизирующими агентами. 4554 1 В этой патентной заявке, благодаря проведенным исследованиям, было показано, что стабильность лиофилизованных композиций, обеспечиваемая сахарозой, выше, чем стабильность, обеспечиваемая лактозой или маннитом. Однако до настоящего времени не было описано каких-либо жидких стабилизированных композиций гонадотропинов. Поэтому, было бы весьма желательным получить такие жидкие композиции, которые были бы уже готовы для инъекций, что позволило бы избежать стадии разведения лиофилизованного порошка, и тем самым облегчить использование этих композиций. Авторами настоящей заявки было неожиданно обнаружено, что такие жидкие стабилизированные композиции могут быть получены. Главной целью настоящего изобретения является получение жидкой фармацевтической композиции, содержащейи стабилизированной многоатомным спиртом или нередуцирующим сахаром. Предпочтительным многоатомным спиртом является маннит, а предпочтительным нередуцирующим сахаром является сахароза. При этом более предпочтительным стабилизатором жидкой композиции является маннит. Предпочтительным раствором является забуференный водный раствор при этом в соответствии с настоящим изобретением буфер выбирают из группы, включающей фосфатный, ацетатный или сукцинатный буфер. Предпочтительным буфером является фосфат, а рН предпочтительно составляет 7,00.является предпочтительно рекомбинантным и может быть получен, например, путем экспрессии в клетках СНО (яичника китайского хомячка), трансформированных соответствующей ДНК с использованием техники, описанной в Европейском патенте 160699. Другой целью настоящего изобретения является разработка способа получения вышеуказанной жидкой фармацевтической композиции, предусматривающего разведение основного объема растворав буферном растворе, содержащем наполнители. Указанная жидкая фармацевтическая композиция поставляется в герметически закрытых контейнерах, которые обеспечивают ее хранение перед использованием в стерильных условиях. В целях оптимизации стабильности -содержащих композиций настоящего изобретения была проведена серия предварительных экспериментов с использованием различных буферов при различных рН, ионной силы, диэлектрической постоянной и концентрации рек-. Для оценки влияния рН и буфера на стабильность композиции, были получены 0,01 М растворы фосфатных, сукцинатных или ацетатных буферов с использованием воды для инъекций. рН доводили до 6,0 7,0 и 8,0 путем добавления 1 М ОН. Затем к буферным системам добавляли основной объем раствора рек-,в результате чего получали растворы с концентрацией 5000 МЕ/мл. Полученные растворы фильтровали и выливали в 3-миллилитровые стеклянные сосуды. Состав полученных таким образом композиций приводится в таблице 1. При этом были проведены исследования ускоренной стабильности вышеуказанных композиций для того, чтобы стабильность этих композиций при их хранении в контейнерах при комнатной температуре можно было предсказать путем экстраполяции данных, полученных при более высоких температурах. В этом случае образцы хранили при 40 С и 50 С, и стабильность рек- контролировали путем определения их чистоты с помощью анализовв соответствии со следующими стандартными условиями фаза А 0,1 М фосфат рН 6,70,1 М 24 изократные условия 100 фаза А колонка 2000 скорость потока 0,5 мл/мин УФ-детектор 214 нм объем ввода 20 мкл (концентрация 10 000 ) 40 мкл (концентрация 5 000 ). В таблице 3 приводится процент рекмономерного пика, определенного с помощью анализа ЕС. Полученные результаты показали, что растворы с рН 6,0 и 8,0 являются менее стабильными, чем растворы с рН 7,0 однако при использовании различных буферов какого-либо заметного различия в стабильности растворов не наблюдалось. Влияние ионной силы оценивали с использованием 5000 МЕ/мл-растворов рек-, полученных в фосфатном и сукцинатном буферах (0,01 М, рН 7,0), доведенных с помощьюдо значений осмомоляльности 150, 300 и 400 мОсм. Состав композиций указан в таблице 2. Образцы хранили при 4, 25, 40 и 50 С и тестировали на стабильность рек- с помощью анализа . Результаты анализа, представленные в таблице 4, показали, что увеличение ионной силы отрицательно влияет на стабильность рек-. Влияние диэлектрической постоянной оценивали с использованием 5000 МЕ/мл-растворов рек-, полученных в фосфатном и сукцинатном буферах (0,01 М, рН 7), содержащих 5, 10 и 15 пропиленгликоля. Состав композиций указан в таблице 2. Образцы хранили при 4, 25, 40 и 50 С и тестировали на стабильность рек- с помощью анализа . Результаты анализа, представленные в таблице 4, показали, что увеличение процентного содержания пропиленгликоля отрицательно влияет на стабильность рек-. Для оценки влияния концентрации рек- стабильность растворов при 50 С в фосфатном буфере (0,01 М,рН 7,0), содержащих соответственно 2500, 5000, 7500 и 10000 МЕ/мл рек-, прослеживали в течение 2 не 2 4554 1 дель с помощью . Результаты, представленные в таблице 5, показали, что более концентрированные растворы имеют более высокую стабильность. Для сравнения влияния различных стабилизаторов и/или наполнителей на стабильность рек- было получено в качестве первой стадии шесть жидких композиций в фосфатном буфере (0,01, рН 7,0), содержащих 10000 МЕ/мл рек-. При этом в качестве стабилизаторов/наполнителя использовали сахарозу, глицин, глюкозу, маннит, лактозу и . Состав композиций указан в таблице 6. Образцы композиций, подвергаемые тесту на стабильность, хранили при 4, 25, 40 и 50 С и анализировали с помощью анализови ЕС. Затем, исходя из результатов, полученных в указанной первой стадии, были получены четыре партии из двух отобранных жидких композиций с использованием сахарозы и маннита в качестве стабилизаторов. Состав таких композиций указан в таблице 7. Биоанализосуществляли в соответствии с описанием в монографии Европейской фармакопеи. Данные по стабильности, полученные с помощью , представлены в таблице 8, а величины биологической активности представлены в таблице 9. При этом были получены следующие результаты 1) биологическая активность композиций, содержащих глюкозу и лактозу, заметно снижалась после 1 недельного хранения при 50 С. Кроме того, мономерный пик был также ниже мономерного пика, измеренного для других композиций 2) в присутствии глицина инаблюдалось более явное снижение биологической активности и чистоты, чем для композиций, содержащих сахарозу и маннит. В этом случае также снижение процента рек-мономерного пика обусловлено не образованием агрегатов, а увеличением количества свободных субъединиц. В таблицах 10 и 11 представлены данные чистоты, определенной с помощьюдля концентраций 5000 и 10000 соответственно. Эти данные свидетельствуют о том, что даже после 3-недельного хранения при 50 С чистота композиции, содержащей маннит, была выше, чем чистота композиции, содержащей сахарозу. В таблицах 12 и 13 представлены данные чистоты для -субъединицы, определенные с помощью обращенно-фазовой ВЭЖХ после 1-недельного хранения при 50 С композиций, содержащих сахарозу и маннит. Эти данные подтверждают, что композиция, содержащая маннит, является более стабильной, чем композиция, содержащая сахарозу. Анализ с помощью обращенно-фазовой хроматографии (ВЭЖХ) осуществляли при следующих стандартных условиях фаза 1 млв 1 л бидистиллированной воды фаза В 0,79 млв 1 л ацетонитрила градиентные условия время А В 0 85 15 25 мин 60 40 21 мин 20 80 22 мин 85 15 колонка 25 см,300 температура колонки 40 С скорость потока 1 мл/мин УФ-детектор 214 нм объем ввода 10 мкл. В таблицах 14 и 15 представлены результаты анализа на биологическую активность. После 24-недельного хранения при 4 и 25 С какого-либо заметного снижения биологической активности в композиции, содержащей маннит, не наблюдалось. В соответствии с настоящим изобретением жидкая фармацевтическая композиция содержит от 1000 до 40 000 МЕ/мл, а предпочтительно 10 000 МЕ/мл , и от 10 до 180 мг/л, а предпочтительно 54,6 мг/л маннита в 0,01 М буферном растворе. Примеры получения фармацевтического препарата. Материалы 85 фосфорная кислота( ) Маннит ,, , , ,421 ,1 , вода для инъекций. Исходный контейнер для получения сосудов с препаратом состоял из 3-миллилитровых стеклянных флаконов( 2) (из боросиликатного стекла типа 1), резиновых прокладок ( 1816 50), алюминиевых колец и защелкивающихся крышек . Получение раствора рек-С, содержащего маннит. В воду для инъекций (600 мл) добавляли фосфорную кислоту (0,98 г). Если необходимо, то рН доводили до 7,0 путем добавления 1 М аОН. Затем в раствор фосфорной кислоты добавляли маннит (54,6 г) и рН снова контролировали, после чего, если это было необходимо, рН доводили до 7,000,2 путем добавления 1 М аОН или фосфорной кислоты, разведенной в отношении 15. После этого к раствору-наполнителю добавляли основной объем к- (10 или 20 , если необходимо было получить конечную концентрацию 5000 или 4554 1 10000 соответственно) и рН снова контролировали, после чего, если это было необходимо, рН доводили до 7,000,2 путем добавления 1 Мили фосфорной кислоты, разведенной в отношении 15. Затем раствор доводили до объема 1 литр путем добавления воды для инъекций. Полученный раствор фильтровали через 0,22 мкм-фильтр 20 под давлением не выше 1,5 атм. при ламинарном потоке, собирая этот раствор в колбу и слегка помешивая в течение примерно 1 минуты. После этого флаконы наполняли 0,5 мл раствора рек-. Таблица 1 Состав растворов рек. Эффект рН/буфера Ацетатно-буферный раствор Основной объем рекЛедяная уксусная кислота 1 М аОН Сукцинатно-буферный раствор Основной объем рекЯнтарная кислота 1 М аОН Фосфатно-буферный раствор Основной объем рек. 85 -ная фосфорная кислота 1 М аОН Объем заполнения 1 мл Таблица 2 Состав растворов рекИонная сила/диэлектрическая постоянная Партия Таблица 6 Жидкие композиции Композиция во флаконе Компоненты/партия -/рек- МЕ/мл 10,000 Сахароза мг/мл 102,6 Маннит мг/мл Глицин мг/мл Глюкоза мг/мл Лактоза мг/млмг/мл Буфер 34 0,01 ,7,0. Объем заполнения 0,5 мл. Жидкие композиции Композиция во флаконе Компонент Сахароза 0. Фосфорная кис-та Гидроксид натрия Компонент Маннит 0. Фосфорная кис-та Гидроксид натрия Объем заполнения 0,5 мл-не тестировали Таблица 9 Сравнение с различными наполнителями Данные биоанализа (МЕ/мл) Партия/ 8486 неделя Объем заполнения 0,5 млдействителен один анализ Таблица 12 Жидкие композиции Чистота -субъединицы, определенная с помощью ОФ-ВЭЖХ Партия 4554 1 Таблица 13 Жидкие композиции Чистота -субъединицы, определенная с помощью ОФ-ВЭЖХ Партия Таблица 14 Жидкие композиции Данные биоанализа (МЕ/мл) Партия Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66. 9
МПК / Метки
МПК: A61K 47/26, A61K 38/24
Метки: хорионический, жидкие, hcg, содержащие, человеческий, композиции, гонадотропин
Код ссылки
<a href="https://by.patents.su/9-4554-zhidkie-kompozicii-soderzhashhie-chelovecheskijj-horionicheskijj-gonadotropin-hcg.html" rel="bookmark" title="База патентов Беларуси">Жидкие композиции, содержащие человеческий хорионический гонадотропин (hCG)</a>
Предыдущий патент: Способ лечения аутоиммунного тироидита и аутоиммунной офтальмопатии
Следующий патент: Вертолет
Случайный патент: Способ замораживания пищевого полуфабриката