Фармацевтичееская композиция, регулирующая гематопоэз
Номер патента: 2237
Опубликовано: 30.09.1998
Авторы: ХАНС-ЙЁРГ МАРКЛЬ, Вернер Грубер, ФРИТЦ ДЕММЕР, Хайнрих Воог
Текст
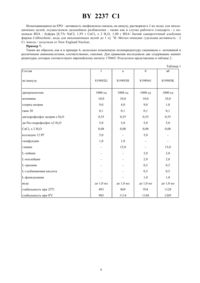
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ(71) Заявитель БРИНГЕР МАННХАЙМ ГмбХ(73) Патентообладатель БРИНГЕР МАННХАЙМ ГмбХ(57) 1. Фармацевтическая композиция, регулирующая гематопоэз в форме водного инъекционного раствора или лиофилизата, включающая эффективное количество эритропоиэтина, физиологически совместимые буферирующие агенты и аминокислоту, отличающаяся тем, что она дополнительно содержит мочевину и детергент при соотношении (г/л) мочевина аминокислота детергент, равном 5-501-500,05-5. 2. Фармацевтическая композиция по п.1, отличающаяся тем, что она дополнительно содержит обычные для инъекционных целей вещества, включающие изотонирующее средство, комплексообразователь, например,хлористый кальций, и другие вспомогательные компоненты. 3. Фармацевтическая композиция по п.1, отличающаяся тем, что в качестве аминокислоты она содержит одну или несколько аминокислот, выбранных из группы, включающей глицин, -аланин, -фенилаланин, - аргинин,-лейцин, -изолейцин, -глутаминовую кислоту или -треонин. 4. Фармацевтическая композиция по пп. 1, 2 или 3, отличающаяся тем, что в качестве детергента она содержит неионогенное поверхностно-активное вещество. 5. Фармацевтическая композиция по п.4, отличающаяся тем, что в качестве поверхностно-активного вещества она содержит полиэтиленсорбитанлаурат. 6. Фармацевтическая композиция по пп. 1-5, отличающаяся тем, что она содержит на единицу инъекционной дозы от 1 до 5 мл 100-1000000 единиц эритропоиэтина. 7. Фармацевтическая композиция по п.6, отличающаяся тем, что она содержит 100-20000 единиц эритропоиэтина.(56) 1.178665, МПК 61 37/24, 1986 Предметом настоящего изобретения являются стабильные, неиммунногенные, физиологически хорошо совместимые, растворенные или сублимационно высушенные галеновые фармацевтические композиции из человеческих протеинов (белков), в особенности эритропоэтин. Человеческие протеины представляют собой аутогенные, имеющиеся только в незначительных количествах протеины, как, например, тканевый плазмогенный активатор (-), стрептокиназа, урокиназа, интерферон, стимулирующие различные колонии, фаторыили эритропоиэтин . На примере , который предпочтительно используется в составе, изобретение поясняется подробнее. Эритропоиэтинпредставляет собой гликопротеин, который стимулирует образование гемоглобина,соответственно, эритроцитов в костном мозгу. Этот липопротеин образуется главным образом в почках, в очень незначительных количествах находится в сыворотке и при физиологических условиях частично выделяется в моче. Отсутствие ЕРО при почечной недостаточности обусловлено ренальной анемией. Благодаря введению ЕРО в физиологических количествах, т.е. несколько микрограмм, за одну или несколько дозировок можно снова возбуждать в таких случаях образование эритроцитов. Так как организм чувствительно реагирует уже на незначительные изменения дозы, то дозировка должна быть точно воспроизводима. Обычно ЕРО инъекцируют или 2237 1 внутримышечно или внутривенно в виде водного раствора или вводят в виде распыляемого раствора через слизистую оболочку носа. Однако, известно, что ЕРО, и именно как прежде всего полученный из человеческой мочи продукт ( и др., . . ., т. 25, 5558-5564, 1977), как также получаемый между тем путем генной инженерии продукты (ВОИС 85-02610), в водном растворе нестабильны и даже при хранении при - 800 С наступают большие потери активности. Эти оба вида продуктов отличаются несколько по образу гликозилирования и по активности, прямое сравнение с содержащимся в сыворотке ЕРО до сих пор неизвестно. Эти потери активности сводятся, с одной стороны, к разрушению ЕРО за счет каталитических эффектов поверхности служащих для хранения ампул благодаря следам тяжелых металлов, кислороду воздуха и т.д., с другой стороны, однако, также за счет отложения ЕРО - молекул на стенках сосуда, причем также может происходить частично денатурация. Так как, как сказано выше, в каждой дозировочной единице должны содержаться только несколько микрограммов, потери за счет адсорбции уже спустя короткое время хранения могут быть значительными. В европейском патенте А - 178 576 поэтому описано ингибирование этого отложения на стенках сосуда благодаря добавке полимерных соединений, как альбумин сыворотки человека или крупного рогатого скота, лецитин, декстран, целлюлоза, полиэтиленгликоль и т.д., и таким образом достижение спустя примерно 2 часа хранения при 20 С обнаружения ЕРО в количестве 75-98, в противоположность чему обнаруживают только 16 без такой добавки. При этом, впрочем, измерялось только обнаружение радиоактивной маркировки (14 С), так что эти опыты ничего не говорят о стабилизации ЕРО от разложения. Заявителем установлено, что стабилизации в течение длительного времени с помощью таких средств, однако, нельзя достигать, т.е. ЕРО- активность в тесте на мыши сильно падает, к тому же эти средства при инфекции вызывают иммуногенные реакции. Из европейского патента 1, далее, известны стабилизаторы, в особенности для сублимационно высушенных ЕРО - препаратов. Наряду с полимерными веществами ПЭГ 4000, желатиной и декстраном 40 названы различные сахара и многозначные спирты, дающие при окислении моносахариды аминокислоты, неорганические соли и тиольные соединения. Комбинации этих веществ с человеческим сывороточным альбумином, желатиной и декстраном также указаны. Также в этом литературном источнике определяется обнаружение радиоактивностей только спустя 2 месяца хранения сублимационно высушенных продуктов. Оно указывается равным 87-99, в противоположность 60 без добавок. Так как лиофилизированный материал используется непосредственно после получения в качестве стандарта, то не указано, какие еще потери активности при приготовлении препаратов. Также эти препараты обладают высокой потерей активности в тесте на мышах. Поэтому была поставлена задача создания хорошо совместимого ЕРО- препарата, который стабилен при хранении, т.е. сохраняет ин виво активность, не приводит к адсорбциям на стенках ампул или шприцов и легко может переводиться в инъекцируемую форму. Неожиданно эта задача решается благодаря подробнее охарактеризованной в формуле изобретения фармацевтической композиции, регулирующей гематопоэз в форме водного инъекционного раствора или лиофилизата, включающей эффективное количество эритропоиэтина, физиологически совместимые буферирующие агенты и аминокислоту, характеризующейся тем, что она дополнительно содержит мочевину и детергент при соотношении (г/л) мочевина аминокислота детергент, равном 5-501-500,05-5 и дополнительно содержит обычные для инъекционных целей вещества, включающие изотонирующее средство, комплексообразователь,например, хлористый кальций, и другие вспомогательные компоненты. Как показали опыты, отдельно взятые индивидуальные вещества этими свойствами не обладают или обладают только в незначительной мере. Решающей для стабилизации является добавка мочевины и различных аминокислот. Мочевина используется в количестве 5-50 г/л, предпочтительно 10-15 г/л. В качестве аминокислот следует назвать, например, глицин, аланин, аргинин, -лейцин, 2-фенилаланин, глутаминовая кислота или -треонин. Смеси различных аминокислот, по-видимому, имеют особенно предпочтительный эффект. Их используют в количествах 0,5-50 г/л, предпочтительно 1-20 г/л, причем общее количество должно составлять предпочтительно 5-25 г/л. Далее, необходим физиологический совместимый буфер, который в необходимых для инъекционных растворах незначительных концентрациях (примерно 20-100 ммоль/л), устанавливает необходимую для ЕРО рН - область 6,5-7,4, в особенности 7,0-7,2. Кроме фосфатных буферов применимы также глицинат, карбонат, цитрат и другие, причем в качестве противоионов могут служить, кроме ионов натрия и калия, также ионы аммония. Буферирование дополнительно вызывается содержащимися аминокислотами. Прилипание ЕРО к стенкам ампул и шприцам существенно снижается за счет добавки незначительных количеств детергента. Так как препарат должен предпочтительно вводится путем инъекции, это вещество должно быть физиологически, в особенности внутривенно, совместимо. Оказываются пригодными концентрации 0,05-5 г/л, в особенности 0,1-0,5 г. Неионные смачиватели, как различные виды полимакроголов, в особенности полиэтиленсорбитанлаурат (Твин 20 или 80) или сорбитантриолеат ( 35 или 80) или полигликолевый эфир глицеринолеиловой кислоты ( ) оказываются пригодными для этой цели, однако, в равной мере могут использоваться другие совместимые вещества. 2237 1 Для уменьшения влияния на ЕРО ионов тяжелых металлов которые почти неизбежно увлекаются при обработке, например, из используемых металлических инструментов, далее, оказывается пригодным добавление раствора 0,01-5 г/л растворимой кальциевой соли, предпочтительно примерно 0,02-0,2 г/л хлорида кальция. Также могут использоваться другие физиологически совместимые комплексообразователи, например, цитрат, пантотенат. В качестве растворителя используют чистую воду для инъекционных целей, к которой для установления изотонии добавляются еще 0,5-10 г/л хлорида натрия или соответствующих веществ, как маннит, сорбит и т.д. Для получения предлагаемых согласно изобретению фармацевтических композиций все вспомогательные вещества растворяют в необходимом количестве воды, примешивают ЕРО-препарат который должен иметь активность примерно 100 000-200 000 единиц/мг протеина, стерильно фильтруют в соответствующие ампулы, замораживают и осторожно лиофилизируют при низких температурах. Полученные препараты устойчивы в атмосфере азота в течение 2-х лет при 0 С, и в течение 1 года при комнатной температуре. При реконституировании с помощью воды они растворяются за несколько секунд без помутнения и таким образом могут прямо вводиться путем внутривенной иди внутримышечной инъекции или после разбавления изотоническими растворами (например, раствором хлорида натрия) вливаться. Процессу замораживания придают особое значение. Вспомогательные вещества по роду и количеству выбираются так, чтобы эвтектическая точка замораживаемого раствора находилась между -50 и -30 С. С помощью управляемой компьютером программы оптимизации определялись следующие оптимальные условия для 3-х фаз лиофилизации время замораживания 12-14 часов при - 40 С основная сушкатемпература рассола 10 С, давление 10-1 мбар, время - 48-60 часов дополнительная сушкатемпература рассола 20, давление 10-3 мбар, время 4-6 часов. При этом существенным является распознавание с помощью измерительного устройствар, а также измерение электропроводности, когда закончится основная сушка, чтобы лиофилизируемый продукт слишком быстро не нагревался и чтобы избегать оттаивания замороженного раствора и связанной с этим потери активности. Используемые вспомогательные вещества выбираются так, чтобы осуществлялось образование равномерно структурированного лиофилизируемого замерзшего тела и во время лиофилизации получался пористый скелет (осадок на фильтре), из которого возможна оптимальная сублимация льда, прежде всего также к концу основной сушки. Дополнительная сушка осуществляется, как указано выше, только при 20 С в течение 4-6 часов. Эта осторожная обработка является важной, так как иначе приходит к потере активности в случае слишком лиофилизированного материала. Как правило, таким образом, лиофилизированные продукты имеют содержание воды по К.Фишеру примерно 2-5, это остаточное содержание воды зависит от рода и количества вспомогательных веществ, которые используются в соответствующей рецептуре. Водные растворы стабилизированного ЕРО можно также непосредственно заливать в ампулы и без лиофилизации в виде готовой к употреблению формы использовать. Устойчивость, однако, благодаря этому по сравнению с лиофилизатом сокращается примерно до 1 года при 0 С и нескольких месяцев при комнатной температуре. Нижеследующие примеры должны более подробно пояснить вышеописанноеПример 1. Сухое вещество для инъекции с 2000 единиц эритропоиэтина (состав для 35 000 ампул). В стерильном, снабженном мешалкой, емкостью 100 л 2 А резервуаре с двойной рубашкой растворяют вспомогательные вещества мочевина 700,0 г хлорид натрия 70,0 г Твин 20 7,0 г дигидрофосфат натрия х 1 2 38,4 г динатрийгидрофосфат х 2 2 350,0 г хлорид кальция х 2 2 8,4 г глицин 105,0 г-фенилаланин 70,0 г вода для инъекционных целей до 70,0 л. 2237 1 К 30 л этого вспомогательного раствора добавляют 214,3 мл сырьевой загрузки эритропоиэтина с титром ЕРО 140 000 ед./мл и доливают до конечного объема 35 л и перемешивают. С помощью остального раствора вспомогательных веществ споласкивают систему фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор в асептических условиях заливают в склянки для инъекции емкостью 1 мл и сублимационно высушивают в установке для лиофилизации при следующих критериях время замораживания 12-14 часов при - 40 С,основная сушка температура рассола 10 С, давление 10-1 мбар, время 48- 60 часов,дополнительная сушкатемпература рассола 20 С, давление 10-3 мбар, время 4-6 часов. Получают таким образом объемистое, с открытыми порами сухое вещество для инъекции, которое стабильно по крайней мере 2 года в холодильнике и 1 год при комнатной температуре и в течение нескольких часов растворяется в 2 мл воды для инъекционных целей без помутнения и лишенным частиц. Пример 2. Лиофилизат с 200 единицами эритропоиэтина (состав для 35 000 ампул). эритропоиэтин 46,7 мл 7 единиц хлорид натрия 100,0 г Твин 20 10,0 г дигидрофосфат натрия х 1 2 155,0 г динатрийгидрофосфат х 2 2 500,0 г хлорид кальция х 2 2 10,0 г мочевина 1000,0 г-лейцин 150,0 г треонин 120,0 г фенилаланин 165,0 г вода для инъекционных целей до 70,0 л. Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРО-биологически активного вещества. Вторые 35 л используют для споласкивания системы фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор при асептических условиях заливают в склянки для инъекции емкостью 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 год при комнатной температуре. Пример 3. Лиофилизат с 1000 единицами эритропоиэтина (состав для 35 000 ампул) эритропоиэтин 233,33 мл 35 единиц хлорид натрия 100,0 г Твин 20 12,0 г дигидрофосфат натрия х 2 140,0 г динатрийгидрофосфат х 2 2 450,0 г хлорид кальция х 2 2 10,0 г мочевина 700,0 г глицин 1050,0 г-лейцин 92,0 г глутаминовая кислота 103,0 г фенилаланин 115,5 г вода для инъекционных целей до 70,0 л. Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРО -биологически активного вещества. Вторые 35 л используют для споласкивания системы для фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор при асептических условиях заливают в склянки для инъекции емкостью по 1 мл и лиофилизируют при тех же критериях, как описано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться 2 года в холодильнике или 1 год при комнатной температуре, без больших потерь активности. Пример 4. Лиофилизат с 500 единицами эритропоиэтина (состав для 35 000 ампул) эритропоиэтин 116,67 мл 17,5 единиц хлорид натрия 70,0 г Твин 20 7,0 г дигидрофосфат натрия х 2 38,5 г 4-лейцин глутаминовая кислота фенилаланин вода для инъекционных целей до Вспомогательные вещества растворяют в 70 л воды для иинъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРО-биологически активного вещества. Вторые 35 л используют для споласкивания системы для фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор. 0,2 мкм. Стерильно профильтрованный раствор разливают при асептических условиях в склянки для инъекции емкостью по 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 год при комнатной температуре. Пример 5. Лиофилизат с 750 единицами эритропоиэтина (состав для 35 000 ампул) эритропоиэтин 175,0 мл 26,25 единиц хлорид натрия 100,0 г Твин 20 12,0 г дигидрофосфат натрия х 2 140,0 г динатрийгидрофосфат х 2 2 450,0 г хлорид кальция х 2 2 10,0 г мочевина 12,0 г глицин 1250,0 г изолейцин 98,0 глутаминовая кислота 130,0 г фенилаланин 145,0 г вода для инъекционных целей до 70,0 л. Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРО-биологически активного вещества. Вторые 35 л используют для споласкивания системы для фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор разливают при асептических условиях в склянки для инъекций емкостью по 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 год при комнатной температуре. Пример 6. Для того, чтобы испытать эффективность различных стабилизаторов, стандартную рецептуру с 1000 ед. ЕРО/мл, которая содержит в качестве основного стабилизатора мочевину, смешивают со смесью поливинилпирролидона с белком, соответственно, различными аминокислотами и продукты лиофилизируют. Результаты представлены в таблице 1. Стабильность ЕРО после б недель хранения лиофилизата при 35 С, соответственно, 0 С, в тесте на селезенке мыши согласно методике . в , 11, 649-660 (1983), определяется следующим образом. Самкам В 6 С 3 Г 1- мышей весом примерно по 20 г (Центральный Институт для покупателей подопытных животных,Ганновер) в два последовательных дня вводили путем инъекции интраперитонеально 60 мг/кг фенилгидразингидрохлорида. Спустя следующие 3 дня извлекали селезенку, клетки селезенки суспендировали в стерильной- среде(модифицированнаясреда 584,0 мг/л 1 -глутамина 0,1 ммоль/л 2-меркаптоэтанола 20 зародышевой телячьей сыворотки / и разбавляли до 4 х 106 ядросодержащих клеток/мл. Суспензию, к которой прежде добавляют тест -вещество, соответственно, ЕРО- стандарт, смотря по обстоятельствам в природных концентрациях, растворенные в-буфере, распределяют на пластинках для микротитра (0,2 мл/углубление). После инкубации /22 часа, 37 С, воздух 15 2/ на углубление добавляют 20 мкл 3 Н метил - тимидинового раствора с 1 и снова инкубируют 2 часа при 37 С. После этого содержимое переводят с помощью клеточногои промывают дистиллированной водой. Встроение 3 Н- тимидина определяют с помощью -сцинтилляционного счетчика и оценивают по отношению к стандартным препаратам. В качестве рабочего стандарта используют Р 009 - ЕРО-стандарт Института генетики, Кембридж, Массачусетс, США, который содержит 112 ед. ЕРО/мл и 503 нг протеина/мл/ (уравненный по отношению к ЕРО стандартуНО, ,/ 2 по , 1971/. Стандартные концентрации находятся в области 10-100 / мл. 5 2237 1 Испытывающиеся на ЕРО - активность лиофилизаты сначала, на ампулу, растворяли в 2 мл воды для инъекционных целей, осуществляли дальнейшее разбавление - также как в случае рабочего стандарта - с помощью- буфера 8,75 г , 1,95 г 2 х 2 2, 1,00 г / бычий сывороточный альбумин фирмы /, вода для инъекционных целей до 1 л. 3 -Метил-тимидин /удельная активность 2/ммоль / получали от. Пример 7. Таким же образом, как и в примере 6, несколько измененную штаммрецептуру смешивали с- мочевиной и различными аминокислотами, соответственно, смесями. Для сравнения исследовали две содержащие маннит рецептуры, которые соответствуют европейскому патенту 178665. Результаты представлены в таблице 2. 2237 1 Таблица 2 Опытсостав в мг/мл ЕРО загрузка Р 007 Хлорид натрия Твин 20 дигидрофосфат а. Н 2 О ди-а-гидрофосфат х 2 Н 2 О хлорид кальция 2 Н 2 О маннит мочевина глицин-лейцин /1/100 ммоль/ изолейцин -треонин -глутаминовая кислота фенилаланин-аргинин-а Н 204 х Н 2 О 2 НРО 4 х 2 Н 2 О вода для инъекций до Стабильность 25 С Стабильность 0 С Опыт состав в мг/мл ЕРО загрузка Р 007 Хлорид натрия Твин 20 дигидрофосфат а. Н 2 О ди-а-гидрофосфат х 2 Н 2 О хлорид кальция 2 Н 2 О маннит мочевина глицин-лейцин /1/100 ммоль/ изолейцин -треонин -глутаминовая кислота фенилаланин-аргинин-а Н 204 х Н 2 О 2 НРО 4 х 2 Н 2 О вода для инъекций до Стабильность 25 С Стабильность 0 С 2237 1 Эритропоиэтин лиофилизат 500 ед (смесь для 35.000 флаконов) Композицию получают аналогично примеру 4. Вводят следующие компоненты при следующем соотношении 116,67 мл 17,5 ед Эритропоиэтин Кислый фосфорнокислый натрий х 2 42,0 г динатрийгидрофосфат х 2 2 523,5 г Твин 20 9,5 мочевина 105,0 глицин-фенилаланин 115,0 вода для инъекционных целей до 70,0 л. Получают хорошо растворимый в 2 мл воды лиофилизат, который может храниться 9 месяцев при комнатной температуре и 1.5 года в холодильнике без большой потери активности. Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66. 8
МПК / Метки
МПК: A61K 9/19, A61K 38/22, A61K 9/08
Метки: композиция, гематопоэз, фармацевтичееская, регулирующая
Код ссылки
<a href="https://by.patents.su/8-2237-farmacevticheeskaya-kompoziciya-reguliruyushhaya-gematopoez.html" rel="bookmark" title="База патентов Беларуси">Фармацевтичееская композиция, регулирующая гематопоэз</a>
Предыдущий патент: Гидростатический аксиально-поршневой двигатель с регулируемым рабочим объемом для установки в ступице колеса, приводимого этим двигателем
Следующий патент: Вентиляторная градирня
Случайный патент: Валковый кристаллизатор машины непрерывного литья ленты