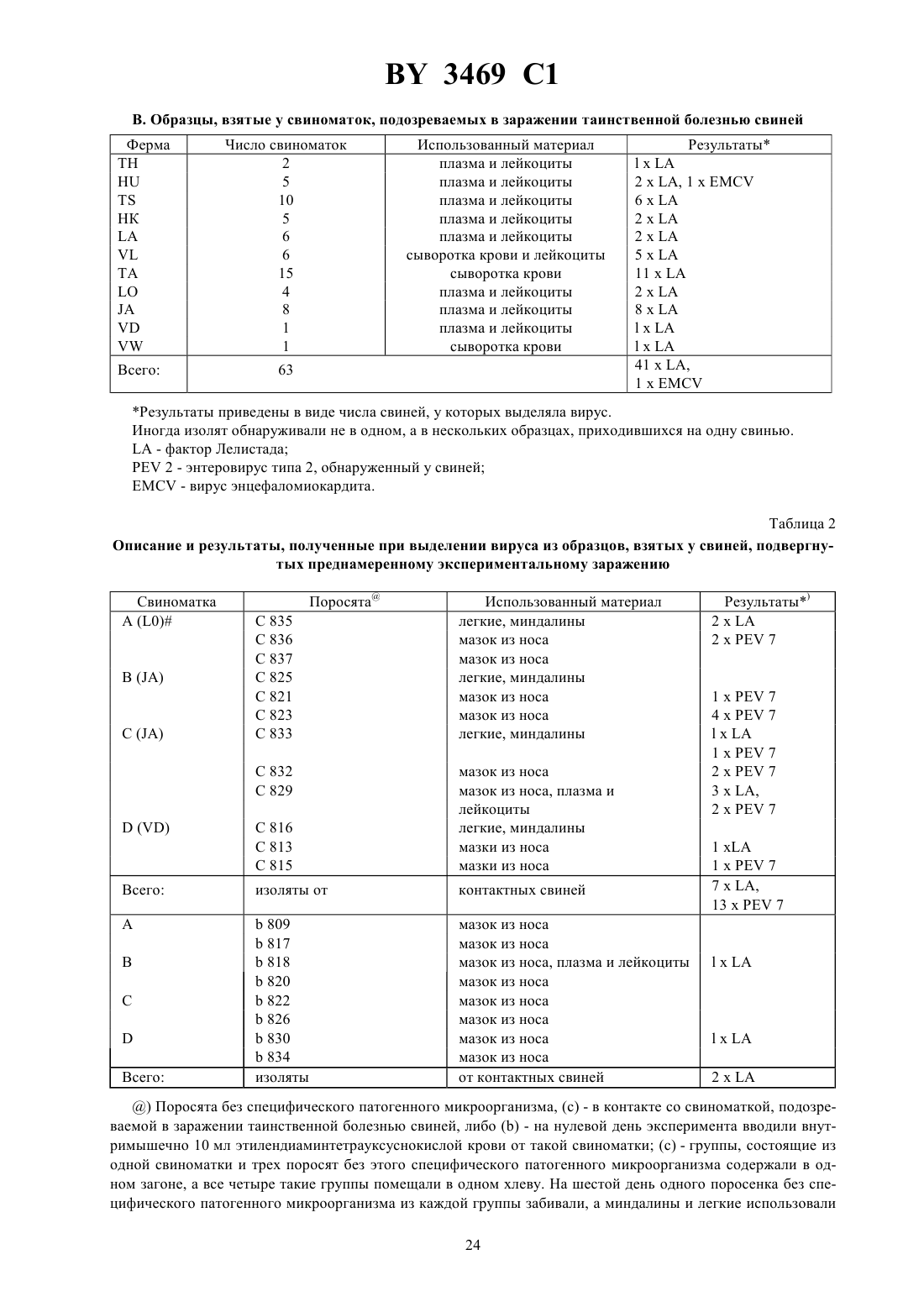
Композиции на основе фактора Лелистада
Номер патента: 3469
Опубликовано: 30.09.2000
Авторы: Йоханна Йакоба Мария Мэуленберг, Катаринус Терпстра, Йоаннес Мария Антонис Пол, Герт Венсворт, Робертус Йокобус Мария Морманн
Текст
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ КОМПОЗИЦИИ НА ОСНОВЕ ФАКТОРА ЛЕЛИСТАДА(71) Заявитель СТИХТИНГ СЕНТРАЛ ДИРГЕНЭСКЮНДИНГ ИНСТИТЮТ(72) Авторы Герт Венсворт, Катаринус Терпстра,Йоаннес Мария Антонис Пол, Робертус Йокобус Мария Морманн, Йоханна Йакоба Мария Мэуленберг(73) Патентообладатель СТИХТИНГ СЕНТРАЛ ДИРГЕНЭСКЮНДИНГ ИНСТИТЮТ(57) 1. Композиция на основе фактора Лелистада ( ), который является этиологическим фактором таинственного заболевания свиней , причем упомянутый фактор Лелистада по существу соответствует изоляту фактора Лелистада (- 2.91), депонированного под номером 1-1102 в институте Пастера. Фиг. 1 (17) 2. Композиция по п. 1, отличающаяся тем, что содержит инактивированный фактор Лелистада. 3. Композиция по п. 1, отличающаяся тем, что содержит аттенуированный фактор Лелистада. 4. Композиция по п. 1, отличающаяся тем, что содержит часть или компонент фактора Лелистада. 5. Композиция на основе рекомбинантного вектора, производного фактора Лелистада, который является этиологическим фактором таинственного заболевания свиней , причем упомянутый фактор Лелистада по существу соответствует изоляту фактора Лелистада (- 2.91), депонированного под номером 1-1102 в институте Пастера. 6. Композиция на основе изолированного или синтетического белка, полипептида или нуклеиновой кислоты, соответствующих фактору Лелистада, который является этиологическим фактором таинственного заболевания свиней , причем упомянутый фактор Лелистада по существу соответствует изоляту фактора Лелистада (- 2.91), депонированного под номером 1-1102 в институте Пастера. 7. Композиция по п. 6, отличающаяся тем, что содержит полипептид с аминокислотной последовательностью белка фактора Лелистада. 9 3469 1 8. Композиция по п. 6, отличающаяся тем, что содержит полипептид, имеющий аминокислотную последовательность фактора Лелистада, показанную на фиг. 1. Изобретение касается выделения, описания и использования возбудителя таинственного заболевания свиней. В изобретении используется открытие фактора, вызывающего заболевание, и проводится определение его геномной организации, геномной нуклеотидной последовательности и белков, закодированных геномом, что делается с целью защиты от инфекций и диагностики инфекций, в частности, защиты от инфекций таинственного заболевания свиней и диагностики таких инфекций. Зимой и ранней весной 1991 г. индустрия производства свиней в Дании понесла урон от внезапного появления нового заболевания у племенных свиноматок. У большинства свиноматок наблюдалась анорексия, у некоторых происходил выкидыш на поздней стадии беременности (примерно на 110 день), а также поросята рождались мертвыми или рождались мумифицированные плоды, у некоторых свиноматок наблюдалось лихорадочное состояние. Иногда обнаруживали свиноматок с посиневшими ушами, по этой причине заболевание получило название Абортус блау ( ). Заболевание у свиноматок часто сопровождалось появлением респираторного расстройства, смертью поросят и часто появлением респираторного заболевания и замедлением роста у подросших поросят и откармливаемых свиней. Причина этой эпизодического заболевания была неизвестна, однако симптомы напоминали симптомы аналогичного заболевания, возникшего в Германии с конца 1990 г., и напоминали симптомы, так называемой Таинственной болезни свиней , наблюдавшейся с 1987 г. на среднем западе Соединенных Штатов Америки и в Канаде 1. Для обозначения этой болезни использовались различные другие названия, в Германии она известна как Эпизодический поздний аборт у свиньи, а в Северной Америке она также известна как Таинственная болезнь свиней , Таинственный репродуктивный синдром и Синдром бесплодия свиней и респираторный синдром . В Северной Америке автором Лула (, 1990) были описаны общие клинические признаки болезни 1) отказ от пищи, слабое развитие в любом возрасте 2) выкидыши, рождение мертвого плода, слабые поросята, появление мумифицированного плода 3) респираторные проблемы после опороса 4) проблемы, связанные с размножением. Этиологический фактор не был идентифицирован, однако в качестве возможных причин были названы вирус энцефаломиокардита, парвовирус, вирус псевдобешенства, вирус свиного гриппа, вирус бычьей вирусной диареи, вирус свиной холеры, энтеровирусы, вирус заболевания, подобного гриппу, хламидии, лептоспиры (, 1990 и , 1990 и др.). Изобретение представляет собой композицию, включающую выделенный фактор Лелистада ,который является этиологическим фактором таинственного заболевания свиней, причем упомянутый фактор Лелистада в значительной мере соответствует выделенному изоляту фактора Лелистада (2.91), который был депонирован 5 июня 1991 г. в Институте Пастера, Париж, Франция, депозитный номер -1102. Выражение в значительной мере относятся к вариациям, которые встречаются в природе, а также к искусственным вариациям фактора Лелистада, особенно к тем, которые еще можно обнаружить такими способами,как гибридизация, способ полимерной цепной реакции, иммуносорбентный анализ с ферментной меткой,проводимыми с использованием специфических в отношении фактора Лелистада ДНК или специфических антител. В состав композиции могут входить инактивированный фактор Лелистада аттенуированный фактор Лелистада выделенная часть или компонент фактора Лелистада рекомбинантный вектор производного фактора Лелистада изолированный или синтетический белок, полипептид или нуклеиновая кислота, соответствующие фактору Лелистада полипептид с аминокислотной последовательностью белка фактора Лелистада полипептид, имеющий аминокислотную последовательность фактора Лелистада, который продуцируется клеткой, способной продуцировать его в силу своего генетического сочетания с надлежащей рекомбинантой ДНК. 10 3469 1 Настоящее изобретение является результатом совместных усилий Центрального ветеринарного института и региональных служб охраны здоровья животных Нидерландов в их стремлении найти причину нового заболевания, так называемой Таинственной болезни свиней. Фермы, на которых свиньи оказались подверженными новому заболеванию, посещали участковые ветеринары региональных служб охраны здоровья животных. Больных свиней, образцы, взятые у больных свиней, а также сыворотки, взятые у свиноматок в острый период заболевания и в период выздоровления, направляли для выделения вируса в региональные службы охраны здоровья животных и в Центральный ветеринарный институт. Парные сыворотки заболевших свиноматок тестировали на наличие антител, направленных против десяти известных вирусов у свиней. Были выделены три различных вируса, вирус энцефаломиокардита, свиной энтеровирус, фактор Лелистада. Свиноматки, которые были зарегистрированы как зараженные этой болезнью, характеризовались в основном сероконверсией в фактор Лелистада и редко в какой-либо из иных вирусных изоляторов или известных вирусных патогенных микрообразований. С целью экспериментального воспроизведения таинственной болезни свиней восемь беременных свиноматок были инокулированы интраназально фактором Лелистада на 84-й день беременности. Одна свиноматка на 109-й день беременности родила семь мертвых и четырех живых, но очень слабых поросят. Четверо живых поросят умерли через день после рождения. Еще одна свиноматка родила на 116-й день три мумифицированных плода, шесть мертвых поросят и трех живых поросят. Два живых поросенка умерли в течение дня. Третья свиноматка родила на 117-й день два мумифицированных плода,восемь мертвых и семь живых поросят. Другие свиноматки опоросились примерно на 115-й день и характеризовались менее тяжелыми репродуктивными потерями. Среднее число живых поросят от восьми свиноматок составило при рождении 7,3, а среднее число мертвых поросят при рождении было 4,6. Антитела, направленные против фактора Лелистада, были обнаружены в 10 из 42 образцов сыворотки, взятых до того,как поросята начали сосать. Фактор Лелистада был выделен у трех поросят, умерших вскоре после рождения. Эти результаты свидетельствуют в пользу вывода, что фактор Лелистада является причинным фактором появления таинственной болезни у свиней. Фактор Лелистада развивается с цитоплазматическим эффектом в легочных макрофагах свиней, и он может быть идентифицирован по окрашиванию при проведении иммунопероксидазномонослойного анализа с использованием постинфекционных сывороток свиней с номерами с 829 и 822 или с использованием любых иных постинфекционных сывороток- свиней, перечисленных в табл. 5. Антитела, направленные против фактора Лелистада, могут быть идентифицированы по методикам косвенного окрашивания при проведении иммунопероксидазномонослойного анализа. Фактор Лелистада не гемаглютинирует с эритроцитами, подвергнутыми тестированию. Фактор Лелистада характеризуется размером не менее 200 нм, поскольку он проходит через фильтр с порами этого размера. Фактор Лелистада обнаруживает чувствительность к хлороформу. Приведенные выше результаты свидетельствуют о том, что фактор Лелистада пока еще не идентифицирован как принадлежащий к определенной группе вирусов или к иному макробиологическому виду. Он был депонирован 5 июня 1991 г. под номером -1102 в Институте Пастера, Франция. Установлены геномная организация, нуклеотидные последовательности и полипептиды, установленные из таковых, у фактора Лелистада. Эти данные вместе с данными других исследователей подтверждают классификацию фактора Лелистада, называемого далее вирусом Лелистада, ЛВ, как члена нового семейства вирусов под названием Артеривириды. В качестве вируса-прототипа этого нового семейства предлагается взять вирус лошадиного артериита ((, первого члена нового семейства, для которого стали доступны данные о стратегии репликации генома и его организации (и др., 1990, с имеющимися ссылками). На основании сопоставления полученных данных о последовательностях с данными, имеющимися для вируса элевации лактатдегидрогеназы (-(и др., 1990, можно предположить, что вирус элевации лактатдегидрогеназы также является членом семейства вирусов Артеривиридов. Геномная организация и трансляционная стратегия семейства вирусов Артеривиридов достаточны для размещения этой новой семьи вирусов в суперсемье коронавирусов ( и др., 1990 а). Общим у артеривирусов является то, что их главными целевыми клетками у соответствующих хозяев являются макрофаги. Было показано, что репликация вируса элевации лактатдегидрогеназы ограничивается макрофагами их хозяина, например у мыши, тогда как склонность в отношении макрофаг не была еще пока выявлена у вирусов лошадиного артериита и вируса Лелистада. Артеривирусы представляют собой сферические заключенные в оболочку частицы диаметром 45-60 нм,содержащие иносаэдрический нуклеокапсид (- и 1975 и др. 1971 , 1973). Геном Артеривиридов состоит из положительной спиральной полиаденилированной РНК-молекулы размером, примерно, в 12000-13000 оснований (- и 1975 и др., 1975). Лошадиный артериитный вирус репликатирует через находящийся в 3-месте набор из шести субгеномных кислот мРНК размером от 800 до 3600 оснований, которые составляют лидерную последовательность, иду 11 3469 1 щую от 5-конца геномной РНК, которая соединяется с 3-концевыми последовательностями (и др.,1990). Геномная организация и репликационная стратегия вируса Лелистада похожи на таковые у вируса лошадиного артериита, коронавирусов и торовирусов, тогда как геномные размеры последних вирусов отличаются от таковых у вируса Лелистада и вируса лошадиного артериита. Геном вируса Лелистада состоит из геномной РНК-молекулы длиной примерно от 14500 до 16500 оснований (оценка произведена на нейтральном агарозном геле), которая репликатирует через находящийся в 3 месте набор из субгеномных кислот РНК. Субгеномные кислоты РНК состоят из лидерной последовательности, длина которой пока еще остается неизвестной, которая исходит из 5-конца геномной РНК и которая сливается с основными последовательностями, исходящими из 3-конца геномной РНК (фиг. 2). Нуклеотидная последовательность у геномной РНК вируса Лелистада была определена из анализа перекрывающихся кДНК-клонов. Консеквентная последовательность из 15088 пар оснований была получена покрытием почти полного генома вируса Лелистада (фиг. 1). У этой последовательности было идентифицировано 8 кадров открытого считывания кадр открытого считывания 1 А, кадр открытого считывания 1 В и кадры открытого считывания от 2 до 7. Считают, что кадры открытого считывания 1 Аи 1 В кодируют вирусную репликазу или полимеразу, тогда как кадры открытого считывания от 2 до 6 кодируют структурную вирусную мембрану (оболочку), т. е. связанные с ней белки. Считают, что кадр открытого считывания 7 кодирует структурный вирусный нуклеокапсидный белок. Поскольку продукты, отвечающие кадрам открытого считывания 6 и 7 вируса Лелистада, обнаруживают значительную схожесть соответственно с продуктами из областейивируса эливации лактатдегидрогеназы, можно полагать, что последовательности, соответствующие кадрам открытого считывания 6 и 7,должны быть также сильно консервативными среди антигенных вариантов вируса Лелистада. Полная нуклеотидная последовательность, показанная на фиг. 1, и все последовательности и белковые продукты, кодированные кадрами открытого считывания от 1 по 7 и, возможно, другие кадры открытого считывания, находящиеся на последовательности, показанной на фиг. 1, являются особенно пригодными для разработки вакцины независимо от вкладываемого здесь смысла и для разработки диагностических инструментов независимо от вкладываемого здесь смысла. Все возможные варианты и модификации хорошо известны специалистам в этой области техники. Поскольку теперь представляется возможным определенно идентифицировать фактор Лелистада, т. е. причинный фактор таинственной болезни свиней, можно теперь провести тестирование на зараженность свиней фактором Лелистада. Такие диагностические тесты пока еще никто не проводил. Тест может быть проведен посредством выделения вируса в макрофагах или в иных системах клеточной культуры, в которых может развиваться фактор Лелистада, и окрашивания инфицированных культур антителами, направленными против фактора Лелистада (такого, как постинфекционные сыворотки с 829 или 822), однако могут быть также разработаны и применены другие типы диагностических тестов. Например, можно использовать методики прямого или косвенного иммуногистологического окрашивания, т. е. проводить анализ с использованием антител, направленных против фактора Лелистада, который подвергается воздействию метки с флюоресцентными соединениями, такими как изотиоцианат, или воздействию метки с ферментами, такими как пероксидаза хрена обыкновенного. Эти методики могут быть использованы для обнаружения антигена фактора Лелистада в тканевых срезах или в иных образцах, взятых у свиней, подозреваемых в заболевании таинственной болезнью свиней. Антителами, необходимыми для этих тестов, могут быть антитела с 829 или 822 или иные поликлональные антитела, направленные против фактора Лелистада, но могут быть также использованы и моноклональные антитела, направленные против фактора Лелистада. Поскольку определены природа и организация генома фактора Лелистада и нуклеотидная последовательность этого генома, могут быть идентифицированы специфические нуклеотидные последовательности фактора Лелистада, и их можно использовать для создания олигонуклеотидных последовательностей, которые используются в качестве проб или примеров в диагностических методиках, таких как методика с гибридизацией, методика с полимеразной цепной реакцией или любые иные методики, разработанные для специфического обнаружения нуклеотидных кислотных последовательностей. Можно также провести тестирование на антитела, направленные против фактора Лелистада. Из табл. 5 видно, что у экспериментально зараженных свиней быстро появляются антитела, направленные против фактора Лелистада, из табл. 4 видно, что у свиней, относящихся к этой области, также быстро проявляются реакции антител, направленные против фактора Лелистада. Таким образом, теперь можно установить, были ли свиньи ранее заражены фактором Лелистада. Такое тестирование представляется исключительно важным при определении отсутствия фактора Лелистада у свиней, стада свиней, или популяций свиней, или у свиней целых регионов или стран. Тест может быть проведен с использованием иммунопероксидазномонослойного анализа, как это было описано ранее, но при этом могут быть также разработаны и применены другие 12 3469 1 типы диагностических тестов, направленных на обнаружение антител, направленных против фактора Лелистада. В таких тестах могут быть использованы специфические для фактора Лелистада белки, полипептиды и пептиды или пептидные последовательности, мимикрирующие антигенные компоненты фактора Лелистада. Белки могут быть выделены из самого фактора Лелистада, однако такие белки могут быть также приготовлены способами с использованием рекомбинантной ДНК или с использованием пептидного синтеза. При проведении этих тестов можно использовать специфические поликлональные и (одновременно или по отдельности) моноклональные антитела, направленные против фактора Лелистада, или специфические компоненты фактора Лелистада и (одновременно или по отдельности) клеточные системы, зараженные фактором Лелистада, или клеточные системы, экспрессирующие антиген фактора Лелистада. Антитела могут быть, например, использованы в качестве средства иммобилизации антигена фактора Лелистада (твердую поверхность покрывают антитела, после чего антиген фактора Лелистада связывают антителом), что сопровождается увеличением специфики теста, или могут быть использованы в конкурентном анализе (меченое антитело и неизвестное антитело, находящиеся в образце, конкурируют в отношении имеющегося антигена фактора Лелистада). Описанные выше диагностические возможности могут быть применены для тестирования других животных, таких как млекопитающие, птицы, насекомые или рыбы, или растений, или иных живых существ с целью установления возможности их заражения фактором Лелистада или родственными факторами с целью установления у них наличия такой инфекции в момент тестирования или с целью выявления их возможной зараженности в прошлом. Поскольку теперь фактор Лелистада идентифицирован как причинный фактор таинственной болезни свиней, может быть приготовлена вакцина, предназначенная для защиты свиней от этого заболевания. Фиг. 1 изображает нуклеотидную последовательность генома вируса Лелистада. Показана выведенная аминокислотная последовательность, отвечающая идентифицированным кадрам открытого считывания. Метионины, закодированные (предполагаемыми) -стартовыми сайтами, указываются жирным шрифтом, а предполагаемые сайты -гликозилирования даются подчеркиванием. Показаны различия у нуклеотидной и аминокислотной последовательности, как это идентифицировано посредством определения последовательности расположения аминокислотных остатков у различных кДНК-клонов. Подчеркиванием выделена нуклеотидная последовательность праймера 25, который был использован в гибридизационных экспериментах(фиг. 2 и раздел Результаты). Фиг. 2 изображает организацию генома вируса Лелистада. Клоны кДНК, которые были использованы для определения нуклеотидной последовательности, указаны в верхней части фигуры. Части клонов, которые были идентифицированы посредством определения последовательности расположения аминокислотных остатков, указываются черным. В нижней части фигуры показаны кадры открытого считывания, идентифицированные у нуклеотидной последовательности, и показан субгеномный набор мРНК, кодирующий эти кадры. Пунктирными линиями на этих кадрах открытого считывания представлены иные возможные сайты инициирования (-сайты), отвечающие этим кадрам. Лидерная последовательность у геномных и субгеномных кислот РНК показана заштрихованным прямоугольником. Фиг. 3 изображает характеристики роста фактора Лелистада пустые квадраты - титр вируса без клетки заштрихованные квадраты - титр вируса, ассоциированного с клеткой сплошная линия - цитопатический эффект, выраженный в процентах Сбор образцов. Образцы свиней собирали на фермах, где имело место эпизодическое заболевание таинственной болезнью свиней. Важными критериями при выборе фермы с отнесением ее к разряду зараженных таинственной болезнью свиней были следующие критерии наличие свиноматок, отказывающихся от пищи, наличие мертворожденных плодов и выкидыши, слабое потомство, респираторное заболевание и смерть среди поросят. Исследованию были подвергнуты образцы, взятые у свиней четырех групп 1) образцы ткани и мазки со слизистой оболочки полости рта, взятые у больных поросят (табл. 1 А) 2) образцы крови и мазки со слизистой оболочки полости рта, взятые у больных свиноматок(табл. 1 В и 4) 3) образцы ткани и назальные мазки и образцы крови, собранные у свиней без специфического патогенного микроорганизма, экспериментально зараженных посредством контакта с больными свиноматками или 4) образцы ткани, назальные мазки и образцы крови, собранные у свиней без специфического патогенного микроорганизма, экспериментально зараженных посредством инокуляции образцами крови, взятыми у больных свиноматок (табл. 2 и 5). Приготовление образцов. Образцы, необходимые для выделения вируса, получали от поросят и свиноматок, которые по клиническим данным подозревались в заболевании таинственной болезнью свиней, а также от экспериментально зараженных свиней, свиноматок и поросят, не имеющих этого специфического патогенного микроорганизма. 13 3469 1 Образцы ткани срезали на криостатном микротоме, а срезы подвергали прямому иммунофлюоресцентному тестированию с конъюгатами, направленными против различных патогенных микроорганизмов у свиней. Образцы тканей в виде 10 -ной суспензии готовили в буферном солевом растворе Хэнка ( ) с добавлением антибиотиков, и оральные и назальные мазки помещали в буферный солевой раствор Хэнка с добавлением антибиотиков. После выдержки в течение одного часа при комнатной температуре суспензии осветляли центрифугированием в течение 10 мин при 6000 об. х уд. массу, и надосадочные жидкости хранили при -70 С для дальнейшего использования. Лейкоцитные фракции отделяли от этилендиаминтетрауксусной кислоты или от крови гепарина, как описано ранее ( и , 1988), и хранили при -70 С. Плазму и сыворотку, предназначенные для выделения вируса, хранили при -70 С. Сыворотку для проведения серологии брали у свиноматок, подозреваемых в заболевании в острой форме таинственной болезнью свиней, парную сыворотку брали через 3-9 недель. Кроме того, сыворотки брали у экспериментально зараженных свиней, не имевших ранее этого специфического патогенного микроорганизма. Забор сыворотки повторяли через определенные промежутки времени, а молозиво и сыворотку брали у экспериментально зараженных свиноматок и их поросят. Сыворотки, необходимые для проведения серологии, хранили при -20 С. Клетки. Легочные макрофаги свиней получали из легких свиней в возрасте 5-6 недель без этого специфического патогенного микроорганизма и из легких взрослых свиноматок без этого специфического патогенного микроорганизма, взятых из собственного стада Центрального ветеринарного института. Легкие промывали от пяти до восьми раз фосфатно-солевым буферным раствором. Каждую аликвоту промывной воды собирали и центрифугировали в течение 10 мин при 300 об.х уд.массу. Результирующий клеточный остаток от центрифугирования снова промывали фосфатно-солевым буферным раствором и вновь суспендировали в среде,предназначенной для содержания клеточной культуры (160 мл среды 199 с добавлением 20 мл 2,95 -ного триптозофосфата, 20 мл сыворотки плода коровы и 4,5 мл 1,4 -ного бикарбоната натрия), доводя концентрацию до 4 х 107 клеток/мл. Клеточную суспензию затем медленно смешивали с равным объемом диметилсульфоксидной смеси (6,7 мл указанной выше среды, 1,3 мл сыворотки плода коровы, 2 мл 97 -ного диметилсульфоксида), фасовали в ампулы на аликвоты по 2 мл и хранили в жидком азоте. Макрофаги, взятые из одной ампулы, готовили для клеточной культуры двухкратной промывкой растворомЭрла ( ) и вновь суспендировали в 30 мл среды роста (средаЭрла с добавлением 10 -ной сыворотки плода коровы, пенициллина в количестве 200 ед/мл, 0,2 мг/мл стрептомицина,100 ед/мл микостатина и 0,3 мг/мл глутамина). Клетки линии РК-15 (Американская коллекция типовых культур микроорганизмов,33) и клетки линии -6 ( и др.,1972) выращивали, как описано у Уэнсвурта и др. ( и др., 1989). Вторичные почечные (РК 2) клетки свиней выращивали в средеЭрла при добавлении 10 -ной сыворотки плода коровы и указанных выше антибиотиков. Все клетки выращивали в камере, предназначенной для выращивания точных культур, что делали при 37 С и 5 содержании углерода. Методики выделения вирусов. Выделение вирусов производили, согласно установленным методикам, при использовании клеток РК 2,РК-15 и -6 и свиных легочных макрофагов. Первые три разновидности клеток выращивали в 25 мл склянках Грейнера и инокулировали опытным образцом, когда захват монослойным покрытием достигал 70-80 . Макрофаги засевали в аликвотах на 100 мкл, находящихся на микротитраторных пластинах на 96 углублений (Грейнер), или при больших объемах в надлежащих склянках и инокулировали опытным образцом в пределах одного часа после засевания. Культуры просматривали ежедневно на наличие цитопатических эффектов и замораживали при -70 С, когда цитоплазматический эффект доходил до 50-70 или после 5-10 дней развития культуры. Дальнейшие пассажи производили на замороженном-оттаявшем материале пассажного уровня 1 и 2 или выше. Некоторые образцы инокулировали также на девятый-двенадцатый день куриными яйцами с развивающимся эмбрионом. Аллантоиновую среду субинокулировали два раза при использовании инкубационного интервала в три дня и собранные клетки третьего пассажа, выросшие в культуре,обследовали проведением гемагглютинации при 4 С с использованием эритроцитов цыпленка и проведением иммуносорбентного анализа с ферментной меткой для специального обнаружения нуклеопротеида вирусов гриппа А (и др., 1990). Серология. Сыворотки тестировали проведением тестов по гемагглютинирующему ингибированию с целью изучения развития антитела, направленного против вируса гемагглютинирующего энцефалита и вирусов свиного гриппаи 32, что делали согласно прописи Мазурела (, 1976). Начальные разбавления сывороток в тестах по гемагглютинирующему ингибированию составляли 19, после чего сыворотки разбавляли вдвое. Сыворотки тестировали в установленных иммуносорбентных анализах с ферментной меткой на антитела,направленные против гликопротеидоввируса псевдобешенства (и др.,1988), свиного 14 3469 1 парвовируса (и др. 1989), вируса бычей вирусной диареи (и др., 1986) и вируса свиной холеры (и др., 1988). Начальные разбавления в тестах с иммуносорбентным анализом с ферментной меткой составляли 15, после чего сыворотки разбавляли вдвое. Сыворотки тестировали на нейтрализацию антител, направленных против доз 30-300 ТС 50 вирусов энцефаломиокардита, свиных энтеровирусов и фактора Лелистада, что делали согласно прописи Терпстра(, 1978). Начальные разбавления сывороток в тестах по нейтрализации сыворотки составляли 15, после чего сыворотки разбавляли вдвое. Сыворотки тестировали на связывание с фактором Лелистада, проводя иммунопероксидазномонослойный анализ. Фактор Лелистада ( код 2.91) засевали на микротитраторных пластинах добавлением 50 мл среды для выращивания, содержащей 100 50 фактора Лелистада, в углубления микротитраторной пластины, содержащей свежезасеянные легочные макрофаги. Клетки выращивали в течение двух дней, а затем фиксировали, как описано в литературе (, 1986). Тестируемые сыворотки разбавляли в соотношении 110 смесью, содержащей 0,15 м хлорида натрия, 0,05 твина 80, 4 лошадиной сыворотки,или разбавляли еще сильнее, производя последовательные четырехкратные разбавления с добавлением в углубления, а затем инкубировали в течение одного часа при 37 С. Овечьи-анти-свиные иммуноглобулины,конъюгированные с пероксидазой хрена обыкновенного (фирма ДАКО), разбавляли тем же самым буферным раствором и использовали при втором инкубировании, которое проводили в течение одного часа при 37 С, после чего пластины окрашивали, как описано в литературе ( и др., 1986). Окрашивание цитоплазмы в интенсивный красный цвет у инфектированных макрофагов указывало на наличие связывания сывороток с фактором Лелистада. Методики идентификации вирусов. Идентичность цитоплазматических изолятов устанавливали определением пловучей плотности в хлориде цезия, оценкой размера частиц в негативно окрашенных препаратах посредством электронной микроскопии,определением чувствительности изолята к хлороформу и нейтрализацией цитопатического эффекта у изолята сыворотками с известной специфичностью (табл. 3). Всякий раз, когда изолят оказывался специфически нейтрализованной сывороткой, направленной против известного вируса, считали, что изолят является представительным для этого известного вируса. Изоляты, которые обнаруживали цитопатический эффект на макрофаговых культурах, также подвергали исследованию окрашиванием с проведением иммунопероксидазномонослойного анализа в условиях постинфекции сыворотками от свиней с 829 или 822. Изоляты реинокулировали на макрофаговых культурах и фиксировали на второй день после инокуляции до проявления изолятом цитоплазматического эффекта. Всякий раз, когда изолят обнаруживал реактивность в условиях проведения иммунопероксидазномонослойного анализа с постинфекцией сыворотками от свиней с 829 или 822, считали, что изолят является представительным для фактора Лелистада. Представительные образцы других изолятов, выращенных в макрофагах или в неинфицированных макрофагах, также подвергали окрашиванию этими сыворотками, что делали с целью проверки специфичности сывороток. Дальнейшая идентификация фактора Лелистада. Фактор Лелистада подвергали дальнейшему изучению методом гемагглютинации, проводимой при 4 С и при 37 С с использованием красных кровяных телец 0, взятый у цыпленка, морской свинки, свиньи, овцы или человека. При проведении гемагглютинационных исследований в качестве положительного контрольного теста использовали тест с вирусом свиного гриппа, подтип 32. Связывание свиных антисывороток, специфически направленных против вируса псевдобешенства, вируса передаваемого гастроэнтерита, вируса свиной эпидемической диареи, вируса гемагглютинирующего энцефалита, вируса африканской лихорадки свиней, вируса свиной холеры и вируса свиного гриппа типаи 32, бычих антисывороток, специфически направленных против вирусов бычьего герпеса типа 1 и 4, вируса злокачественной герпетической лихорадки, вируса парагриппа 3, бычего респираторно-синцитиального вируса и вируса бычего лейкоза, и птичих антисывороток, специфически направленных против вируса лейкоза птиц и вируса инфекционного бронхита, изучали с использованием специфических иммуноглобулиновых конъюгатов пероксидазы хрена обыкновенного в условиях проведения иммунопероксидазномонослойного анализа на свиных легочных макрофагах, инфициированных и неинфицированных фактором Лелистада, как описано выше. Иммунопероксидазномонослойному анализу подвергали тестированию также антисыворотки различных видов, направленные против вируса эпидемического паротита, вируса Сендаи , вируса собачьей чумы, вируса чумы рогатого скота, вируса кори, вируса пневмонии мышей, бычьего респираторносинцитиального вируса, вируса бешенства ( ), вируса бешенства ( ), вируса заболевания маеди-висна (- ), вируса бычьего и муриновоголейкоза, вируса иммунодефицита человека, кошек и обезьян, вируса лимфоцитарного хориоменингита, вируса кошачьего инфекционного перитонита, вируса мышиного гепатита, вируса Бреда , вируса Гантаана , вируса найробийской болезни овец, вируса восточного, западного и венесуэльского энцефалопиелита у лошадей, вируса коревой 3469 1 краснухи, вируса артериита у лошадей, молочного дегидрогеназного вируса, вируса желтой лихорадки, вируса клещевого энцефалита и вируса гепатита С. Фактор Лелистада вслепую подвергали пассажу в клетках РК 2, РК-15 и -6 и в куриных яйцах с развивающимся эмбрионом. После двух пассажей материал снова инокулировали в свиных легочных макрофаговых культурах для повторного выделения фактора Лелистада. Фактор Лелистада титровали в свиных легочных макрофагах до и после пропускания через фильтр с размером отверстий 0,2 мкм . Фактор Лелистада обнаруживали проведением иммунопероксидазномонослойного анализа и по его цитоплазматическому эффекту. Титры рассчитывали согласно Риду и Мюнху (, 1938). Затем готовили свиную антисыворотку, направленную против фактора Лелистада. Две свиньи (21 и 23) без специфического патогенного микроорганизма, инфицировали интразально дозой 10550 материалом,взятым от пятого пассажа клеточной культуры фактора Лелистада. Две другие свиньи без специфического патогенного микроорганизма инфицировали интразально свежей суспензией дозой по фактору Лелистада в 10550, которая была приготовлена из легочной ткани поросят без специфического патогенного микроорганизма, но инфицированных им. Образцы крови брали на 0, 14, 28 и 42 постинфекционные дни. Далее фактор Лелистада выращивали в альвеолярных макрофагах свиней с целью установления их временной характеристики роста. Свиные альвеолярные макрофаги засевали в 25 мл склянках Грейнера, инфицировали фактором Лелистада с множественностью заражения 0,01 50 на клетку. Через 8, 16, 24, 32,40, 48, 56 и 64 часов после заражения исследовали одну склянку и определяли процентную величину цитоплазматического эффекта в сравнении с неинфицированной контрольной культурой. Производили сбор клеток из среды с культурой, и изъятое количество заменяли равным объемом фосфатно-солевого буферного раствора. Среду и склянку хранили при -70 С. После сбора всех культур определяли титры фактора Лелистада и выражали их как логарифм 10 50 мл-1. Морфологию фактора Лелистада изучали посредством электронной микроскопии. Фактор Лелистада культивировали, как описано выше. Через 48 ч культуры подвергали замораживанию-оттаиванию и центрифугировали в течение 10 мин при 6000 об.х уд.массу. Примерно 30 мл надосадочной жидкости смешивали затем с 0,3 мл специфической в отношении фактора Лелистада свиной сыворотки и инкубировали в течение 1,5 ч при 37 С. После центрифугирования в течение 30 мин при 125000 об.х уд. массу результирующий твердый осадок суспензировали в 1 -ной агарозной среде Сикема , находящуюся в фосфатносолевом буферном растворе при 40 С. После коагуляции агарозный блок погружали в 0,8 -ный глутаровый альдегид и 0,8 -ный тетраоксид осмия ( и др., 1968), находящиеся в веронально-ацетатном буферном растворе с величиной рН 7,4 (230 мОсмий/кг воды), и фиксировали микроволновым излучением. Эту методику повторяли один раз с использованием свежего фиксатора. Образец промывали водой, погружали в 1 -ный раствор уранилацетата и окрашивали микроволновым облучением. На протяжении всех этапов образец держали при 0 С, и помещали в микроволновой прибор Самсунг - 1211 для оттаивания в течение 5 мин. Тонкие срезы готовили по стандартным методикам, окрашивали цитратом свинца ( и др., 1965) и обследовали на электронном микроскопе Филипс - СМ 10. Далее продолжали выделение фактора Лелистада из сывороток свиней, которые были получены в случаях заболевания таинственной болезнью свиней. Образцы сыворотки привезли из Нидерландов (случай заболевания Нидерланды 2), из Германии (случаи заболевания Германия 1 и Германия 2), из Соединенных Штатов (эксперимент осуществлен с использованием образца -2332, взятого из Американской коллекции типовых культур микроорганизмов случаи заболевания Соединенные Штаты 2 и Соединенные Штаты 3). Все образцы направляли в институт,для диагноза в отношении фактора Лелистада. Все образцы использовали для выделения вируса, проводимого на альвеолярных макрофагах свиней, как описано выше. Цитопатические изоляты трижды подвергали пассажу и идентифицировали как содержащие фактор Лелистада проведением специфического иммуноокрашивания с использованием постинфекционных сывороток, имеющих номера 822 и с 829, направленных против фактора Лелистада. Изучали также антигенные взаимосвязи изолятов ( 1 (первый изолят фактора Лелистада код -2.91), 2, 1, 2, 1, 2 и 3. Изоляты выращивали в макрофагах, как описывалось выше, и подвергали тестированию проведением иммунопероксидазномонослойного анализа с использованием совокупности из сывороток, выделенных при реальном заболевании, и двух наборов экспериментальных сывороток. Сыворотки также тестировали проведением иммунопероксидазномонослойного анализа с использованием неинфектированных макрофаг. Сыворотки от действительных заболеваний были следующими. Две сыворотки, положительные в отношении вируса Лелистада (ТН-187 и -36), были выбраны из совокупности сывороток от действительных заболеваний, присланных из-за границы в Лелистад для установления серологического диагноза. Сыворотки были получены из Германии (ВЕ-352, ВЕ-392 и -2), из Великобритании (РА-141615, РА-141617 и РА 142440), из Бельгии (РЕ-1960), из Франции (ЕА-2975 и ЕА-2985), из Соединенных Штатов (-441, -451, 16-9577, -10814/33, -4994, -7252, - 41, -М 44 и - 45), из Канады (-16, -19, 22 и -23). Экспериментальными сыворотками были следующие сыворотки описанный выше набор сывороток от свиней 21, 23, 25 и 29, взятых на 0, 14, 28 и 42 постинфекционные дни набор экспериментальных сывороток от четырех шестимесячных поросят, зараженных интраназально дозой величиной 105,150 от изолята 2332 из Американской коллекции типовых культур микроорганизмов. Образцы крови брали у молодой свиньи 2 В на 0, 20, 36 и 63 постинфекционные дни у молодой свиньи 9 - на 0, 40, 44 и 68 постинфекционные дни у молодой свиньи 16 - на 0, 25, 40 и 64 постинфекционные дни и у молодой свиньи 16 У - на 0, 36 и 64 постинфекционные дни. Для изучения радиоиммуноосадительным анализом (и др., 1986) белков фактора Лелистада, находящихся в свиных альвеолярных макрофагах, выращивали инфицированные фактором Лелистада и неинфицированные макрофаги в течение 16 ч в присутствии меченой среды, содержащей 35-цистеин. Клетки с меткой осаждали, следуя стандартным методикам, с использованием постинфекционных сывороток 42 го постинфекционного дня от свиней 822 и 23 и с использованием сыворотки 8, которая была получена через 26 дней после инфицирования свиноматки изолятом -2332, взятым из Американской коллекции типовых культур микроорганизмов. Осажденные белки анализировали при помощи электрофореза в 12 -ном полиакриламидном геле с додецилсульфатом натрия и проводили флюорографию. Для определения характеристик генома фактора Лелистада экстрагировали ядерную ДНК и цитоплазматическую РНК из макрофаговых культур, которые были инфицированы фактором Лелистада и выращивались в течение 24 ч или находились в неинфицированном состоянии. Среду, в которой находилась культура клеток, отделяли, и клетки дважды промывали фосфатно-солевым буферным раствором. ДНК экстрагировали, как описано в литературе (, 1987). Цитоплазматическую РНК экстрагировали так, как описано в литературе ( и др., 1980), очищали центрифугированием через хлорид цезия с концентрацией 5,7 М( и др., 1980), обрабатывали свободной от рибонуклеазы дезоксирибонуклеазой (фирма Фармация) и анализировали в 0,8 -ном нейтральном агарозном геле ( и , 1988). Клонирование и секвенирование. С целью клонирования РНК вируса Лелистада внутриклеточную РНК альвеолярных макрофагов (10 мг) свиней, инфицированных вирусов Лелистада, инкубировали вместе с 10 мМ гидроксида метилртути в течение 10 мин при комнатной температуре. Денатурированную РНК инкубировали при 42 С совместно с 50 мМ - с рН 7,8, 10 мМ хлорида магния, 70 мМ хлорида калия, 0,5 мМ дАТФ, дЦТФ, дГТФ и дТТФ,0,6 мкг олигонуклеотидных праймеров из тимуса теленка 6 (фирма Фармация) и 300 ед. обратной транскриптазы вируса Молони муринового лейкоза , в общем объеме 100 мкл. По прошествии часа добавляли 20 мМ этилендиаминтетрауксусной кислоты, затем реакционную смесь экстрагировали смесью фенола с хлороформом, пропускали через колонку с сефадексом 50 и осаждали этанолом. Для синтеза второй кДНК-спирали использовали ДНК-полимеразу 1 (фирма Боерингер) и рибонуклеазу Н (фирма Фармация) ( и , 1983). Для образования тупых концов на окончаниях двухспиральную кДНК инкубировали совместно с ДНК-полимеразой Т 4 (фирма Фармация), делая это в реакционной смеси, которая содержала 0,05 мМ дезоксинуклеотидтрифосфатов. Затем кДНК фракционировали в 0,8 -ном нейтральном агарозном геле ( и , 1988). Фрагменты размером от 1000 до 4000 оснований электроэлюировали, вставляли в сайтплазмиды -4 (фирма Промега) и использовали для трансформации штамма 5 культуры(, 1985). Фильтры с колониями подвергали гибридизации с использованием односпиральной кДНК-пробы с меткой в виде 32 . Пробу подвергали обратному транскрибированию из РНК вируса Лелистада, которая была подвергнута фракционированию в нейтральном агарозном геле ( и , 1988). Перед использованием односпиральную ДНК-пробу инкубировали совместно с цитоплазматической РНК, выделенной из ложно инфицированных легочных альвеолярных макрофаг. Взаимосвязь между кДНК-клонами вируса Лелистада определяли проведением анализа с использованием ограничительных ферментов и проведением гибридизаации с образованием пятен по Садернуна расщепленной ДНК при использовании транслированных в определенном месте кДНК-проб ( и др.,1989). Для получения 3-конца у вирусного генома конструировали вторую кДНК-библиотеку, для чего использовали олигообразование 12-18 и олигонуклеотид, специфический в отношении 3-геному со спиралью отрицательного направления его использовали в качестве примера в реакции с первой спиралью. Реакционные условия, имевшие место при проведении синтеза первой и второй спиралей, были идентичны описанным выше. Эту библиотеку сортировали, используя олигонуклеотидные пробы, специфические в отношении вирусного 3-конца. 3469 1 Большую часть (более 95 ) кДНК-последовательности определяли, используя автоматический лазерный флюорисцентный ДНК-секвенсер , ,ТМ фирмы. Определение последовательного порядка расположения аминокислотных остатков, направляемое флюоресцентным олигонуклеотидным праймером,проводили на двухспиральной ДНК при использовании набора ТМ (товарный знак фирмы Фармация), что в существенной мере соответствовало методикам С и Д, описанным в инструкции к набору. Флюоресцентные праймеры готовили с использованием материала(товарный знак фирмы Фармация). Оставшуюся часть последовательности определяли посредством секвенсирования двухспиральной ДНК с использованием олигонуклеотидных праймеров в сочетании с набором последовательностей на основе Т 7-полимеров (Фармация), и с -32 -дАТФ (фирма Амершам). Данные о последовательности анализировали с использованием программ(фирма , ., Маунтаин-Вью, США) и( и , 1988). Экспериментальная репродукция таинственной болезни свиней. Четырнадцать беременных свиноматок в количестве 14 особей, беременность которых продолжалась уже в течение 10-12 недель, тестировали на наличие антитела, направленного против фактора Лелистада, для чего проводили иммунопероксидазномонослойный анализ. Все они дали отрицательный результат. Затем были образованы две группы по четыре свиноматки и доставлены в Центральный ветеринарный институт. На 12 ю неделю беременности эти свиноматки были инокулированы интраназально 2 мл фактора Лелистада (число пассажей равнялось трем, титр составлял 104,850 на 1 мл). Сыворотку и этилендиаминтетрауксуснокислотные образцы крови брали на 10-й день после инокуляции. Ежедневно регистрировали потребление пищи,ректальную температуру и другие клинические симптомы. При опоросе регистрировали дату рождения и число мертвых и живых поросят, приходящихся на одну свиноматку и брали образцы, необходимые для выделения вирусов и проведения серологии. РЕЗУЛЬТАТЫ. Иммунофлюоресценция. Тканевые срезы, взятые у свиней, зараженных таинственной болезнью свиней, окрашивали проведением иммунофлюоресцентного тестирования с использованием -конъюгатов, направленных против вируса африканской лихорадки свиней, вируса свиной холеры, вируса псевдобешенства, свиного парвовируса, вируса свиного гриппа, вируса энцефаломиокардита и культуры. Срезы подвергали окрашиванию, обследовали методом флюоресцентной микроскопии и было установлено, что все они дают отрицательный результат. Выделение вируса у поросят, взятых на фермах, зараженных таинственной болезнью свиней. Цитопатические изоляты обнаруживали в макрофаговых культурах, инокулированных тканевыми образцами, взятыми у поросят в возрасте от двух до десяти дней, которые были инфицированы таинственной болезнью свиней. Положительными оказались 16 из 19 поросят, взятых на пяти различных фермах (табл. 1 А). Все эти изоляты взаимодействовали при проведении иммунопероксидазномонослойного анализа с постинфекционной сывороткой свиньи с 829, тогда как неинокулированные контрольные культуры не взаимодействовали. Следовательно, эти изоляты оказались представительными для фактора Лелистада. Один раз цитопатический изолят был обнаружен в культуре клеток -6, инокулированной суспензией мазка со слизистой оболочки полости рта поросенка с шестой фермы (ферма ) (табл. 1 А). Этот изолят обнаруживал характеристики пикорнавирусов, и его нейтрализовали сывороткой, специфической в отношении свиного энтеровируса 2 по этой причине изолят был идентифицирован как свиной энтеровирус 2 (табл. 3). Клетки РК 2,РК-15 и куриные яйца, инокулированные образцами этой группы, оставались всегда отрицательными. Выделение вирусов у свиноматок, взятых на фермах, зараженных таинственной болезнью свиней. Цитопатические изоляты обнаруживали в макрофаговых культурах, инокулированных тканевыми образцами, взятыми у свиноматок, инфектированных таинственной болезнью свиней. У 41-й из 63 свиноматок,взятых на 11 фермах, результат оказался положительным (табл. 1 В). Все эти изоляты при проведении иммунопероксидазномонослойного анализа взаимодействовали с постинфекционной сывороткой свиньи 822, и они, следовательно, были представительными для фактора Лелистада. В одном случае цитопатический изолят был обнаружен в культуре клеток РК 2, инокулированной суспензией лейкоцитовой фракции, взятой у свиноматки с фермы(табл. 1 В). Этот изолят обнаруживал характеристики пикорнавирусов, и его нейтрализовали сывороткой, специфической в отношении вируса энцефаломиокардита по этой причине изолят был идентифицирован как вирус энцефаломиокардита (табл. 3). Клетки -6, РК-15 и куриные яйца, инокулированные образцами этой группы, давали отрицательный результат. Выделение вирусов у свиней, не зараженных специфическими патогенными микроорганизмами,которые находились в контакте со свиноматками, зараженными таинственной болезнью свиней. Цитопатические изоляты обнаруживали в макрофаговых культурах, инокулированных образцами, взятыми у свиней, не зараженных свободными специфическими патогенными микроорганизмами, находившихся в контакте со свиноматками, зараженными таинственной болезнью свиней. Четыре из 12 свиней дали положительный результат (табл. 2). Все эти изоляты при проведении иммунопероксидазномонослойного анализа 18 3469 1 взаимодействовали с постинфекционной сывороткой свиньи с 829 и свиньи 822 и, следовательно, они были представительными для фактора Лелистада. Цитопатические изоляты обнаруживали также в клеточных культурах РК 2, РК-15 и -6, инокулированных образцами этих свободных от специфического патогенного микроорганизма свиней. Семь из 12 свиней дали положительный результат (табл. 2) все эти изоляты были нейтрализованы сывороткой, направленной против свиного энтеровируса 7 ( 7). Один из этих семи изолятов был подвергнут дополнительному исследованию и другие характеристики также идентифицировали изолят как 7 (табл. 3). Выделение вирусов у свиней, не зараженных свободными специфическими патогенными микроорганизмами, которые были инокулированы кровью свиноматок, зараженных таинственной болезнью свиней. Цитопатические изоляты обнаруживали в макрофаговых культурах, инокулированных образцами, взятыми у свиней, не зараженных специфическими патогенными микроорганизмами, инокулированных кровью свиноматок, зараженных таинственной болезнью свиней. У двух из восьми свиней результат оказался положительный (табл. 2). Все эти изоляты при проведении иммунопероксидазномонослойного анализа взаимодействовали с постинфекционной сывороткой свиньи с 829 и свиньи 822 и, следовательно, они были представительными для фактора Лелистада. Клетки РК 2, РК-15 и -6, инокулированные образцами этой группы, дали положительный результат. Суммируя сказанное выше, следует сказать, что четыре группы свиней были подвергнуты тестированию на наличие факторов, которые могут быть связаны с таинственной болезнью свиней. В одной группе у поросят, инфицированных таинственной болезнью свиней, фактор Лелистада был выделен у 16 из 20 поросят один раз был выделен свиной энтеровирус 2 (2). Во второй группе у свиноматок, инфицированных таинственной болезнью свиней, фактор Лелистада был выделен у 41 из 63 свиноматок один раз был выделен вирус энцефаломиокардита. Кроме того, у 123 из 165 свиноматок, инфицированных таинственной болезнью свиней, имела место сероконверсия в фактор Лелистада, как это было установлено тестированием с проведением иммунопероксидазномонослойного анализа. Такая массовая сероконверсия не проявлялась против каких-либо других вирусных патогенных микроорганизмов, подвергнутых тестированию. В третьей группе у свиней, не зараженных специфическими патогенными микроорганизмами, находящихся в контакте со свиноматками, зараженными таинственной болезнью свиней, фактор Лелистада был выделен у четырех из 12 поросят у семи поросят был выделен свиной энтеровирус 7 (7). У всех 12 свиней имела место сероконверсия в фактор Лелистада и в свиной энтеровирус 7 (7). В четвертой группе у свиней, не зараженных специфическими патогенными микроорганизмами, инокулированных кровью свиноматок, зараженных таинственной болезнью свиней, фактор Лелистада был выделен у двух свиней. Все восемь свиней обнаружили сероконверсию в фактор Лелистада. Серология свиноматок, взятых на фермах, зараженных таинственной болезнью свиней. Парные сыворотки, взятые у свиноматок, зараженных таинственной болезнью свиней, тестировали в отношении разнообразных вирусных патогенных микроорганизмов и в отношении изолятов, полученных при проведении этого исследования (табл. 4). Поразительно сильная антительная реакция, направленная против фактора Лелистада, была измерена в условиях проведения иммунопероксидазномонослойного анализа (75 свиноматок оказались сероконвертированными сероконверсию обнаружили на 23 фермах из 26). Тогда как ни один из других патогенных микроорганизмов не давал четкой картины сероконверсии. Нейтрализующие антитела, направленные против фактора Лелистада, обнаружены не были. Серология свиней, не зараженных специфическими патогенными микроорганизмами, находившихся в контакте со свиноматками, зараженными таинственной болезнью свиней. Все восемь свиней без специфических патогенных микроорганизмов обнаруживали антитело, направленное в условиях проведения иммунопероксидазномонослойного анализа против фактора Лелистада (табл. 5). Ни одна из этих сывороток не давала положительного результата при проведении иммунопероксидазномонослойного анализа, выполненного при неинфицированных макрофагах. Ни одна из этих сывороток не давала положительного результата в сывороточном нейтрализационном тесте в отношении фактора Лелистада. Все сыворотки, взятые через две недели после возникновения контакта, обладали высокими нейтрализующими антительными титрами (более 1280) против свиного энтеровируса 7 ( 7), тогда как прединфекционные сыворотки давали отрицательный результат (менее 10), указывая на то, что все свиньи были также инфицированы свиным энтеровирусом 7 ( 7). Серология свиней, не зараженных специфическими патогенными микроорганизмами, инокулированных кровью свиноматок, зараженных таинственной болезнью свиней. Все восемь свиней без специфических патогенных микроорганизмов обнаруживали антительную реакцию в иммунопероксидазномонослойном анализе, направленную против фактора Лелистада (табл. 5). Ни одна из этих сывороток не давала положительного результата в иммунопероксидазномонослойном анализе,19 3469 1 выполненном на неинфицированных макрофагах. Ни одна из этих сывороток не давала положительного результата в сывороточном нейтрализационном тесте в отношении фактора Лелистада. Прединфекционная и двухнедельная постинфекционная сыворотки давали отрицательный результат (менее 10) против свиного энтеровируса 7 ( 7). Дальнейшая идентификация фактора Лелистада. Фактор Лелистада не гемагглютинирует с О-красными кровяными тельцами цыпленка, морской свинки,свиньи, овцы или человека. Фактор Лелистада не взаимодействует в иммунопероксидазномонослойном анализе с сыворотками, направленными против вируса псевдобешенства, вируса передаваемого гастроэнтерита, вируса свиной эпидемической диареи, вируса африканской лихорадки свиней и т. д. После двух неконтролируемых пассажей фактор Лелистада не растет в клетках РК 2, РК-15 или -6 или в куриных яйцах с развивающимся эмбрионом, инокулированным аллантоическим путем. Фактор Лелистада по-прежнему сохраняет инфекционную способность после пропускания через фильтр с размером отверстий 0,2 мкм, как обнаружено при проведении иммунопероксидазномонослойного анализа титры до и после фильтрования составляли 105,05 и 105,350. Получена кривая роста фактора Лелистада (фиг. 3). Максимальные титры у свободного от клетки вируса примерно составляют 105,550 мл-1, что имеет место по прошествии 32-48 ч после инокуляции. По прошествии указанного времени макрофаги погибают под воздействием цитопатического эффекта фактора Лелистада. Электронная микроскопия. Были обнаружены кластеры из сферических частиц фактора Лелистада. Частицы характеризовались диаметром 45-55 нм и содержали нуклеокапсид размером 30-35 нм, который был окружен липидной двухслойной мембраной. Частицы фактора Лелистада не обнаруживали в инфицированных культурах, подвергнутых обработке отрицательной сывороткой, или в отрицательных контрольных препаратах. Определяли закономерности поведения изолятов из Нидерландов, Германии и Соединенных Штатов. Все семь изолятов были выделены в свиных альвеолярных макрофагах и подвергнуты пассажу три-пять раз. Все изоляты обуславливали появление цитопатического эффекта в макрофагах и могли быть подвергнуты специфическому иммуноокрашиванию направленными против фактора Лелистада сыворотками от свиньи 822 и сывороткой 23-го и 42-го постинфекционного дня. Эти изоляты были названы как 2, 1, 2, 1,2 и 3. Устанавливали антигенные взаимосвязи у изолятов 1, 2, 1, 2, 1, 2 и 3. Ни одна из полученных сывороток не взаимодействовала в условиях проведения иммунопероксидазномонослойного анализа с неинфицированными макрофагами однако все сыворотки содержали антитела, направленные против одного или нескольких из семи изолятов (табл. 7). Ни одна из экспериментальных сывороток не взаимодействовала в условиях проведения иммунопероксидазномонослойного анализа с неинфицированными макрофагами и ни одна из экспериментальных сывороток, отвечающих нулевому постинфекционному дню, не взаимодействовала с каким-либо из семи изолятов при проведении иммунопероксидазномонослойного анализа (табл. 8). Все семь изолятов фактора Лелистада взаимодействовали со всеми или большинством сывороток, взятых из совокупности экспериментальных сывороток от свиней 21, 23, 25 и 29, которые были взяты после нулевого постинфекционного дня. Только изоляты 1, 2 и 3 взаимодействовали со всеми или большинством сывороток из совокупности экспериментальных сывороток, взятых у поросят 2 В, 9, 16 и 16 после нулевого постинфекционного дня. Радиоиммуноосаждение. Семь белков специфических в отношении фактора Лелистада были обнаружены в макрофагах, инфицированных фактором Лелистада, но при этом они не были обнаружены в неинфицированных макрофагах,осажденных сыворотками 42-го постинфекционного дня от свиней 822 и 23. По оценкам белки обладали следующими молекулярными массами 65, 39, 35, 26, 19, 16 и 15 кДа. Только два из этих специфических в отношении фактора Лелистада белка, а именно белки с молекулярной массой 16 и 16 кДа, осаждались также сывороткой 8 26-го постинфекционного дня. Последовательность у генома фактора Лелистада и его организация. Природа генома фактора Лелистада была установлена анализом ДНК и РНК, взятых из инфицированных свиных альвеолярных макрофаг. Специфическая для вируса Лелистада кислота ДНК не обнаружена. Однако была обнаружена специфическая для вируса Лелистада кислота РНК. В 0,8 -ном нейтральном агарозном геле РНК вирус Лелистада мигрирует несколько медленнее, чем препарат РНК вируса свиной холеры размером 12300 оснований ( и др., 1990). Хотя в нейтральных агарозных гелях невозможно определить точный размер, из сделанных расчетов следует, что длина у РНК, специфической для вируса Лелистада, составляет примерно от 14500 до 15500 оснований. Для установления сложного строения специфических для вируса Лелистада кислот РНК, находящихся в инфицированных клетках, и выявления нуклеотидной последовательности у генома вируса Лелистада, гото 20 3469 1 выми кДНК из РНК, взятой из свиных легочных альвеолярных макрофагов, инфектированных вирусом Лелистада, и выбирали и картировали специфические для вируса Лелистада кДНК-клоны, как было описано в разделе Материалы и методы. Специфичность кДНК-клонов подтверждали повторно при проведении гибридизации специфических клонов, локализованных по перекрывающейся кДНК-последовательности, для чего получали пятна по Нордену , несущие РНК инфицированных вирусом Лелистада и неинфицированных макрофаг. Поразительным было то, что некоторые из кДНК-клонов гибридизировали с РНК размером от 14500 до 15500 оснований, обнаруженных лишь в инфицированных макрофагах, тогда как другие гибридизировали с РНК размером от 14500 до 15500 оснований, а также с группой из четырех или пяти кислот РНК с меньшей молекулярной массой (согласно расчетам, их размер составлял от 1 до 4 тысяч оснований). Все последние клоны являлись кластерными на одном конце кДНК-карты и охватывали примерно 4000 оснований у ДНК. Из этих данных следует, что геномная организация вируса Лелистада может оказаться схожей с таковой у коронавирусов ( и др., 1988), вируса Бернеи др., 1990), торовируса и вируса лошадиного артериита (и др., 1990), т. е. помимо геномной РНК там имеются субгеномные кислоты мРНК, образующие сгруппированную совокупность, которая локализуется на 3-конце. Это предположение было подтверждено, когда стали доступными последовательности, отвечающие кДНК-клонам, и могли быть выбраны специфические примеры в качестве пробы, необходимой для полученных пятен. Совокупность собранных гибридизационных данных, полученных с использованием кДНК-клонов и специфических примеров, которые были подвергнуты гибридизации с образованием пятен по Нордену , несущих РНК инфицированных вирусом Лелистада и неинфицированных макрофаг (фиг. 2). Клоны 12 и 20,которые расположены в 5-части и в центре последовательности, соответственно гибридизируют с геномной РНК размером от 14500 до 15500 оснований, обнаруженной только в клетках, инфицированных вирусом Лелистада. Однако клоны 41 и 39 распознают геномную РНК размером от 14500 до 15500 оснований и совокупность из четырех и пяти кислот РНК с более низкой молекулярной массой соответственно. Однако наиболее поучительная и убедительная гибридизационная схема была получена, однако, при использовании праймера 25, который располагается на самом 5 э-конце последовательности, отвечающей вирусу Лелистада(по сравнению с фиг. 1). Праймер 25 гибридизирует с группой из семи кислот РНК с рассчитанной молекулярной массой в пределе от 700 до 3300 оснований (субгеномные кислоты мРНК), а также с геномной РНК. Наиболее вероятным объяснением гибридизационной схемы, отвечающей праймеру 25, является то, что 5 концевые геномные последовательности, длина которых пока еще остается неизвестной, сливаются с основанием кислот мРНК, которые транскрибируются от 3-конца генома. В самом деле, из гибридизационной схемы, полученной с использованием праймера 25 следует, что 5-концевые геномные последовательности функционируют как так называемая лидерная последовательность в субгеномных кислотах мРНК. Такая транскрипционная схема является отличительным признаком коронавирусов ( и др., 1988) и вируса лошадиного артериита (и др., 1990). Единственное заметное расхождение между вирусом Лелистада и вирусом лошадиного артериита, которое может быть установлено по приведенным выше данным, состоит в том, что геномный размер вируса Лелистада примерно на 2500 оснований больше чем вируса лошадиного артериита. Согласованная нуклеотидная последовательность из перекрывающихся кДНК-клонов показана на фиг. 1. Длина последовательности составляет 15088 пар оснований, что согласуется с рассчитанным размером геномной РНК вируса Лелистада. Поскольку кДНК-библиотека для вируса Лелистада была образована в условиях случайного воздействия праймера при обратном транскриптазном взаимодействии с праймерами 6 из тимуса теленка, не были получены какие-либо кДНК-клоны, начинающиеся с полиадениловокислотного участка их 3-конца. С целью клонирования 3-конца вирусного генома была сконструирована вторая кДНК-библиотека, для чего были использованы олигообразныеи праймер 39 183 в обратной транскриптазной реакции. Праймер 39 183 является комплементарным к спиральной РНК минусового направления вируса Лелистада, которая,по-видимому, присутствует в препарате РНК, выделенном из клеток, инфицированных вирусом Лелистада. Эту библиотеку сортировали с использованием специфических в отношении вируса проб (транслированный в необходимой области кДНК-клон 119 и олигонуклеотид 11964), результатом чего явилось выделение пяти дополнительных кДНК-клонов (например, кДНК-клон 151, фиг. 2). При выявлении порядка расположения аминокислотных остатков в этих кДНК-клонах было установлено, что вирус Лелистада содержит 3 полиадениловокислотный хвост. Длина этого полиадениловокислотного хвоста различна у разных кДНКклонов однако максимальная длина составляет двадцать нуклеотидов. Помимо клонов 25 и 155 (фиг. 2) на 5-конце генома были выделены четыре дополнительных кДНК-клона, которые оказались всего лишь на 2-3 нуклеотида короче, чем предельный 5-нуклеотид, показанный на фиг. 1. С учетом этого факта и способа синтеза кДНК было высказано предположение, что получена картина, которая является очень близкой к имеющей место в случае 5-конца последовательности геномной РНК вируса Лелистада. 3469 1 Почти 75 геномной последовательности вируса Лелистада кодирует кадры открытого считывания 1 А и 1 В. Кадр открытого считывания 1 А инициируется, по-видимому, в первом триплете АУГ(, нуклеотидное положение 212, фиг. 1), встречающемся в последовательности вируса Лелистада. У кадра открытого считывания 1 А С-конец перекрывает предполагаемый -конец кадра открытого считывания 1 В, что происходит на небольшом участке в 16 нуклеотидов. Тем самым представляется, что трансляция кадра открытого считывания 1 В осуществляется через рибосомальное смещение кадра, что является характерным признаком способа трансляции полимеразного или репликазного гена у коронавирусов ( и др., 1987 и др., 1990) и торовирусов Берне (,) ( и др,1990 а). Характерная РНК-псевдоузельная структура, которая, как считают, должна образовываться в месте рибосомального сдвига кадра, также обнаруживается в этом местоположении у последовательности вируса Лелистада (результаты не показаны). Кадр открытого считывания 1 В кодирует аминокислотную последовательность, состоящую почти из 1400 остатков, которая много меньше, чем у кадров открытого считывания 1 В коронавирусов, таких как вирус инфекционного гепатитаи вирус инфекционного бронхита(примерно 3700 аминокислотных остатков ( и др., 1990 и др., 1987) и вирус Берне(примерно 2300 аминокислотных остаткови др., 1990 а). Характерные особенности проявления кадра открытого считывания 1 В у членов суперсемейства коронавирусов, такие как репликазный лейтмотив и наличие цинкфингерной области, могут быть также найдены у кадра открытого считывания 1 В вируса Лелистада (результаты не показаны). Тогда как кадры открытого считывания 1 А и 1 В кодируют вирусную полимеразу и, следовательно, как считается, кодируют неструктурированный вирусный белок, кадры открытого считывания 2 до 7 кодируют, как полагают, структурированные вирусные белки. Продукты от наличия кадров открытого считывания 2 до 6 обнаруживают специфические особенности, напоминающие связанные с мембраной (оболочкой) белки. Кадр открытого считывания 2 кодирует белок из 249 аминокислот, содержащий два предсказанных -связанных сайта гликозилирования(табл. 9). На -конце идентифицируется гидрофобная последовательность, которая может функционировать как так называемая сигнальная последовательность. Конец С также завершается гидрофобной последовательностью, которая в этом случае может функционировать как трансмембранная область, которая захватывает результат появления кадра открытого считывания 2 со встраиванием в вирусную оболочечную мембрану. Кадр открытого считывания 3 может инициироваться на стартовом триплете АУГв нуклеотидном положении 12394 или на стартовом триплете АУГв нуклеотидном положении 12556 и затем кодировать белки, соответственно содержащие 265 и 211 аминокислот. Белок из 256 остатков содержит семь предполагаемых -связанных сайтов гликозилирования, тогда как белок из 211 остатков содержит четыре сайта (табл. 9). На -конце белка, состоящего из 256 остатков, идентифицируется гидрофобная последовательность. Судя по результатам проведения анализа на гидрофобность, топология белка, закодированного кадром открытого считывания 4, является аналогичной таковой у белка, закодированного кадром открытого считывания 2, если считать, что проявление кадра открытого считывания 4 инициируется на стартовом триплете АУГв нуклеотидном положении 12936. Однако кадр открытого считывания 4 может также инициироваться в двух иных АУГ-кодонах (фиг. 1 и 2) со стартовыми положениями в последовательности, приходящимися соответственно на нуклеотиды 12981 и 13068. Пока еще остается неясным, какой используется стартовый кодон. В зависимости от используемого стартового кодона кадр открытого считывания 4 может кодировать белки из 183 аминокислот, содержащих четыре предполагаемых связных сайта гликозилирования, или из 139 аминокислот, содержащих три предполагаемых -связных сайтов гликозилирования (табл. 9). Считают, что кадр открытого считывания 5 кодирует белок из 201 аминокислоты, содержащей два предполагаемых -связанных сайта гликозилирования (табл. 9). Характерной особенностью проявления кадра открытого считывания 5 является наличие внутренней гидрофобной последовательности между аминокислотой 108 и 132. Из анализа мембранных соединительных сегментов и гидрофильности продукта проявления кадра открытого считывания 6 следует, что он содержит три мембранных соединительных сегмента на -концевом участке своей последовательности, состоящей из 90 аминокислот. Эта отличительная особенность является также характеристикой небольшого оболочечного гликопротеида М или Е 1 у нескольких коронавирусов, например у вируса инфекционного бронхита (и др., 1984) и у вируса мышиного гепатита (и др., 1986). Можно, следовательно, считать, что белок, закодированный кадром открытого считывания 6, обладает мембранной топологией, аналогичной такой у белка М или Е 1 коронавирусов ( и др., 1986). Второй характерной особенностью белка М или Е 1 является наличие так называемой поверхностной спирали, которая располагается в непосредственной близости от предполагаемой третьей трансмембранной области. Эта последовательность, состоящая из 25 аминокислот, которая 22 3469 1 является вполне консервативной у коронавирусов, также распознается, хотя и в значительно более вырожденном состоянии, у вируса Лелистада. Все же предполагается, что продукт проявления кадра открытого считывания 6 у вируса Лелистада обладает аналогичной связанной с мембраной функцией, как это наблюдается в случае белка М или Е 1 коронавирусов. Кроме того, белок, закодированный кадром открытого считывания 6, обнаруживает сильную схожесть (53 идентичных аминокислот) с образованием( и др., 1990) вируса элевации лактатдегидрогеназы. Белок, закодированный кадром открытого считывания 7, обладает длиной в 128 аминокислотных остатков (табл. 9), которая на 12 аминокислот превышает длину последовательности 1 у вируса элевации лактатдегидрогеназы ( и др., 1990). Все же наблюдается значительная схожесть (43 идентичных аминокислот) между белком, закодированным кадром открытого считывания 7, и 1. Еще одна общая характерная особенность продукта проявления кадра открытого считывания 7 и 1 сводится к наличию высокой концентрации основных остатков (аргинин, лизин и гистидин (, , ) на -концевой половине белка. До аминокислоты 55 последовательность у вируса Лелистада содержит 26 аргинина, лизина и гистидина. Этот результат находится в полном согласии с предполагаемой функцией продукта проявления кадра открытого считывания 7 и 1 и др., 1990), а именно с инкапсидацией вирусной геномной РНК. На основании изложенных выше данных делается предположение, что продукт проявления кадра открытого считывания 7 у вируса Лелистада представляет собой нуклеокапсидный белоквируса. Схематическое представление организации генома у вируса Лелистада показано на фиг. 2. Карта из перекрывающихся клонов, предназначенная для определения последовательности у вируса Лелистада, показана в верхней группе. Линейное изображение этой карты с указанием концов 5 и 3 у нуклеотидной последовательности вируса Лелистада показано на фиг. 1 масштаб в тысячах оснований приводится под картой из кДНК-клонов, чем обеспечивается возможность последовательного расположения этих клонов в виде последовательности. Положение кадров открытого считывания, идентифицированных у генома вируса Лелистада,указывается ниже под линейной картой последовательности вируса Лелистада. Нижняя группа изображает сведенную воедино совокупность субгеномных кислот мРНК и положение этих кислот РНК по отношению к последовательности у вируса Лелистада. В согласии с представлениями о трансляционной стратегии у субгеномных кислот мРНК коронавирусов,торовирусов и артеривирусов делается предположение, что кадры открытого считыванияот 1 до 6 транслируются с единого 5-конца их геномных кислот или кислот мРНК. Считается, что эта специфическая часть кислот мРНК представляет собой ту часть РНК, которая получается при вычитании РНК меньшей молекулярной массы из РНК с большей молекулярной массой, последовательно идущей за ней. Хотя РНК 7 и образует 3-конец у всех других геномных и субгеномных кислот РНК и тем самым не характеризуется наличием некой уникальной области, полагают, что кадр открытого считывания 7 транслируется лишь с этой самой маленькой по размеру мРНК. Лидерная последовательность, расположенная на 5-конце у субгеномных кислот РНК, указывается заштрихованным прямоугольником. Длина этой последовательности составляет примерно 200 оснований однако точное место слияния с основанием геномных кислот РНК предстоит еще определить. Экспериментальная репродукция таинственной болезни свиней. Восемь беременных свиноматок были инокулированы фактором Лелистада и у этих свиноматок воспроизводили клинические признаки таинственной болезни свиней, такие как отсутствие аппетита и репродуктивные потери. По прошествии от четырех до 10-12 дней после инокуляции все свиноматки стали обнаруживать отвращение к еде. Ни у одной из свиноматок не наблюдалось повышение температуры. У двух свиноматок посинели уши, что обнаружилось на 9-й и 10-й постинфекционные дни. В табл. 6 приведены данные о дне рождения и числе живых и мертвых поросят, приходящихся на свиноматку. Фактор Лелистада выделили у 13 новорожденных поросят. Таблица 1 Описание и результаты, полученные при выделении вируса из реальных образцов А. Образцы, взятые у поросят, подозреваемых в заражении таинственной болезнью свиней Ферма 3469 1 В. Образцы, взятые у свиноматок, подозреваемых в заражении таинственной болезнью свиней Ферма ТН Использованный материал плазма и лейкоциты плазма и лейкоциты плазма и лейкоциты плазма и лейкоциты плазма и лейкоциты сыворотка крови и лейкоциты сыворотка крови плазма и лейкоциты плазма и лейкоциты плазма и лейкоциты сыворотка крови Результаты приведены в виде числа свиней, у которых выделяла вирус. Иногда изолят обнаруживали не в одном, а в нескольких образцах, приходившихся на одну свинью.- фактор Лелистада 2 - энтеровирус типа 2, обнаруженный у свиней- вирус энцефаломиокардита. Таблица 2 Описание и результаты, полученные при выделении вируса из образцов, взятых у свиней, подвергнутых преднамеренному экспериментальному заражению Свиноматка(0) Использованный материал легкие, миндалины мазок из носа мазок из носа легкие, миндалины мазок из носа мазок из носа легкие, миндалины мазок из носа мазок из носа, плазма и лейкоциты легкие, миндалины мазки из носа мазки из носа мазок из носа мазок из носа мазок из носа, плазма и лейкоциты мазок из носа мазок из носа мазок из носа мазок из носа мазок из носа от контактных свиней) Поросята без специфического патогенного микроорганизма, (с) - в контакте со свиноматкой, подозреваемой в заражении таинственной болезнью свиней, либо- на нулевой день эксперимента вводили внутримышечно 10 мл этилендиаминтетрауксуснокислой крови от такой свиноматки (с) - группы, состоящие из одной свиноматки и трех поросят без этого специфического патогенного микроорганизма содержали в одном загоне, а все четыре такие группы помещали в одном хлеву. На шестой день одного поросенка без специфического патогенного микроорганизма из каждой группы забивали, а миндалины и легкие использовали 24 3469 1 для выделения вируса. Четыре группы поросят без специфического патогенного микроорганизма, инокулированных кровью , помещали в четыре других загона, находящихся в отдельном хлеву. У поросят без специфического патогенного микроорганизма на второй, пятый, седьмой и девятый дни от начала эксперимента брали мазки из полости носа, а в случае обнаружения лихорадки брали этилендиаминтетрауксуснокислотную кровь, предназначенную для выделения вируса из плазмы и лейкоцитов.) Результаты приводятся в виде числа изолятов, приходящихся на каждого поросенка.- фактор Лелистада.7 - свиной энтеровирус типа 7.В скобках приведены начальные буквы названия фермы, откуда происходила свиноматка. Таблица 3 Идентификация вирусных изолятов Происхождение и культура клеток Плавучая 1 плот- Размер частиц 2 по ность вданным флюоресцентной микроскопии (нм)-15,2,6 Оральные мазки свине определяли ноферма 6 Мазок из носа, миндалины свиньи без патоне определяли гена 15,2,6 Различные образцы различные фермы ле 1,19 г/мл гочные маркофаги свиньи Плавучую плотность, которую находили в предварительно образованных линейных градиентах хлорида цезия в фосфатно-солевом буферном растворе, определяли согласно стандартным методикам (, 1967). Приведенная величина отвечает плотности, при которой степень заражения происходит через максимум. 2) Инфицированные и неинфицированные клеточные культуры подвергали замораживанию и оттаиванию. Клеточные лизаты центрифугировали в течение 30 мин при 130000 об.х уд.массу, результирующий твердый остаток от центрифугирования отрицательно окрашивали, что делали согласно стандартным методикам( и Ное, 1959), и подвергали исследованию на электронном микроскопе Филипс СМ 10. Приведенная величина отвечает размеру частиц, которые присутствовали в инфицированных и отсутствовали в неинфицированных культурах. 3) Чувствительность к хлороформу определяли согласно стандартным методикам (,и , 1974). 4) Изоляты дозами от 100 до 300 50 смешивали, меняя величину разбавления со специфическими антисыворотками, и выращивали в надлежащей клеточной системе до момента появления полного цитопатического эффекта. Сыворотки с титрами выше пяти подвергали повторному тестированию, а сыворотки, которые характеризовались высокими титрами по цитопатическому эффекту, считали специфическими в отношении изолята. Изоляты, не обладавшие чувствительностью к хлороформу, тестировали с использованием сывороток, направленных против свиных энтеровирусов , от 1 до 11, против вируса энцефаломиокардитапротив свиного парвовируса и против свиной везикулярной болезни. Изолят (код -2.91), чувствительный к хлороформу, тестировали с использованием антисывороток, специфически направленных против вируса псевдобешенства, вируса 1 бычьего герпеса, вируса 4 бычьего герпеса, злокачественного катарального вируса, вируса бычьей вирусной диареи, вируса свиной холеры, вируса свиного гриппа 11 и 32, вируса парагриппа 3, бычьего респираторного синцитиального вируса, вируса передаваемого гастроэнтерита, вируса свиной эпидемической диареи, вируса магглютинирующего энцефалита, вируса инфекционного бронхита, вируса бычьего лейкоза, вируса птичьего лейкоза, вируса заболевания маедни-висна, и с использованием экспериментальных сывороток, полученных от свиней без специфического патогенного микроорганизма (см. табл. 5). 25 3469 1 Результаты, полученные при проведении серологии на парных реальных сыворотках, полученных у свиноматок, подозреваемых в заражении таинственной болезнью свиней. Сыворотки брали в острый период заболевания и 3-9 недель спустя. Приведенная величина представляет собой число свиноматок, которые обнаруживали четырехкратное или более высокое повышение титра в знаменателе указано число тестированных свиноматок. Таблица 4 Ферма 3 Всего с отрицательным результатом Всего с положительным результатом Всего сероконвертированных случаев Всего тестировано Сыворотки тестировали проведением тестов по гемагглютинирующему ингибированию с целью обнаружения антитела, направленного против вируса гемагглютинирующего энцефалитаи вирусов свиного гриппа 11 и 32, проведением иммуносорбентного анализа с ферментной меткойс целью обнаружения антитела, направленного против гликопротеидавируса псевдобешенства , против парвовируса свиней , против вируса бычьей вирусной диареии против вируса холеры свиней 3 Всего с отрицательным результатом Всего с положительным результатомр Всего сероконвертированных случаев Всего тестировано Ферма Сыворотки тестировали проведением тестов по нейтрализации сыворотки , проводимых с целью обнаружения антитела, направленного против вируса энцефаломиокардита , выделенноговируса энцефаломиокардита , свиных энтеровирусов 2 и 7 и- изолятов , и против фактора Лелистадаи тестировали проведением иммунопероксидазномонослойного анализа (РМА), проводимого с целью обнаружения антитела, направленного против фактора Лелистада .) Время между отбором первой и второй сыворотки.) Общее число свиней, у которых первая сыворотка дала отрицательный результат в тесте при проведении исследования и из которых вторая сыворотка также дала отрицательный результат или обнаружила менее чем четырехкратное повышение титра. р) Общее число свиней, у которых первая сыворотка дала положительный результат и из которых вторая сыворотка обнаружила менее чем четырехкратное повышение титра.) Общее число свиней, у которых вторая сыворотка дала четырехкратное или более высокое повышение титра чем первая сыворотка.- не проводили. 3469 1 Таблица 5 Эволюция антитела, направленного против фактора Лелистада, как это следует из результатов проведения иммунопероксидазномонослойного анализа А. Контактные свиньи Недели Титры сыворотки в РМА анализе после контакта Свиньи 0 2 3 4 5 С 836 0 10 640 640 640 С 837 0 10 640 640 640 С 821 0 640 640 640 640 С 823 0 160 2560 640 640 С 829 0 160 640 10240 10240 С 832 0 160 640 640 2560 С 813 0 640 2560 2560 2560 С 815 0 160 640 640 640 В. Свиньи, инокулированные кровью Недели после инокуляции Свиньи 809817818820822826 В 830 В 834 По вопросу описаний эксперимента см. табл. 2. У всех свиней кровь брали через определенные интервалы времени и все сыворотки тестировали проведением иммунопероксидазномонослойного анализа (РМА) для обнаружения антитела, направленного против фактора Лелистада . Таблица 6 Экспериментальная репродукция таинственной болезни свиней Продолжи- Число поросят при рождении тельность беживых мертвых ременности Число мертвых Первая неделя Фактор Лелистада у поросят 1 родившихся умерших за мертвыми первую неделю 2 4 4 3 Фактор Лелистада выделяли из лекого, печени, селезенки, почки или асцитических жидкостей. Антитела, направленные против фактора Лелистада, обнаруживали в сывороточных образцах, взятых до того, как поросята начинали сосать свиноматку, или обнаруживали в асцитических жидкостях поросят, родившихся мертвыми. 2 3469 1 Таблица 7 Реакционная способность в условиях проведения иммунопероксидазномонослойного анализа реальных сывороток, взятых из коллекции, собранной в Европе и Северной Америке тестированию подвергали изоляты с факторами Лелистада, полученными из Нидерландов (1 и 2), Германии (1 и 2) и Соединенных Штатов (1, 2 и 3) Изоляты Сыворотки из Нидерландов ТН-187- титр выражен в виде отрицательного десятичного логарифма знак-обозначает отрицательный результат. 3469 1 Таблица 8 Реакционная способность в условиях проведения иммунопероксидазномонослойного анализа экспериментальных сывороток, направленных против фактора Лелистадаи , которые были подвергнуты тестированию изолятами с фактором Лелистада, полученными из Нидерландов (1 и 2), Германии (Е 1 и 2) и Соединенных Штатов (1, 2 и 3) Изоляты Сыворотки анти 21- титр выражен в виде отрицательного десятичного логарифма знак- обозначает отрицательный результат. Таблица 9 Характеристики кадров открытого считывания у вируса Лелистада Кадр открытого считывания 1 1 2 3 4 5 6 7 Рассчитанный размер Число амино- немодифицированного Число сайтов глюкокислот пептида, кДа зилирования 2396 260,0 3 1463 161,8 3 249 28,4 2 265 30,6 7 211 24,5 4 183 20,0 4 168 18,4 4 139 15,4 3 201 22,4 2 173 18,9 2 128 13,8 1
МПК / Метки
МПК: C12N 7/00
Метки: фактора, лелистада, композиции, основе
Код ссылки
<a href="https://by.patents.su/30-3469-kompozicii-na-osnove-faktora-lelistada.html" rel="bookmark" title="База патентов Беларуси">Композиции на основе фактора Лелистада</a>
Следующий патент: Способ получения активного комплекса биологического назначения
Случайный патент: Сдвоенное колесо транспортного средства повышенной проходимости