Способ получения генетически модифицированного бакуловируса, штамм вируса ядерного полиэдроза, способ борьбы с насекомыми, инсектицидная композиция
Текст
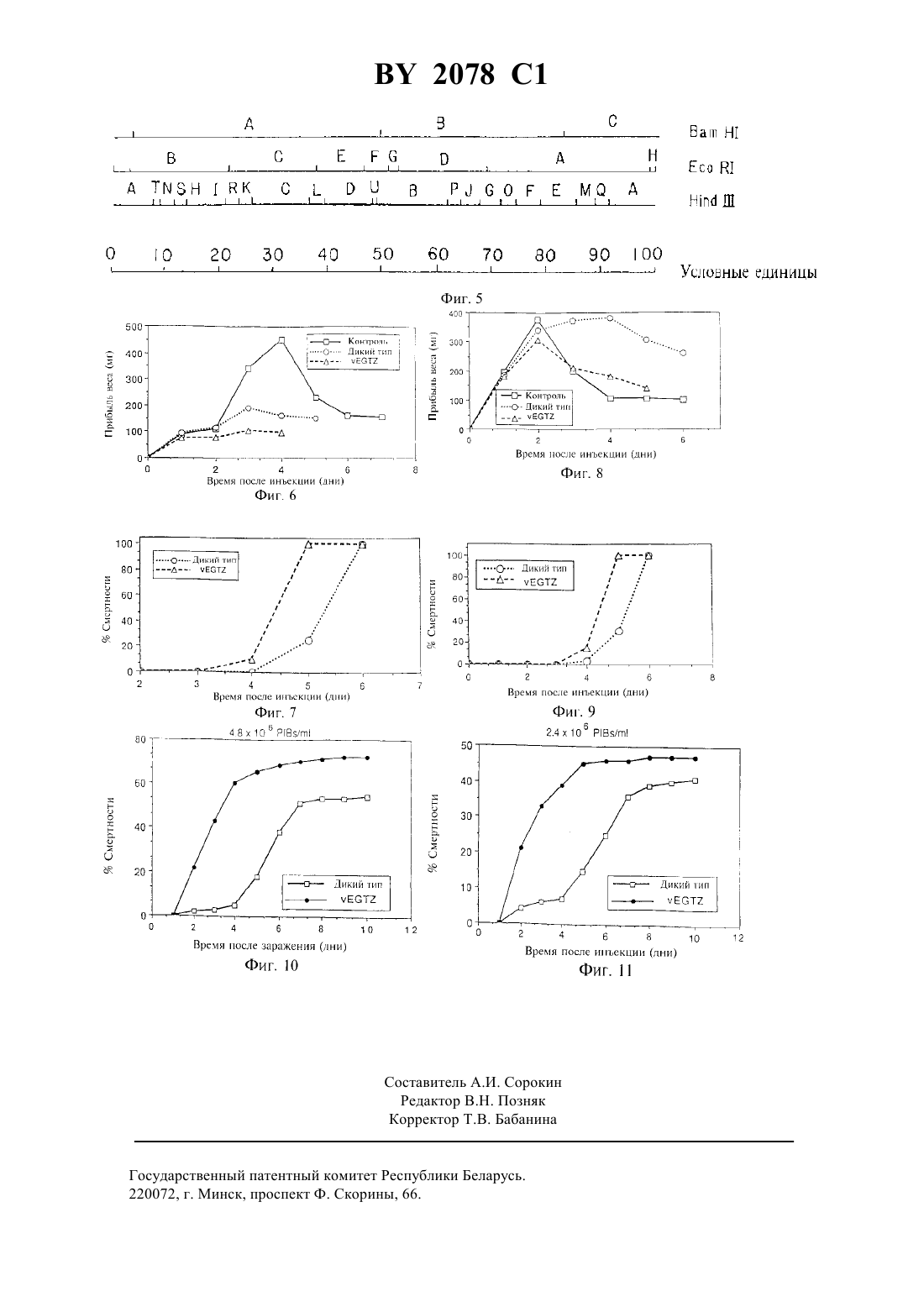
12 15/00 ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННОГО БАКУЛОВИРУСА, ШТАММ ВИРУСА ЯДЕРНОГО ПОЛИЭДРОЗА,СПОСОБ БОРЬБЫ С НАСЕКОМЫМИ, ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ(71) Заявитель ЮНИВЕРСИТИ ОФ ДЖОРДЖИА РИСЕРЧ ФАУНДЕЙШН, ИНК(73) Патентообладатель ЮНИВЕРСИТИ ОФ ДЖОРДЖИА РИСЕРЧ ФАУНДЕЙШН, ИНК(57) 1. Способ получения генетически модифицированного бакуловируса, отличающийся тем, что проводят инакти 2078 1 вацию гена вируса, кодирующего фермент экдистероид -глюкозилтрансферазу. 2. Способ по п.1, отличающийся тем, что указанный бакуловирус является вирусом ядерного полиэдроза. 3. Способ по п.2, отличающийся тем, что вирусом ядерного полиэдроза является вирус ядерного полиэдроза(Ас ). 4. Способ по п.1, отличающийся тем, что в геном вируса дополнительно встраивают гетерологический ген, определяющий синтез белка, влияющего на метаморфоз насекомых. 5. Штамм вируса ядерного полиэдрозаАТСС 2244, обладающий инсектицидной активностью. 6. Способ борьбы с насекомыми, предусматривающий нанесение вируса на растение, отличающийся тем, что используют генетически модифицированный бакуловирус, ген которого кодирующий фермент экдистероид -глюкозилтрансферазу, инактивирован. 7. Способ по п.6, отличающийся тем, что в качестве бакуловируса используют вирус ядерного полиэдроза. 8. Способ по п.7, отличающийся тем, что в качестве вируса ядерного полиэдроза используют штамм вируса ядерного полиэдрозаАТСС 2244. 9. Инсектицидная композиция, содержащая активное начало - вирус и агрономически приемлемый носитель, отличающаяся тем, что в качестве активного начала она содержит генетически модифицированный бакуловирус с инактивированным геном, кодирующим фермент экдистероид -глюкозилтрансферазу, в эффективном количестве. 10. Инсектицидная композиция по п.9, отличающаяся тем, что в качестве бакуловируса она содержит вирус ядерного полиэдроза. 11. Инсектицидная композиция по п.10, отличающаяся тем, что в качестве вируса ядерного полиэдроза она содержит штамм вируса ядерного полиэдрозаАТСС 2244.(56) 1. Биологические средства защиты растений.-М. Колос, 1974.-.335-345. 2. ЕР заявка 0225777, С 1215/00, 1987 г. Предлагаемое изобретение относится к способам и композициям для улучшенного биологического контроля над насекомыми-вредителями. Более конкретно, данное изобретение относится к использованию палочковидного вируса с измененным геном, продукт которого эффективен в отношении регулирования роста и развития насекомых. Данное изобретение относится также собственно к генетически видоизмененным палочковидным вирусам и способам их получения. Интерес к биологическому способу борьбы с насекомыми-вредителями обусловлен недостатками традиционных химических пестицидов. Химические пестициды, как правило, воздействуют как на вредные, так и на полезные виды. Имеется тенденция, что насекомые-вредители приобретают устойчивость к подобным химикалиям, так что быстро может развиться популяция устойчивых к таким пестицидам насекомых. Далее, остатки химических веществ наносят урон окружающей среде и, потенциально, здоровью людей. Биологический контроль представляет собой альтернативный способ воздействия на насекомых, который позволяет уменьшить зависимость от химических пестицидов. Основная стратегия биологического контроля включает использование встречающихся в природе организмов, патогенных по отношению к насекомым (энтомопатогены), и разведение более устойчивых по отношению к насекомым-вредителям культур. Подход к решению этих задач включает идентификацию и характеристику генов насекомых или продуктов генов, которые могут служить подходящей основой для получения агентов контроля, идентификацию и эксплуатацию ранее не использовавшихся микроорганизмов(сюда относится также модифицирование существующих в природе непатогенных микроорганизмов с целью превращения их в патогенные по отношению к насекомым) , модифицирование и улучшение используемых в настоящее время энтомопатогенов, а также создание методами генной инженерии культур, обладающих большей устойчивостью к насекомым-вредителям. К энтомопатогенам, предложенным в качестве биологических пестицидов, относятся вирусы, вызывающие естественные эпизоотии в популяциях насекомых ( ,, 1968, . 51-62) 1 в том числе бакуловирусы. Палочковидные вирусы (бакуловирусы) представляют большую группу вирусов, инфицирующих только членистоногих насекомых ( (1981), в, . , (.).,, . 203-224(1980)52107-110(1979) в. . 25,., (.). , . 273-355). Многие 2 2078 1 бакуловирусы инфицируют насекомых, являющихся вредителями промышленно важных сельскохозяйственных и лесных культур. Такие бакуловирусы потенциально представляют собой ценные агенты биологического контроля. Агентством США по охране окружающей среды рекомендовано к использованию в качестве инсектицидов четыре палочковидных вируса. Одним из преимуществ бакуловирусов как биологических пестицидов является их специфичность по отношению к насекомому-хозяину. Бакуловирусы как группа инфицируют только членистоногих, а каждый индивидуальный штамм палочковидного вируса обычно инфицирует только один или несколько видов насекомых. Таким образом, они не представляют угрозы ни для окружающей среды, ни для человека и могут быть использованы без вреда для полезных видов насекомых. Группа бакуловирусов включает подгруппы вирусов ядерного полиэдроза (ЯПВ), вирусов ядерного гранулеза (ГВ) и палочковидных вирусов, не образующих тела включения. У окклюдирующих форм палочковидных вирусов вирионы (заключенные в оболочку нуклеокапсиды) помещаются внутри кристаллической белковой матрицы. Такая структура, так называемое тело включения или тело вкрапления, - это форма нахождения вируса в природе вне организма, которая обуславливает передачу инфекции от организма к организму. Отличительной чертой вирусов ЯП является то, что в каждом теле включения содержатся много вирионов. Тела включения ЯП вирусов обладают относительно большими размерами (до 5 микрометров). Тела включения ГВ мельче и содержат по одному вириону. У обеих форм кристаллическая белковая матрица тел включения состоит главным образом из одного полипептида от 25000 до 33000 дальтон, называемого полиэдрином или соответственно гранулином. Палочковидные вирусы неокклюдирующих форм не производят белок полиэдрин или гранулин и не образуют тел включения. В природе инфекция инициируется, когда насекомое глотает загрязненную частицами палочковидных вирусов пищу, как правило, в виде тел включения. В щелочной среде среднего кишечника насекомого тела включения диссоциируют, высвобождая обособленные вирусные частицы, которые затем проникают в выстилающие стенки кишечника эпителиальные клетки. Внутри клетки-хозяина палочковидный вирус мигрирует к ядру, где производит процесс репликации. Первоначально в инфицированной клетке синтезируются некоторые специфичные вирусные белки путем транскрипции и трансляции так называемых ранних генов. Эти белки необходимы, кроме других функций, для репликации вирусной ДНК, которая начинается 4-6 часов спустя после проникновения вируса в клетку. Интенсивная репликация вирусной ДНК продолжается примерно в течение 12 часов после заражения ( --). Примерно через 8-10 часовинфицированная клетка производит большие количества так называемых поздних продуктов вирусных генов. К ним относятся компоненты нуклеокапсида, окружающего вирусную ДНК в процессе образования дочерних вирусных частиц. Дочерние вирусные частицы начинают образовываться примерно через 12 часов . Первоначально дочерние вирусы мигрируют к клеточной мембране, где, после выхода на поверхность клетки,они приобретают оболочку. Подобный неокклюдированный вирус может затем инфицировать другие клетки насекомого-хозяина. Синтез полиэдрина начинается через 12-18 часов после заражения и к 24 часамон быстро нарастает до очень высокого уровня. В это время наблюдается снижение количества вышедших из клетки вирусных частиц, и затем дочерний вирус образует тела включения. Образование тел включения продолжается до гибели или распада клетки. Некоторые палочковидные вирусы инфицируют все ткани насекомого-хозяина, так что по завершении процесса развития инфекции все насекомое превращается в жидкость,при этом выделяется большое количество тел включения, которые далее распространяют инфекцию на другие особи. (Обзор приводится в е, .,,,, , 1986). Одним из существенных недостатков применения палочковидных вирусов в качестве пестицидов является продолжительный период времени между моментом, когда насекомое заглатывает вирус, и его смертью. В течение этого времени вредитель продолжает питаться и вредит урожаю. В связи с этим определяющим представляется уменьшение времени питания насекомого до минимума, т.е. создание пестицида, снижающего питание насекомого до наступления гибели. Желательно также, чтобы смерть насекомого наступала быстрее. Такие результаты могут быть получены путем воздействия на вирусный геном, осуществить которое в частности позволяют методы генной инженерии 2. Данное изобретение выявляет ген палочковидного вируса и продукт этого гена, влияющий на рост, развитие или поведение насекомых. Оно обеспечивает способы использования этого гена и продукта этого гена, а также способы инактивации этого гена или продукта этого гена в целях контроля над насекомыми. В предпочтительном варианте воплощения используют ген, который кодирует экдистероидглюкозилтрансферазу (Е) вируса . Экспрессия генапалочковидных вирусов вызывает образование Е, которая инактивирует гормоны, обслуживающие линьку насекомых, предотвращая этим линьку или окукливание личинки. Инактивирование генапалочковидных вирусов обеспечивает нормальное протекание линьки и окукливания личинки. 3 2078 1 Предлагаемое изобретение включает целый ряд агентов контроля над насекомыми с использованием генови продуктов функционирования этих генов. Эти агенты контроля либо вызывают у насекомого-вредителя несоответствующий синтез белка Е, либо подавляют нормальное функционирование или проявление белка Е, так что нормальное развитие насекомого нарушается. Предпочтительно, чтобы организм, содержащий ген , представлял собой специфичный для данного насекомого вирус, и чтобы генвируса был инактивирован, что обеспечило бы увеличение продолжительности развития инфицированного этим вирусом насекомого-хозяина. Длительное развитие насекомого-хозяина связано с изменением его поведения, в частности с понижением питания, и следующим за этим снижением роста насекомого и более быстрым наступлением смерти. Данное изобретение включает также способ производства улучшенного вирусного пестицида. Кроме того, оно включает способ контроля над насекомыми-вредителями, который заключается в том, что насекомое-вредитель подвергается воздействию улучшенного вирусного пестицида. Предлагаемые данным изобретением генетически измененные вирусы являются более эффективными пестицидами по сравнению с использовавшимися до сих пор вирусами. У палочковидных вирусов, таких,например, как вирус ядерного полиэдрозаили вирус ядерного полиэдроза, естественно проявляется ген . Экспрессия его увеличивает период времени, в продолжение которого инфицированная личинка питается, не страдая от вирусной инфекции. Данное изобретение включает инактивирование генав геноме вируса. Генможно инактивировать введением на его место или внутрь него другого гена, например, гена-маркера, кодирующего синтез -галактозидазы. Должно быть ясно, что для нарушения генаможет использоваться любая последовательность ДНК, поскольку она нарушает проявление кодирующей последовательности . Можно, напротив, удалить из генома все части генас помощью делеции соответствующего кодирующего сегмента ДНК или удалить либо изменить регуляторные элементы генома, контролирующие экспрессию гена . Палочковидные вирусы с делециями, инактивирующими ген , могут быть также получены последовательным пропусканием вируса через культуру клеток насекомого. Полученные при этом вирусы с делециями имеют следующее преимущество они не содержат чужеродной ДНК и отличаются от вирусов дикого типа только отсутствием функционального гена . Подобные модифицированные бакуловирусы эффективнее в качестве агентов контроля над вредителями, чем те, которые применяются в настоящее время. Как простые делеционные мутанты делеции так и пестициды, полученные путем генной инженерии, они должны быть приемлемы для регулирующих ведомств (например, РА), поскольку в них не содержится негомологичная ДНК. Палочковидные вирусы, в которых не проявляется функциональный ген , дополнительно могут быть видоизменены за счет введения отличных отгенов, которые могут воздействовать на развитие насекомого,повышая этим эффективность таких вирусов как агентов контроля насекомых. Данное изобретение включает также способ контролирования развития насекомых-вредителей путем инфицирования личинок насекомых мутантным вирусом, в котором интактный генотсутствует или не способен производить функциональный продукт . Личинки, инфицированные мутантным вирусом, стремятся линять и окукливаться, и, следовательно, период их питания сокращается по сравнению с личинками, инфицированными диким типом или другими известными в настоящее время вирусами. Зараженные мутантным вирусом личинки также умирают быстрее, чем инфицированные диким типом или другими применяемыми в настоящее время вирусами. Задачей данного изобретения является создание рекомбинантного вируса, который является более эффективным по сравнению с вирусами дикого типа и другими формами, применяемыми в настоящее время. Примером данного изобретения является рекомбинантный вирус , обозначаемый как , в котором часть геназаменена на-бактериальный ген, кодирующий образование -галактозидазы. Как понятно специалистам в данной области, может быть заменена любая последовательность ДНК, инактивирующая ген . Примером реализации данного изобретения является также рекомбинантный палочковидный вирус, обозначаемый , в котором часть генаудалена. Примером осуществления данного изобретения является пестицид на основе палочковидного вируса с удаленным геном . Сюда относятся также палочковидные вирусы, у которых к инактивации генапривели мутации, произошедшие естественным путем. Другой задачей данного изобретения является создание с помощью генной инженерии вируса, который не только представляет собой эффективный пестицид, но одновременно и безвреден для окружающей среды. Еще один предмет изобретения - рекомбинантный вирусный пестицид, в котором отсутствует функциональный гени проявляется второй ген, влияющий на развитие насекомых, причем в естественном виде этот второй ген не присутствует в организме. Указанный второй ген кодирует синтез влияющего на метаморфоз продукта. Таким продуктом гена может быть гормон насекомых, влияющий на развитие насекомого,или фермент, который инактивирует регулирующий метаморфоз гормон. Особые примеры включают прото 4 2078 1 ракотропный гормон, гормон вылупления и эстеразу ювенильного гормона. Если требуется с целью получения агента контроля ввести в вирус насекомых кодирующие эти белки гены, то этот вирус либо не должен содержать гена , либо генв нем должен быть инактивирован. Далее задачей данного изобретения является создание инсектицидных композиций, пригодных для использования в сельском хозяйстве. В состав таких композиций входят, как известно, приемлемый в сельскохозяйственном смысле носитель и вирус насекомых, например, палочковидный вирус, предварительно модифицированный генетически таким образом, что генуказанного вируса инактивирован. Такие -бакуловирусы могут далее быть подвергнуты генетическим изменениям, вызывающим экспрессию гетерологичного гена, который кодирует гормон насекомых, влияющий на метаморфоз, или фермент, инактивирующий такой оказывающий влияние на метаморфоз гормон насекомых. К гетерологичным генам, продукты которых влияют на метаморфоз, относятся, но не исчерпывают их, проторакотропный гормон, гормон вылупления и эстераза ювенильного гормона. В предпочтительном исполнении инсектицидные композиции, включающие генетически измененные палочковидные вирусы, предназначены для распыления. Любая из вышеупомянутых инсектицидных композиций может также включать ингредиенты, стимулирующие питание насекомых. Инсектицидные композиции по данному изобретению насекомое-вредитель может глотать при нанесении его на растения, и насекомые-вредители, чувствительные к активному агенту данной композиции, будут демонстрировать пониженное питание и погибнут. Также задачей данного изобретения является обеспечение модифицированного биологического пестицида, который ингибирует проявление генаили функционирование продукта этого гена. Фиг.1 схематически представляет геномс указанием локализации гена . Геном Ас представлен в единицах карты и в виде карты рестрикциии. На фиг.2 схематически представлены результаты исследования последовательности генаи анализа этой последовательности. На фиг.2 А изображена рестрикционная карта данной области генома. На фиг.2 В показаны результаты компьютерного анализа последовательности на наличие открытых рамок считывания. Вертикальными линиями показаны терминирующие кодоны, являющиеся сигналами остановки синтеза полипептидной цепи. Последовательность транслируется во всех трех потенциальных открытых рамках считывания в каждой нити ДНК (1, 2, 3, 1, 2, 3). Соответствующаяоткрытая рамка считывания (2) обозначена как . Фиг.3 представляет схематически структуры областей генавируса(А) и рекомбинантных вирусов(В) и(С). Заштрихованный прямоугольник представляет собой ген. На фиг.4 схематически представлены электрофорез в геле агарозы и анализ пятен по Саузерну, проводимые для идентификации генапалочковидного вируса . Фиг.5 схематически представляет карту рестрикции вирусного генома . Фиг.6 представляет график прибыли веса контрольных неинфицированных личинок или личинок четвертого возраста после заражения вирусамидикого типа или . На фиг.7 приведен график смертности личинок после заражения личинок 4-го возраста вирусамидикого типа или . Фиг.8 представляет собой график прибыли веса после инфицирования личинок 5-го возраста вирусамидикого типа или . На фиг.9 приведен график смертности личинок после инфицирования личинок 5-го возраста вирусами дикого типаили . На фиг.10 приведен график смертности личинок после инфицирования личинок первого возраста вирусами дикого типаиликонцентрацией полиэдрических тел включения (ПТВ) 4,8 х 10 ПТВ/мл. На фиг.11 показан график смертности личинок после инфицирования личинок первого возраста вирусами дикого типаилис концентрацией 2,4 х 10 ПТВ/мл. Чешуекрылые насекомые в процессе развития от яйца до взрослой особи претерпевают хорошо охарактеризованную последовательность превращений (детальное описание см. е,, , 7 и 8,,, , 1984). После выхода из яйца у личинки насекомого начинается период интенсивного питания, в течение которого она будет несколько раз линять, что обеспечивает ей непрерывный рост. Промежутки времени между последовательными линьками называются возрастными (личиночными) стадиями. По завершении периода роста личинка окукливается и в конце концов превращается во взрослое насекомое. Процессы линьки и окукливания (называемые собирательно метаморфозом) регулируются совместным действием гормонов нескольких различных групп. Первоначальным стимулом является выделение определенными клетками мозга проторакотропного гормона (РТТН). 5 2078 1 Это стимулирует секрецию проторакальными железами экдистероидов, которые часто называют гормонами линьки насекомых. Присутствие ювенильного гормона обеспечивает линьку личинки, тогда как в его отсутствии личинка будет окукливаться. Гормон вылупления также представляется важным для осуществления некоторых связанных с метаморфозом поведенческих изменений. Палочковидный вирус , используемый в качестве модельной системы для многих исследований палочковидных вирусов, совершенно неожиданным образом вмешивается в описанный выше процесс развития насекомого. Инфицированныеличинки насекомых не способны более линять или окукливаться в связи с тем, чтонаправляет синтез фермента, известного как экдистероид-глюкозилтрансфераза , который избирательно инактивирует экдистероиды насекомых. Авторами данного изобретения идентифицирован кодирующийген, он простирается от 8,4 до 9,6 единиц карты генома(фиг.1 и 2). Как показано на фиг.1 С, содержащие генфрагменты вирусной ДНК были клонированы в плазмиды 19,13 и 13-. На фиг.2 показаны карты рестрикции областигенома и компьютерный анализ на наличие в данной области открытых рамок считывания. Только рамка 2 содержит относительно длинную открытую последовательность считывания, которая была идентифицирована как область кодирования гена . В таблице 1 приведена последовательность нуклеотидов генаи выведенная из нее последовательность из 506 аминокислот. Кодирующая последовательность генапростирается примерно от нуклеотида 149 до нуклеотида 1670. В предпочтительном воплощении данного изобретения генбакуловирусаинактивируется путем замещения его части на бактериальную последовательность, кодирующую синтез -галактозидазы. Такой рекомбинантный бакуловирус был обозначен . Во втором варианте предпочтительного воплощения, как показано на фиг.3, часть генавирусаудаляется без замены. Сравнение белков, синтезируемых при инфицированиидикого типа и , выявило, что белокпредставляет собой пептидную цепь с молекулярной массой 60 КДа, выделяемую инфицированными клетками. Альтернативным механизмом инактивации генавируса насекомых является внедрение гена, который кодирует синтез влияющего на метаморфоз гормона или инактивирующего такой гормон фермента и который проявляется в инфицированной указанным вирусом насекомых клетке. Обследования базы данных Генобанка выявило, что от 21 до 22 последовательности аминокислотгомологично -глюкозилтрансферазам млекопитающих. Была выявлена также гомология с глюкозилтрансферазой растений. Сопоставление последовательности аминокислоти некоторых этих ферментов показано в табл. 2. 2078 1 Таблица 1 Последовательность нуклеотидов и предсказанная последовательность аминокислот генавируса Таблица 2 иллюстрирует сопоставление последовательности аминокислоти ряда глюкозилтрансфераз других биологических видов. Предсказанная последовательность аминокислотсравнивается с человеческой(. (1987) . , 242581 мышиной 9(1985), предлагаемого. Буквы верхнего регистра указывают точное совпадение буквы нижнего регистра определяют замещения, часто встречающиеся среди родственных белков ( (1978),, . 5,. 3,,точки обозначают редко встречающиеся замещения, знак дефиса указывает пропуски в последовательности, знак вставки приводится в местах делеции аминокислот из последовательности. Виаминокислоты генав промежутке между стрелками удалены. Гомологичность генаизвестным трасферазе -глюкозы и -глюкуронозилтрасферазе подтверждает идентификацию этой последовательностикак кодирующей последовательности гена . У млекопитающих -глюкуронозилтрансферазы катализируют перенос глюкуроновой кислоты к целому ряду как экзогенных, так и эндогенных липофильных субстратов (смотри обзор в,(.),,, , 1986). Эта реакция присоединения играет существенную роль в детоксикации и безопасном выведении определенных лекарственных препаратов и канцерогенов. Кроме того, через соединения с глюкуроновой кислотой протекают процессы нормального метаболизма и размещения различных эндогенных соединений, таких, как билирубин и стероидные гормоны. Имеющиеся по системам насекомых данные указывают, что подобные реакции присоединения сахаров включают перенос глюкозы, а не глюкуроновой кислоты (обзор смотри(1977) в-,, Т, , . 219-232). Как и у млекопитающих, у насекомых в подобные реакции присоединения вступают разнообразные экзогенные и эндогенные соединения. Авторы данного изобретения показали, что -белок вирусапредставляет собой глюкозилтрансферазу, которая избирательно соединяет глюкозу с экдистероидами, такими как экдизон, 20 гидроксиэкдизон и макистерон А (см. табл. 3). Ни лизаты, ни внеклеточная среда неинфицированных клеток или инфицированныхклеток не модифицируют экдизон. Большая часть активной экдистероидглюкозилтрансферазы, вырабатываемой инфицированнымиклетками, выделяется в межклеточную среду только относительно низкий уровень ее активности наблюдается в лизатах инфицированныхклеток. С использованием генавирусав качестве метки генбыл идентифицирован, как показано на фиг.4, и в другом палочковидном вирусе, а именно в вирусе ядерного полиэдроза и. Для специалистов должны быть понятны преимущества, предоставляемые этим открытием, то есть что генлюбого палочковидного вируса, другого вируса насекомых или самого насекомого может быть локализован, охарактеризован и выделен аналогичным способом. Гены , нуклеотидная последовательность которых не менее чем на 70 гомологична последовательности, приведенной в табл. 1, считаются эквивалентными этой последовательности, при условии, что гомологичные гены кодируют фермент, представляющий собой экдистероидглюкозилтрансферазу. Функциональными эквивалентами генаявляются эквиваленты, которые также катализируют инактивацию экдистероидов, таких как экдизон, путем переноса половины глюкозы от -глюкозы к экдистероиду (экдистероидам). Такие функциональные -эквиваленты могут быть идентифицированы описанными здесь методами. Путем локализации, идентификации и выделения генаспециалист может, используя положения данного открытия и известные методики, инактивировать этот ген и получить агент, обеспечивающий более эффективный контроль над развитием и ростом насекомого. Сравнивая свойствасо свойствамидикого типа , авторы данного изобретения показали, что экспрессия генапредотвращает линьку или окукливание насекомого. Инфицированныенасекомые не линяют и не окукливаются, тогда как насекомые, инфицированные , линяют и стремятся окукливаться (смотри табл. 4 в примере 11). За счет подавления линьки и окукливания инфицирование вирусомдикого типа действительно может удлинить период питания личинки. Личинки, зараженные вирусом дикого типа в начале пятой возрастной стадии (последняя возрастная стадия), продолжают питаться до момента гибели, который наступает на 5 или 6 день после заражения. Однако неинфицированные личинки прекращают питаться, готовясь к окукливанию, через 2-3 дня после вступления в пятую возрастную стадию (смотри фиг.8). Аналогичный эффект наблюдается при обследовании личинок более ранних возрастных стадий. Во время линьки неинфицированные личинки прекращают питаться 10 2078 1 на период около 24 часов, тогда как зараженныеличинки не линяют и, соответственно, продолжают питаться (смотри фиг.6). Рекомбинантные палочковидные вирусы с отсутствующим функциональным геномне увеличивают продолжительность периода питания личинки. Таким образом, личинки, инфицированныев начальный период пятой возрастной стадии, прекращают питаться через два дня после заражения и готовятся к окукливанию (смотри фиг.8). Однако они не окукливаются и вместо этого погибают от вирусной инфекции даже быстрее, как показано на фиг.9, чем личинки, инфицированные вирусом дикого типа. Аналогичным образом личинки, инфицированные вирусом в ранней четвертой возрастной стадии, прекращают питаться спустя два дня после инфицирования и умирают затем быстрее, чем зараженные вирусом дикого типа (смотри фиг.6 и 7). То, что палочковидный вирус отсутствующим функциональным геномубивает насекомых быстрее, наиболее ярко видно, когда, как показано на фиг.10 и 11, вирусоминфицируются только что вышедшие из яиц личинки первой возрастной стадии. Зараженныеличинки умирают от вирусной инфекции на 3-4 дня раньше по сравнению с теми, которые были зараженыАсМР. Следовательно, рекомибинантные палочковидные вирусы с отсутствующим функциональным геномзначительно более эффективны как агенты контроля развития насекомых, чем палочковидные вирусы дикого типа. Для специалистов в данной области должны быть очевидны преимущества данного открытия, заключающегося в том, что генможет быть сделан нефункциональным в любом палочковидном вирусе или вирусе насекомых любым известным способом. Эффект, описанный выше и в последующих примерах, на полях будет еще более сильным. Инфицированныеличинки испытывают затруднения при линьке, которая все-таки происходит только в тщательно контролируемых лабораторных условиях. В условиях отсутствия жесткого контроля температуры и освещенности многие личинки не могут завершить линьку. Такие насекомые не начинают снова питаться и вскоре после этого погибают. Несмотря на то, что несколько сокращается продолжительность времени, в течение которого потомство вируса может накапливаться в личинке, зараженной палочковидовым вирусом, у которого отсутствует функциональный ген , и питание инфицированного насекомого снижается, наблюдается значительное продуцирование дочернего вируса. Количество вируса в расчете на одну личинку, полученное после зараженияличинок поздних возрастных стадий, составляет примерно половину от полученного при заражении вирусом дикого типа. Этого достаточно для обеспечения переноса вируса в поле и эффективного в смысле стоимости получения больших количеств вирусных частиц. В другом варианте воплощения данного изобретения вирус насекомых с отсутствующим функциональным геноммодифицируют с помощью генной инженерии таким образом, что его эффективность как агента биологического контроля повышается за счет введения второго гена, продукт которого оказывает влияние на развитие насекомого. Ген, кодирующий РТТН (пептидный гормон) может быть введен в геном вируса с отсутствующим геноми экспрессия РТТН при этом будет достаточно высока, чтобы оказывать влияние на процессы линьки. У инфицированных таким вирусом личинок в высшей степени нарушен гормональный контроль развития. Такие насекомые быстро заболевают, что влечет за собой ущербное развитие и рост, снижение питания и ускорение смерти. Гормон вылупления также представляет собой мелкий пептидный гормон, ген которого может быть введен с помощью известных методов в вирусный геном с нефункциональным геном . В связи с тем, что гормоном вылупления определяются многие связанные с метаморфозом поведенческие изменения, насекомое, зараженное вирусом -, продуцирующим этот гормон в достаточно больших количествах, будет демонстрировать аномальное поведение и/или развитие, например пониженное питание. Первичным регулятором активности ювенильного гормона в насекомом является фермент эстераза,инактивирующая ювенильный гормон. Рекомбинантный вирус, лишенный функционального генаи продуцирующий достаточно высокий уровень эстеразы ювенильного гормона, может оказывать неблагоприятное воздействие на поведение и/или развитие насекомого. Важно отметить, что, хотя все вышеупомянутые гены могут быть введены в геном вирусов дикого типа,нельзя ожидать, что в этом случае они в значительной степени будут влиять на поведение насекомого, поскольку экспрессия генавирусами дикого типа инактивирует экдистероидные гормоны линьки и это препятствует, несмотря на продуцирование других гормонов, нормальному протеканию метаморфоза. Таким образом, успешная стратегия должна включать, как описано в данном изобретении, генерирование вирусов,предназначенных для изменения протекания метаморфоза в зависимости от предшествующего инактивирования гена . 11 2078 1 В данном изобретении агент контроля над ростом и развитием насекомых представляет собой композицию или активный ингредиент композиции, которая оказывает неблагоприятное воздействие на насекомоевредитель. Реакцией на агент контроля насекомых является снижение питания, нарушается нормальный метаморфоз, в результате чего смерть насекомого становится неизбежной. Активным ингредиентом композиции по данному изобретению является вирус насекомых, в частности бакуловирус, генетически измененный с целью инактивации гена, кодирующего синтез обусловливающего модифицирование экдистероида фермента или вирус насекомых, подвергнутый дальнейшим генетическим изменениям, результатом которых является экспрессия гетерологичного гена, оказывающего влияние на метаморфоз. Инсектицидные композиции, годные для нанесения на растения с целью контроля насекомых-вредителей, содержат кроме активного ингредиента приемлемый в сельскохозяйственном отношении носитель. Нанесение инсектицидной композиции данного изобретения может предохранить растения от насекомых-вредителей за счет снижения питания и гибели восприимчивых насекомых. Специалисты знают, каким образом выбрать активное начало композиции, а именно вирус, подходящий для определенного насекомого-вредителя. Для специалистов ясно, что насекомые-вредители могут быть подвергнуты воздействию контролирующего агента данного изобретения любым традиционным способом, включая глотание, вдыхание или прямой контакт. Описанные в данном изобретении подвергнутые генетическим изменениям палочковидные вирусы найдут основное применение именно как компоненты сельскохозяйственных композиций, предназначенных для нанесения на растения с целью биологического контроля насекомых, являющихся вредителями растений. Известны разнообразные способы приготовления таких приемлемых для сельского хозяйства композиций. Концентрация основного ингредиента, которая требуется для получения эффективных инсектицидных композиций, применяемых в сельском хозяйстве для защиты растений, зависит от типа организма, используемой мутации и от формулы композиции. Как понятно специалисту,эффективные значения концентраций контролирующего агента в инсектицидной композиции можно легко определить экспериментально. Например, концентрацию вируса, дающую инсектицидный эффект, можно легко определить описанными в любом из примеров 611 способами. Сельскохозяйственные композиции должны подходить для применения в сельском хозяйстве и хорошо диспергироваться в поле. В общем случае компоненты композиции не должны быть фитотоксичными и наносить вред всему сообществу окклюдирующих вирусов . Нанесение на листья не должно приносить вреда листьям или повреждать их. Кроме соответствующих твердых или, что является более предпочтительным, жидких носителей,сельскохозяйственные композиции могут включать компоненты, повышающие липучесть или адгезию, эмульгаторы или увлажнители, но не компоненты, снижающие питание насекомых или функционирование вируса. Может оказаться также желательным введение компонентов, предохраняющих контролирующий агент от инактивации под действием ультрафиолетового излучения. Сельскохозяйственные композиции для контроля насекомыхвредителей могут также включать агенты, стимулирующие питание насекомых. Имеются обзоры, описывающие способы нанесения агентов биологического контроля насекомых и применение их в сельском хозяйстве. Смотри, например, о(1981) в 1970-1980,34, . 621-634, ,39, . 717732(1980) в. 417-488(1982) в,. 105-114 и(1982) , . 115-127, .. Данное изобретение иллюстрируется приводимыми ниже примерами, которые ни в коей мере нельзя рассматривать как ограничения области данного изобретения. Ясно, что специалистам могут представиться различные варианты конкретного воплощения, модификации и эквиваленты изобретения, не выходящие за пределы идеи данного изобретения и/или прилагаемой формулы изобретения. Пример 1. Положение генав геномепоказано на фиг.1, над картой геномапоказан масштаб в единицах карты. Для определения нуклеотидной последовательности этого типа и соседних с ним областей, что позволило бы осуществить последующие генетические манипуляции, необходимо вначале клонировать некоторые фрагменты ДНК, фланкирующие данную область, в плазмидных векторах (стандартные методики клонирования смотри .. (1982) вА,,. ). 2078 1 На панели А фиг.1 показана линейная карта генома АсМ после расщепления его рестриктазамии. На панели В представлена в увеличенном масштабе область генома от 7,6 до 11,1 единиц карты, показывающая положение гена . В качестве исходного АсМ использовался штамм 1 ((1978) 27754). Подвергаемые клонированию фрагменты ДНК и названия полученных плазмид показаны на фиг.1. Панель С. Фрагмент 1, который занимает область от сайта , расположенного в точке 7,6 у.е., до сайта(11,1 у.е.), клонируется в плазмидный вектор 19 оба фрагмента 2 и 3 от(7,6 у.е.) до(8,65 у.е.) и от(8,65 у.е.) до(10,5 .е.), соответственно клонируются в векторыМ 13 иМ 13 - (,, ). Фрагмент 5 расположен от- сайта (8,35 у.е.) до- айта (8,7 у.е.) клонируется вМ 13 . Затем генерируется большое количество субклонов плазмид ВСРЕ и ВСЕ ( (1984)28351). Эти подклоны отличаются последовательно увеличивающимися делециями вирусных вставок, так что они содержат различные количества вирусной ДНК, от менее чем 50 пар оснований для полного вирусного фрагмента. Многие такие субклоны и плазмиды ВС затем наращиваются (. (1977) . .. .745463), так что в обоих направлениях восстанавливается последовательность целого гена. Затем полученная нуклеотидная последовательность анализируется на предмет наличия открытых рамок считывания, которые могут кодировать протеин, с помощью компьютерных программ(1984), .. 12643-655 и. (1984) .. 12387-396. Такой анализ показывает, что генкодирует протеин, состоящий из 506 аминокислот. Последовательность нуклеотидов генаи предсказанная аминокислотная последовательность продукта этого гена приведена в таблице 1. Пример 2. Для того чтобы сконструировать рекомбинантные вирусы, неспособные к экспрессии функционального гена , необходимо произвести дальнейшие манипуляции с описанными в примере 1 клонами плазмид. Плазмиду сс расщепляют с помощью эндонуклеаз рестрикциии(сайты рестрикции внутри гена , смотри фиг.3) и отбрасывают маленький фрагмент. Ген, отщепленный от 104 (. (1983). 100293-303) с помощью рестриктази А ,внедряется между сайтамиипосле того, как свободные концызаполняются с помощью ДНК-полимеразы фага Т 4. Полученную плазмиду обозначают . В этой плазмиде внедренный геннаходится в пределах рамки вместе с предшествующей кодирующей последовательностью . Плазмиду, напротив, конструируют простым связыванием сайтови(после того, как концы обоих сайтов заполняются), не вставляя между ними какой-либо нуклеотидной последовательности. Все вирусы являются производными от исходного штамма -((1978) ), очищаются через бляшки и размножаются на культуре линии клеток 21 (-клетки).(1977)13213-217) с использованием описанных ранее методов ((1978).,(1986),, . 8 (. .. )., ,277-298, 1986). Затем плазмидупереносят вместе с ДНК АсМР дикого типа в -клетки, как описано в. (1986) . Эта процедура обеспечивает гомологичную рекомбинацию между последовательностями вирусной и плазмидной ДНК, что приводит к замещению гена вирусана связку генов плазмиды- . Поскольку остающаяся кодирующая последовательностьнаходится в рамке считывания вместе с последовательностью , такой рекомбинантный вирус будет продуцировать слитый белок, представляющий собой первые 84 аминокислоты , соединенные с -галактозидазой. Рекомбинантный вирус, обозначенный., поддается идентификации, так как экспрессия -галактозидазы приводит к образованию голубых вирусных бляшек в присутствии хромогенного индикатора, такого, как 5-бром-4-хлор-3-индолилгалактопиранозида (Х-). Диаграмма генавирусаприведена на панели В фиг.2. Рекомбинантный вирусполучают перенесением плазмиды р и ДНК из вирусавклетки. Гомологичная рекомбинация приводит к замещению вгенной связки-на генс делецией. Рекомбинантный вирусидентифицируют по его неспособности образовывать голубые бляшки в присутствии Х-. Структура генавирусапоказана на фиг.3, С. Пример 3. Продукт гена -идентифицируют путем сравнения белков, синтезируемых вирусомдикого типа (который продуцирует ), и синтезируемых вирусамиили(не способны продуцировать ЕТ). -клетки инфицируют либо АсМ дикого типа, либос множественностью заражений (МО) 20, как описано(1990) , , 641321-1328. Инфицированные клетки 13 2078 1 также анализируют. Спустя 6 часов после заражения клетки инкубируют в течение 1 часа в присутствии 35-метионина с целью внесения радиоактивных меток во все белки. Клетки затем подвергают лизису и отделяют белки электрофорезом в геле-полиакриламида (-) (. (1970)227680-685). Все секретированные клетками белки также собираются и анализируются. После проведения-РАЕ меченные радиоизотопами белки определяются с помощью авторадиографии. ИнфицированныеМ клетки секретировали белок с молекулярной массой 60 КДа , чего не произошло в случае инфицированныхили неинфицированных клеток. Этот белок однако не определяется в лизатах клеток,инфицированных диким типом АсМ, что доказывает его секрецию клетками. Эти данные показывают,что продуктом генаявляется синтезируемый 60 Да-протеин, что хорошо согласуется с данными по последовательности нуклеотидов и аминокислот. Пример 4. Ферментивную активность белка ЕТ определяли путем сравнения -клеток, инфицированныхАсМ или .-клетки, инфицированныеАсМ илиописаны в примере 3. Через двенадцать часовклетки и межклеточную среду собрали и обработали по отдельности. Параллельно обрабатывали неинфицированные клетки. Клеточный лизат или межклеточную среду инкубировали в присутствии 1 мМ глюкозы и 0,253 экдизона, как описано у Ое(1989)2451110-1112. Активность экдистероидглюкозилтрансферазы в клеточных лизатах или межклеточной жидкости будет катализировать перенос глюкозы от -глюкозы к экдизону с образованием соединения (конъюгата) экдизон-глюкоза. Экдизон и экдизон-глюкоза разделяются тонкослойной хроматографией на силикагеле((1988) . . 109-321) и визуализируются с помощью авторадиографии. Комплекс экдизон-глюкозаобразуется только при тестировании инфицированных АсМ клеточных лизатов или межклеточной жидкости. Его не наблюдается при использовании неинфицированных или инфицированныхклеток или межклеточной жидкости, что доказывает, что активность обусловлена экспрессией . Большая часть активности сосредоточена в межклеточной среде, что находится в соответствии с обсуждаемыми в примере 3 данными. Доказательство присоединения глюкозы к экдизону получают при тестировании -инфицированных лизатов описанным выше способом, за исключением того, что Р-глюкозу заменяют на меченную радиоактивными изотопами Р -14 С-глюкозу. Реакции, протекающие с участием немеченной -глюкозы или меченной Р-14 С-глюкозы, с присутствующим в обеих реакциях 3-экдизоном, и подсчет импульсов образующихся соединений показывает, что может быть определен и 3 Н из экдинона, и 14 С из глюкозы. Эти данные доказывают, что продуктом генаявляется -глюкозилтрансфераза, которая является катализатором переноса глюкозы от Р-глюкозы к экдизону. Далее проводили эксперименты с целью более тщательного определения субстратной специфичности . В этих экспериментах инкубировали различные субстраты (1 м) в присутствии межклеточной среды, извлеченной из инфицированных - АсМ клеток, в которых наблюдалась довольно высокая активность . Для обеспечения уверенности в том, что все наблюдаемые случаи образования соединения обусловлены , каждый субстрат инкубировали также со средой, извлеченной из неинфицированных и инфицированныхклеток, которые не способны продуцировать Е. В каждом случае в реакцию вводили 0,0514 Сглюкозы. Все соединения, выступающие по отношению к ЕТ как субстраты, должны присоединять глюкозу,они поддаются определению, поскольку глюкоза помечена радиоизотопами. Таблица 3. Субстратная специфичностьСубстрат р-аминобензойная кислота билирубин хлорамфеникоп диэтилстилбестрол экдизон Контроль (пикомоли перенесенной Дикий тип (пикомоли перенесенглюкозы) ной глюкозы) р-нитрофенол фенолфталеин тестостерон-тетралол Субстраты инкубируют в присутствии среды, полученной из соответствующим образом инфицированных клеток и 0,0514 С-глюкозы. Количество перенесенной глюкозы вычисляется исходя из числа импульсов от соответствующих областей хроматографических пластинок. Для дальнейшего контроля вводили 14 С-глюкуроновую кислоту в отдельные системы реакций со средами, полученными из инфицированных вирусом дикого типа клеток, в целях демонстрации того, что глюкуроновая кислота в этих реакциях не переносится. Полученные данные представлены в табл. 3. В качестве субстратов идентифицированы только экдизон, 20-гидроксиэкдизон и макистерон А (все - экдистероиды). В средах, извлеченных из ложно инфицированных или инфицированныхклеток, конъюгаты не обнаружены, что подтверждает обусловленность наблюдаемой активности экспрессией . При использовании 14 С - глюкуроновой кислоты конъюгаты не наблюдаются, что является демонстрацией того, что глюкуроновая кислота не переносится с помощью . Пример 5. Для того чтобы получить доказательства наличия также и у других бакуловирусов генов, гомологичных в значительной степени генуАсМ, отделили ДНК вирусаи подвергли ее по отдельности воздействию эндонуклеаз рестрикции ,и. Эти ферменты расщепляют вирусную ДНК на несколько сегментов различного размера, положение которых в геноме ОрМ уже известно (. (1984) . , 52699). Затем провели гибридизацию по Саузерну описанным .. (1982)способом. Вырезали внутренний сегмент генаАсМ из плазмиды ВСЕ с помощью ферментови(см. фиг.1). Этот фрагмент пометили радиоактивным изотопом 32 и использовали как средство идентификации любых родственных последовательностей в геноме ОрМ. Ясно, что в соответствующих условиях фрагмент ДНК присоединит другой фрагмент, в составе которого имеется аналогичная или идентичная последовательность. Таким образом, на нейлоновой мембране происходит присоединение метки-генаАсМ к любому фрагменту ДНК , в котором содержатся родственные последовательности ДНК. Место присоединения метки можно визуализировать с помощью экспозиции мембраны рентгеновским лучам. Вначале происходит гибридизация метки -с нейлоновой мембраной в нежестких условиях (1 М хлорида натрия, 0,3 М цитрата натрия, 5 сульфата декстрана, 5 х раствор , 0,25 при 37 С). Это допускает гибридизацию метки с относительно удаленными родственными последовательностями. Далее постепенно увеличивают жесткость гибридизации, поднимая температуру гибридизации или вводя в раствор гибридизации формамид, до тех пор, пока не возникнут специфические гибридизационные связи. Гибридизация, показанная на фиг.4, протекает в следующих условиях 1 М хлорида натрия, 0,3 М цитрата натрия, 5 сульфата декстрана, 5 х раствор , 0,25 температура 68 С, продолжительность 15 ч. Затем мембрану дважды промывают, каждый раз в течение 15 минут, в растворе 0,3 М хлорида натрия, 0,1 М цитрата натрия и 0,1 при 68 С. На фиг.4 показано, что меткаприсоединяется к определенным фрагментам ДНК ОрМ, а именно к фрагменту В , фрагменту А Ва и к фрагментами. Отметим, что гензанимает в геноме Ор такое же относительное положение, что и ген(фиг.5). Аналогичная пропись используется для идентификации гомологичных генов у других энтомопатогенов. Понятно, что для подтверждения ЕТ-активности в случае сильно расходящихся последовательностей потребуется метод рестрикции, описанный в примере 4. Тогда для выделения гена, кодирующего фермент , потребуется молекулярно-генетический анализ, методология которого известна. Для обнаружения гена, кодирующего ЕТ в других организмах, используется, в отличие от вышеописанного,специфический способ тестирования на активность Р-глюкозилтрансферазы, описанной в примере 4. Этот тест используется для определения энзима в процессе очистки стандартными биологическими методами. После очистки определяется частичная аминокислотная последовательность белка ЕТ. Полученную информацию используют для создания олигонуклеотидной метки, с помощью которой затем определяют положение генав геноме. Пример 6. Титр экдистероида в гемолимфе изменяется циклически, регулируя превращения и личинка-личинка, и личинка-куколка, и поскольку предполагается, что присоединение глюкозы инактивирует экдистероиды(. (1986) . . . 91759. (1987) . . . . 41. (1988) . . . . 7157), т представляется возможной взаимосвязь нарушения процесса нормального развития насекомого при инфицировании вирусом АсМ с экспрессией. Нарушение развития демонстрируют следующим образом только что перенесшие линьку личинки чет 15 2078 1 вертого возраста . инфицировали вирусамиилипутем впрыскивания и ежедневно наблюдали за возможными изменениями их развития. Для отрицательного контроля одной группе личинок ввели жидкость культуры ткани. Результаты эксперимента приведены в табл. 4, смотри ниже. Все личинки, которым ввели культуру ткани (ложное инфицирование), как и ожидалось, перелиняли, превратившись в личинки пятого возраста. Из шестнадцати личинок, инфицированных вирусом дикого типа подобная трансформация наблюдалась только у одной. Напротив, все личинки, инфицированные мутантным вирусом, перелиняли из четвертой в пятую возрастную стадию. Таким образом, экспрессия генавирусаявно и специфично подавляет линьку насекомого-хозяина. Впоследствии обе инфицированные группы личинок погибли от вирусной инфекции, что доказывает, что нарушение функциивирусане препятствует ему убивать хозяина. Таблица 4. Подавление линьки при инфицировании вирусомВирус Линька Смертность Ложное инфицирование 16 0 Дикий тип 1 16 16 16 Личинкам . четвертого возраста ввели 05 илив 5 л. Ложноинфицированным личинкам ввели 5 л жидкой культуры ткани. Каждая группа состояла из 16 личинок, которые содержались в следующих условиях искусственная диета ( (1969). 33-134), температура 28 С с циклом светтемнота 1410 часов. Личинки каждый день осматривались на предмет линьки, и на 7 й день регистрировалась смертность. При инъекции вируса личинкам ранней пятой стадии получены аналогичные результаты. Ни одна из только что перелинявших личинок пятого возраста, инфицированных вирусом дикого типа, не обнаружила каких-либо признаков окукливания, тогда как большинство инфицированныхличинок проявили некоторые поведенческие отклонения (прекращение питания, беспокойство и плетение кокона), что является показателем приближения превращения из личинки в куколку. Однако все личинки, которым была введена вирусная инфекция, погибли до окукливания. Эти данные показывают, что инфицирование АсМР препятствует линьке или окукливанию личинок. Они показывают также, что подобное нарушение развития насекомых обусловлено экспрессией гена . Пример 7. БиоанализАсМР дикого типа ( ) ивыявил, что экспрессия генаувеличивает время, в течение которого личинка питается, и что нарушение функцииулучшает характеристики вируса как пестицида. При проведении данных исследований личинкам . делали инъекции либоАсМР,либона ранней 4-й стадии. Для сравнения контрольным личинкам вводили среду культуры ткани,которая не содержала вируса. У личинок каждый день проверяли прибыль веса, признаки линьки или окукливания и смертность. На фиг.6 и 7, соответственно, приведен средний дневной привес личинок различных групп, а также процент смертности. Контрольные личинки в течение первых двух дней показали умеренный рост. В течение второго дня все они перелиняли в пятую стадию. Далее личинки резко выросли за два дня,после чего прекратили питаться и приготовились к окукливанию. Только одна из 16 личинок, инфицированныхАсМР, перелиняла, вместо чего остальные в течение трех дней после заражения личинки непрерывно росли. На этой стадии они заболевают, но вплоть до 5 дня ни одна личинка не погибла. К 6-му дню погибли все инфицированныеАсМР личинки. Напротив, все личинки, инфицированные , перенесли линьку из четвертой в пятую возрастную стадию и в течение этого периода времени они не питались. Этим объясняется отсутствие привеса с 1-го по 2-й день. После линьки они возобновляют питание, но к 3-му дню они начинают проявлять признаки болезни. Четыре дня спустя после заражения они начинают умирать и к 5-му дню все погибают. Личинки, инфицированные производным от АсМ вирусом, у которого отсутствует функциональный ген , меньше питаются и погибают после заражения быстрее по сравнению с личинками, инфицированными диким типом АсМ. При инфицировании личинок 5-й возрастной стадии эти явления наблюдаются еще более четко (фиг.8 и 9). Как и ожидалось, контрольные личинки за два дня значительно выросли, после чего прекратили питаться,готовясь к окукливанию. Прекращение питания сопровождается резким падением веса. Личинки, инфицированныеАсМР, не проявили признаков прекращения питания, они продолжали питаться и прибавлять в весе в течение еще двух дней, а затем начали проявляться признаки заболевания. Смертность до седьмого дня после заражения не была полной. Можно сделать следующий вывод. Личинки, инфицированные , как и контрольные, питаются только в течение первых двух дней после заражения. Затем наблюдается, поскольку они готовятся к окукливанию, резкая потеря веса. Однако, ни одна из этих личинок не окукливается к третьему дню наблюдаются признаки болезни, а через шесть дней после заражения все они погибают. 2078 1 Пример 8 Сравнивается воздействие зараженияиАсМР на только что вылупившиеся личинки. первого возраста. Новорожденным личинкам и, . дают корм, в котором содержатся в различных количествах полиэдрические тела включенияилиАсМР, и ежедневно наблюдают смертность. На фиг.10 и 11 приведены результаты, полученные для двух различных доз. Можно видеть, что в обоих случаях у инфицированныхличинок значительная степень смертности наступает намного раньше по сравнению с личинками, инфицированными вирусом дикого типа. Вообще, личинки, зараженные рекомбинантным вирусом, погибают на три-четыре дня раньше, чем зараженные -вирусом. Этот результат является дополнительным доказательством того, что бакуловирусы, содержащие инактивированные гены, лучше действуют в качестве биологических пестицидов, чем бакуловирусы дикого типа с интактными генами . Пример 9. Для конструирования рекомбинантных вирусов, с экспрессией проторакотропного гормона (РТТН), ген РТТН клонируют в плазмидный вектор переносаХ, который описан в .07/353,847 от 17 мая 1989 г., заявка включена здесь в качестве ссылки. Эта плазмида содержит восходящую и нисходящую последовательности гена полиэдрина АсМР, который является медиатором гомологической рекомбинации экспрессируемого гена РТТН с геномом вируса -. Сайт множественного клонирования располагается у обычного сайта инициирования трансляции полиэдрина, вниз отХмодифицированного промотора полиэдрина (.,7039 (1988). Ген РТТН хвыделяется из плазмиды рВс 22 к-С 19 ( е .,2471333 (1990 с помощью рестрикционного фермента. Связующие концызаполняются с помощью ДНК-полимеразы фага Т 4, а затем плазмиду расщепляют с помощью . ПлазмидуХ расщепляют с помощью. Липкий конецудаляют ДНК-полимеразой фага Т 4 и расщепляют плазмиду с помощью Есо. Фрагмент, в котором содержится ген РТТН, клонируют через эти сайты в плазмиду переноса. В полученной рекомбинантной плазмиде, обозначаемой рЕРТТН, ген РТТН расположен сразу послеХ-модифицированного промотора полиэдрина. Рекомбинантные вирусы с экспрессией РТТН получают путем контрасфекции рЕ РТТН в -клетки с ДНК вирусовАсМР или ЕТЕ. Рекомбинация между последовательностями, фланкирующими полиэдрин в вирусной ДНК, и последовательностями, фланкирующими ген РТН в плазмиде рЕРТТН,приводит к замещению гена полиэдрина на ген РТТН. Вирусы, в геноме которых имела место такая рекомбинация, идентифицируют по отрицательному по окклюзии фенотипу (., в,, . 8, .. , .,, 1986, 277-298). Соответствующие рекомбинантные вирусы обозначаютсяи . Аналогичным образом получают рекомбинантные вирусы с экспрессией эстеразы ювенильного гормона. Сначала вырезают ген эстеразы ювенильного гормона., (1989) . . . 26412419) из плазмиды рСНЕ 16 В (. (1990)344458) посредством расщепленияи. Плазмиду переносаХ также отщепляют посредствоми Ки фрагмент, включающий ген эстеразы ювенильного гормона внедряют между этими сайтами. Таким образом,включает последовательности гена полиэдрина, фланкирующие ген эстеразы ювенильного гормона. Рекомбинантные вирусы - иполучают котрансфекцией Е с ДНКили, соответственно, и отбором бляшек без тел включения. Для конструирования рекомбинантных вирусов с экспрессией гормона вылупления вырезают ген гормона вылупленияиз плазмиды р 5-3 ( . . (1989) . . . .868123) путем расщепленияи ..расщепляют с помощью, свободный конецудаляют посредством ДНК полимеразы фага Т 4, а затем расщепляют с помощью . Внедрение фрагмента,содержащего ген гормона вылупления, в плазмиду перемещения дает рекомбинант рЕЕН, в котором ген гормона вылупления располагается вниз от промотора-модифицирования полиэдрина. Контрансфекция этой плазмиды с ДНКили 26 позволяет выделить, соответственно, рекомбинантные вирусы- Е и А 26 . А 26 представляет собой рекомбинантный вирус со вставкой гена.внутри гена А 26 (., . .). Функция гена А 26 неизвестна, а по фенотипу, что касается метаморфоза, А 26 представляет собой дикий тип. Из-за присутствия гена спроизводные А 26 дают голубые бляшки в присутствии -. Пример 10. Чтобы оценитьэффект таких рекомбинантных вирусов, личинкам .ввели 205 вирусов , - РТТН,или одновременно - РТТН и -(по 105 каждого) личинки находились в поздней 3-й возрастной стадии или в ранней 4-й. При введении всех -вирусов инфицированные насекомые перенесли линьку и пережили 4-ю стадию, а к 3-му дню обнаружили соскальзывание головной капсулы, что указывает на приближающуюся линьку. После инфицирования одним- РТТН или совместно -и Е- НЕ экспрессия РТТН приводит к быстрому заболеванию 17 2078 1 насекомых, а к 4-му дню наблюдается значительная смертность. Напротив, насекомые, инфицированные Е, вплоть до 5-го дня не обнаруживают значительной смертности. Как и ожидалось, насекомые,инфицированные вирусом РТН, никогда не проявляют признаков перехода на 5-ю стадию. Соскальзывания головной капсулы не наблюдается и до 6-го дня не замечено значительной смертности. Таким образом, экспрессия РТТН в отсутствиеприближает на 1 день по сравнению с инфекциейсрок гибели насекомых в результате заражения. Эти данные демонстрируют улучшение пестицидных свойств бакуловирусов за счет экспрессии генов, влияющих на метаморфоз насекомых, и показывают, что эффективность такой стратегии возможна только при инактивировании гена . Таблица 5 Процент смертности Вирус Пример 11. Генерирование положительных по признаку образования тел включения вирусов с экспрессией гетерологичных белков, влияющих на развитие насекомых, может осуществляться по следующей схеме. Во-первых,конструируется отрицательный по признаку окклюзии вирус с экспрессией -галактозидазы. Ген.,кодирующий фермент -галактозидазу, клонируют в вектор переноса р-, описанный в 07/353,847 от 17 мая 1989 г. Вектор р- включает последовательности, расположенные в геноме АсМ по восходящей и по нисходящей от гена полиэдрина, причем сайт множественного клонирования расположен непосредственно по нисходящей от синтетического модифицированного промотора полиэдрина. Генвырезают из плазмиды 105 (. 1983)посредством расщепления. Выступающий конец удаляется с помощью нуклеазы, и плазмиду расщепляют посредством. р- расщепляют по сайтам Есо ии клонируют генв эти сайты. Полученная плазмида обозначается р- , в ней генрасполагается непосредственно по нисходящей от синтетического модифицированного промотора полиэдрина. р-переносится в - клетки с ДНК вируса, после чего отделяются отрицательные по признаку окклюзии бляшки с экспрессией галактозидазы, которые представляют собой вирус - - . Для построения положительного по признаку образования тел включения рекомбинантного вируса, у которого имеет место экспрессия РТТН, ген РТТН клонируют в вектор переносаХХ 3. При конструировании рр ХХ 3 сначала строится промежуточная плазмида рр Х. Плазмида Х, (описанная в заявке на патент США серийный номер 07/353,847 от 17 мая 1989 г.) разрезается пои концы заполняются ДНК-полимеразой. Плазмиду(описана в заявке на патент США серийный номер 07/353,847 от 17 мая 1989 г.) разрезают по Есо ии маленький фрагмент Есо-ас очищают. Фрагменты двух плазмид связывают и отбирают р ХСАТ. ПлазмидаХ идентична плазмидеза исключением того, что сайт множественного клонирования в промежутке от сайтадо сайта ас совпадает с . Для конструирования сайта множественного клонирования 3 (описано в заявке на патент США сер. номер 07/353,847 от 17 мая 1989 г) между сайтами - плазмиды рр Х вводится полилинкер. Последовательность сайта множественного клонирования в рр ХХ 3 от сайтадо сайтатаковаААТААА ./ - - -. Эта плазмида содержит интактный ген полиэдрина под контролем промотора полиэдрина дикого типа. Синтетический модифицированный промотор полиэдрина расположен по восходящей от гена полиэдрина и с противоположной ориентацией. Положение сайта множественного клонирования обеспечивает возможность внедрения генов, экспрессия которых должна осуществляться под контролем синтетического модифицированного промотора полиэдрина. Ген РТТН вырезают из плазмиды рВс 22 к.(. (1990) ) путем расщепления по. Свободный конецзаполняют ДНКполимеразой фага Т 4, и расщепляют плазмиду по Есо. р ХХ 3 расщепляют поии клонируют ген РТТН в эти сайты, что дает плазмиду. Ген РТТН в этой плазмиде расположен по нисходящей ветви от синтетического промотора модифицированного полиэдрина, но по соседству и с противоположной ориентацией относительно промотора полиэдрина дикого типа и кодирующих последовательностей. Оба гена, ген РТТН и полиэдрина, фланкируются и по восходящей, и по нисходящей последовательностями гена полиэдрина генома АсМ.РТТН переносится в -клетки совместно с ДНК - - . Рекомбинация между восходящими и нисходящими последовательностями полиэдрина в вирусной ДНК и последовательностями, фланкирующими гены РТТН и полиэдрина в рр РТТН, приводит к замещению гена- -на гены 18 2078 1 РТТН и полиэдрина изРТТН. Рекомбинантный вирус Е-идентифицируют по фенотипу, отрицательному по признаку-галактозидазы и положительному по признаку окклюзии. Для конструирования положительного по признаку окклюзии вируса с экспрессией экстеразы ювенильного гормона вырезали ген эстеразы ювенильного гормона из плазмиды 16 (. (1990) ) посредством расщепления по, удаления свободного конца посредством ДНК-полимеразы фага Т 4 и рассекания по . Затем клонировали ген экстеразы ювенильного гормона в плазмиду рр ХХ 3, которую расщепили по Есо и . Полученную плазмиду,, подвергают контрансфекции с ДНК - , получая рекомбинантный вирус -. У такого положительного по окклюзии вируса экспрессия эстеразы ювенильного гормона происходит под контролем синтетического промотора модифицированного полиэдрина. Аналогичным образом вырезают ген гормона вылупления из плазмилы 5-3 (. (1990) ) посредством рассекания поии клонирования в рр ХХ 3, которая затем расщепляется пои . В результате контрансфекции полученной плазмиды, , с ДНК - -получают рекомбинантный вирус - Е. Положительные по признаку образования тел включения Е- вирусы подвергают далее генетическим изменениям, вызывающим экспрессию белка, который влияет на метамофроз насекомых (пептидный гормон насекомых или фермент, инактивирующий гормоны насекомых), в результате чего они снижают питание и ускоряют гибель инфицированных личинок насекомых эффективнее по сравнению с бакуловирусами дикого типа или с бакуловирусами, генетические изменения в которых вызвали только инактивирование гена е. Поскольку регуляторы роста и развития насекомых примера 11 образуют тела включения, эти вирусы могут вводиться в эффективные инсектицидные, приемлемые для сельского хозяйства композиции, которые можно наносить на инфицированные посевы. Глотание таких окклюдированных вирусных частиц насекомыми приведет к распространению вирусов по полям и, тем самым, к распространению контролирующего агента. Инфекция вызовет гибель насекомых и, следовательно, защитит посевы от насекомых-вредителей. Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66. 20
МПК / Метки
МПК: C12N 7/01, C12N 15/00, A01N 63/00
Метки: борьбы, инсектицидная, способ, модифицированного, полиэдроза, генетически, штамм, бакуловируса, композиция, вируса, получения, ядерного, насекомыми
Код ссылки
<a href="https://by.patents.su/20-2078-sposob-polucheniya-geneticheski-modificirovannogo-bakulovirusa-shtamm-virusa-yadernogo-poliedroza-sposob-borby-s-nasekomymi-insekticidnaya-kompoziciya.html" rel="bookmark" title="База патентов Беларуси">Способ получения генетически модифицированного бакуловируса, штамм вируса ядерного полиэдроза, способ борьбы с насекомыми, инсектицидная композиция</a>
Предыдущий патент: Ингибитор вируса герпеса и способ подавления размножения вируса герпеса
Следующий патент: Способ получения сульфонил-b-D-тиоксилозида
Случайный патент: Лазер