Вакцина для профилактики или лечения опосредованной Т-клетками патологии или нерегулируемой репликации клонами Т-клеток, способ получения вакцины, способ диагностики или прогнозирования восприимчивости к ревматоидному артриту или рассеянному склерозу, сп
Текст
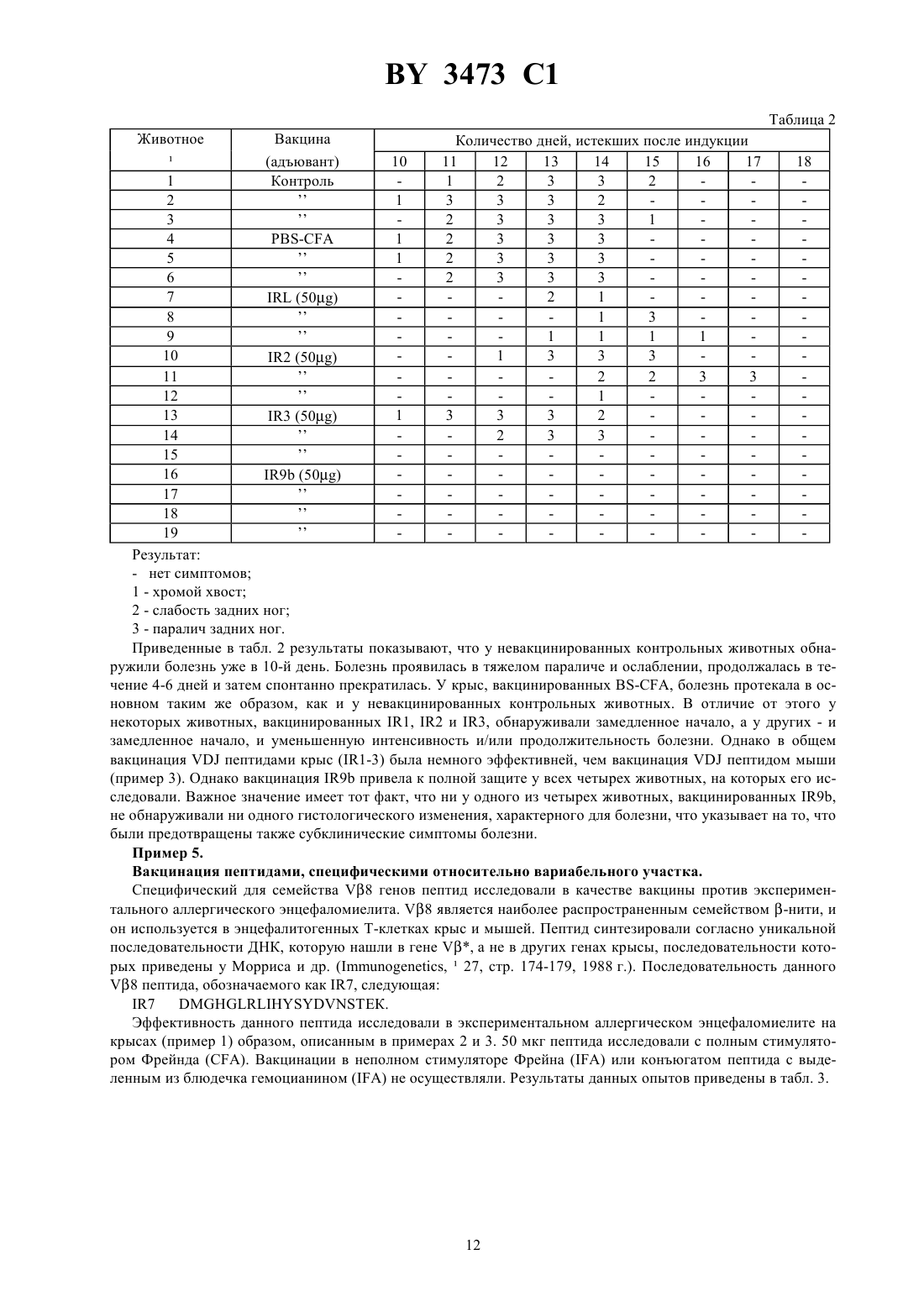
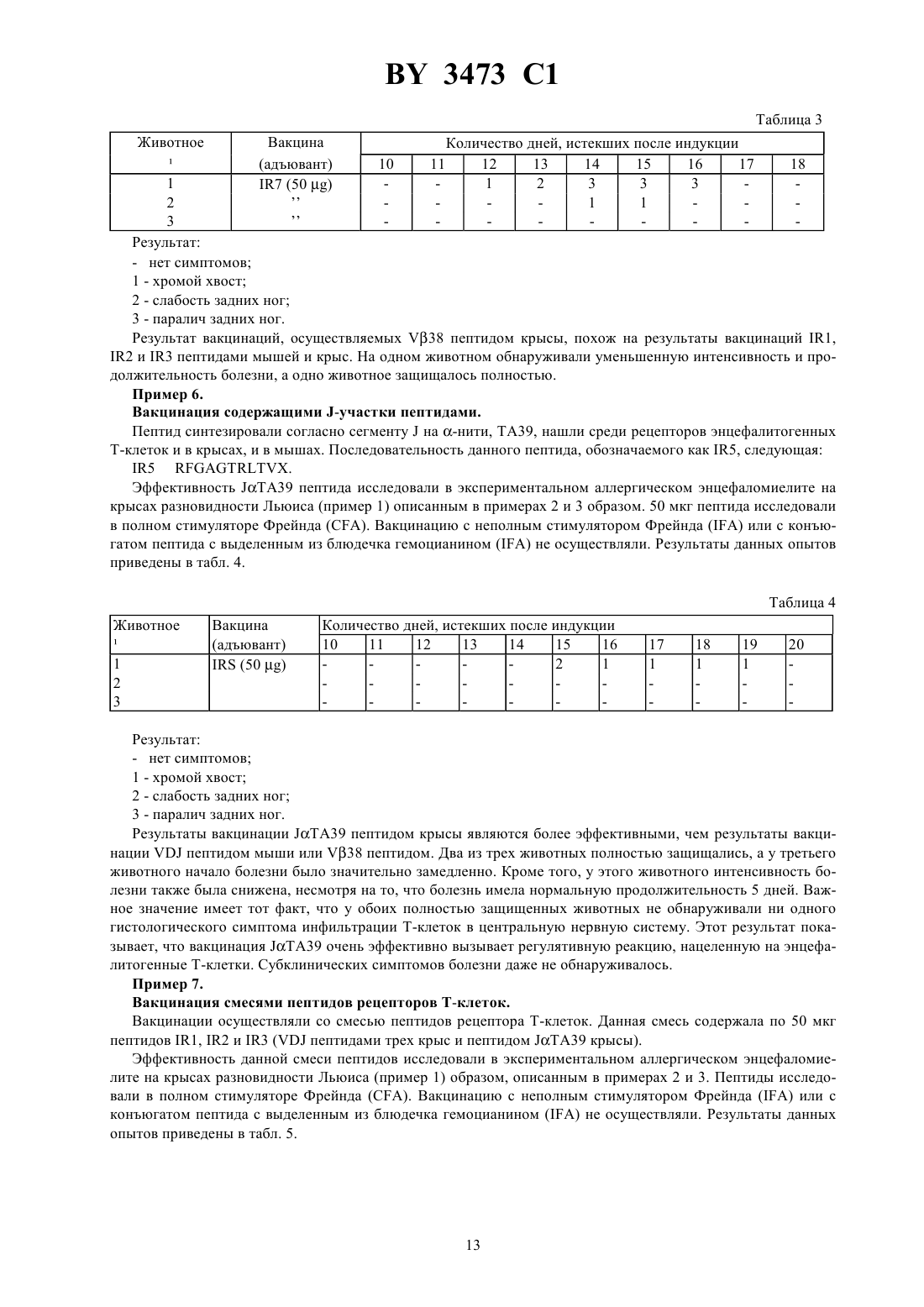
ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ОПОСРЕДОВАННОЙ Т-КЛЕТКАМИ ПАТОЛОГИИ ИЛИ НЕРЕГУЛИРУЕМОЙ РЕПЛИКАЦИИ КЛОНАМИ Т-КЛЕТОК,СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ, СПОСОБ ДИАГНОСТИКИ ИЛИ ПРОГНОЗИРОВАНИЯ ВОСПРИИМЧИВОСТИ К РЕВМАТОИДНОМУ АРТРИТУ ИЛИ РАССЕЯННОМУ СКЛЕРОЗУ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА ИЛИ РАССЕЯННОГО СКЛЕРОЗА И СОДЕРЖАЩИЙ ПОСЛЕДОВАТЕЛЬНОСТЬПЕПТИД, ЯВЛЯЮЩИЙСЯ АГЕНТОМ ДЛЯ ОБНАРУЖЕНИЯ, ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА(71) Заявитель Дзе Иммюн Риспонз Корпорейшен(73) Патентообладатель Дзе Иммюн Риспонз Корпорейшен(57) 1. Вакцина для профилактики или лечения опосредованной Т-клетками патологии или нерегулируемой репликации клонами Т-клеток у млекопитающих, содержащая активное вещество и фармацевтически переносимую среду, отличающаяся тем, что в качестве активного вещества она содержит рецептор Т-клеток или его фрагмент, соответствующий рецептору Т-клеток, находящемуся на поверхности опосредующих данную патологию, или анти-идиотипические антитела, являющиеся внутренним изображением данного рецептора или его фрагмента, причем активное вещество взято в иммуногенно эффективном количестве. 2. Вакцина по п. 1, отличающаяся тем, что в том случае, если опосредованная Т-клетками патология является ревматоидным артритом, упомянутый рецептор Т-клеток содержит последовательность аминокислот-, ее модификации, не затрагивающие способность рецептора к действию в качестве иммуногена, и иммуногенно активные фрагменты. 3. Вакцина по . 1, отличающаяся тем, что упомянутый фрагмент содержит последовательность вариабельного участка упомянутого рецептора Т-клетки. 4. Вакцина по п. 3, отличающаяся тем, что упомянутая последовательность вариабельного участка представляет собой вариабельный участок -нити. 5. Вакцина по п. 4, отличающаяся тем, что в том случае, если опосредованная Т-клетками патология является ревматоидным артритом, упомянутый вариабельный участок -нити содержит в основном последовательность аминокислот, ее модификации, не затрагивающие способность рецептора к действию в качестве иммуногена, и иммуногенно активные фрагменты. 6. Вакцина по п. 5, отличающаяся тем, что упомянутый вариабельный участок -нити содержит в основном последовательность . 7. Вакцина по . 1, отличающаяся тем, что упомянутый фрагмент содержит последовательность . 8. Вакцина по . 1, отличающаяся тем, что упомянутый фрагмент содержит последовательность связывающего участка. 9. Вакцина по . 1, отличающаяся тем, что она дополнительно содержит адъювант. 10. Вакцина по . 1, отличающаяся тем, что она содержит более одного типа рецептора Т-клеток или его фрагмента. 3473 1 11. Вакцина по . 1, отличающаяся тем, что она содержит более одного фрагмента, соответствующего разным последовательностям одного и того же рецептора Т-клеток. 12. Вакцина по . 1, отличающаяся тем, что упомянутый фрагмент конъюгирован с носителем. 13. Вакцина по . 1, отличающаяся тем, что в том случае, если опосредованная Т-клетками патология является рассеянным склерозом, а млекопитающее представляет собой человека, упомянутый фрагмент содержит последовательностьдля стимуляции иммунной реакции против рецепторов Т-клеток,имеющих в основном последовательность . 14. Вакцина по п. 1, отличающаяся тем, что упомянутый рецептор Т-клеток содержит последовательность . 15. Способ получения вакцины для лечения опосредованной Т-клетками патологии, отличающийся тем,что он включает получение клонов Т-клеток, вызывающих данное состояние, определение последовательности аминокислот рецепторов Т-клеток клонов Т-клеток, связанных с данным состоянием, отбор сегментов данных рецепторов Т-клеток, характерных для упомянутых рецепторов Т-клеток, а не для рецепторов Тклеток, не связанных с данным состоянием, и отбор из упомянутых последовательностей тех последовательностей, которые способны к индукции иммуногенной реакции относительно упомянутого рецептора Тклеток, и получаемое таким образом активное вещество соединяют с фармацевтически переносимой средой. 16. Способ диагностики или прогнозирования восприимчивости индивидуума к ревматоидному артриту или рассеянному склерозу, отличающийся тем, что он включает обнаружение Т-клеток, содержащих вариабельный участок -нити с последовательностью , или его фрагмент в пробе индивидуума, причем аномальная экспрессия Т-клеток, содержащих такой участок, указывает на ревматоидный артрит или восприимчивость к ревматоидному артриту,или детекторные Т-клетки, имеющие в основном последовательностьв пробе индивидуума,причем наличие таких Т-клеток указывает на рассеянный склероз или восприимчивость к рассеянному склерозу. 17. Способ по п. 16, отличающийся тем, что он включает обнаружение части упомянутого вариабельного участка -нити, в основном не имеющейся в рецепторах Т-клеток, не связанных с ревматоидным артритом. 18. Способ по п. 16, отличающийся тем, что упомянутая проба взята из синовиальной ткани. 19. Способ по п. 16, отличающийся тем, что упомянутый вариабельный участок -нити или упомянутую последовательность обнаруживают путем приведения в контакт с детекторным лигандом. 20. Способ по п. 16, отличающийся тем, что наличие упомянутого вариабельного участка -нити или упомянутой последовательности устанавливают с помощью нуклеотидной пробы комплиментарной с нуклеотидной последовательностью, кодирующей упомянутый участок или упомянутую последовательность. 21. Способ профилактики или лечения ревматоидного артрита или рассеянного склероза, отличающийся тем, что он включает предотвращение связывания рецептора Т-клеток, содержащего последовательность, или рецептора Т-клеток, содержащего в основном последовательность , с его партнером. 22. Способ по п. 21, отличающийся тем, что упомянутый партнер представляет собой -, вызывающий восприимчивость к ревматоидному артриту. 23. Способ по п. 21, отличающийся тем, что связывание предотвращают путем связывания последовательностис лигандом. 24. Способ по п. 21, отличающийся тем, что связывание предотвращают путем связывания лиганда с партнером упомянутого рецептора Т-клеток. 25. Способ профилактики или лечения ревматоидного артрита или рассеянного склероза в индивидууме,отличающийся тем, что он включает цитотоксическую или цитостатическую обработку Т-клеток, содержащих , или Т-клеток, содержащих в основном последовательность , в индивидууме. 26. Способ по п. 25, отличающийся тем, что Т-клетки, содержащиеили упомянутую последовательность, обрабатывают цитотоксическим или цитостатическим агентом, избирательно связывающимся с данными последовательностями. 27. Способ по п. 26, отличающийся тем, что упомянутый агент является антителом, связанным с веществом из группы, включающей радиоактивные вещества, хемотерапевтические и хемотоксичные вещества. 28. Пептид, содержащий последовательность , являющийся агентом для обнаружения, профилактики или лечения рассеянного склероза. 2 Изобретение относится к иммунологии, в частности к вакцине для профилактики или лечения опосредованной Т-клетками патологии или нерегулируемой репликации клонами Т-клеток у млекопитающих, способу выделения вакцины, способу диагностики или прогнозирования восприимчивости индивидуума к ревматоидному артриту или рассеянному склерозу, способу профилактики или лечения ревматоидного артрита или рассеянного склероза и содержащему последовательностьпептиду, являющемуся агентом для обнаружения, профилактики или лечения рассеянного склероза. Высшие организмы отличаются иммунной системой, защищающей их от инвазии возможно вредных веществ или микроорганизмов. Если вещество, обозначаемое как антиген, проникает в тело и если оно узнается как чужое, то иммунная система вызывает и опосредованную антителами реакцию, и клеточноопосредованную реакцию. Клетки иммунной системы, обозначаемые как В-лимфоциты, или В-клетки, производят антитела, специфически узнающие чужое вещество и связывающиеся с ними. Другие лимфоциты,обозначаемые как Т-лимфоциты, или Т-клетки, и вызывают, и регулируют клеточно-опосредованную реакцию, в конечном счете приводящую к уничтожению антигена. В клеточно-опосредованной реакции участвуют разные виды Т-клеток. Некоторые из них индуцируют определенные клоны В-клеток к пролиферации и производству антител, специфических для соответствующего антигена. Другие узнают и уничтожают клетки, представляющие собой чужие антигены на своей поверхности. Определенные Т-клетки регулируют реакцию или путем стимуляции, или путем супрессии других клеток. Нормальная иммунная система точно регулируется, однако отклонения не редки. В некоторых случаях иммунная система работает неправильно и реагирует на компонент хозяина, как будто он являлся чужим. Такая реакция приводит к аутоиммунной болезни, которая выражается в том, что иммунная система организма атакует ткань хозяина. Т-клетки, являясь основными регуляторами иммунной системы, непосредственно или косвенно вызывают такие аутоиммунные патологии. Предполагают, что многочисленные болезни являются результатом аутоиммунных механизмов. Самые известные из этих болезней - ревматоидный артрит, системная красная волчанка, рассеянный склероз, диабет типа , миастенияи обыкновенная пузырчатка. Миллионы людей во всем мире страдают от аутоиммунных болезней, и связанные с этими болезнями расходы, включающие само лечение и побочные расходы и потери трудовой производительности, составляют миллиарды долларов каждый год. В настоящее время нет средств для эффективного лечения таких аутоиммунных патологий. Обычно можно лечить лишь симптомы, причем сама болезнь прогрессирует, часто приводя к серьезному ослаблению больного или его смерти. В других случаях лимфоциты умножаются чрезмерно и неконтролируемым образом. Такое умножение приводит к раковому состоянию, так называемой лимфоме. В том случае если нерегулируемые лимфоциты являются Т-клетками, то данные опухоли обозначают как лимфомы Т-клеток. Так же, как и другие злокачественные опухоли, и лимфомы Т-клеток эффективно лечить трудно. Таким образом, уже давно нуждаются в эффективном средстве для лечения или уменьшения интенсивности патологий,опосредованных Т-клетками. В идеальном случае такое лечение включало бы скорее контроль неадекватной реакции Т-клеток чем лишь уменьшение интенсивности симптомов. Настоящее изобретение удовлетворяет этому требованию и одновременно имеет дополнительные преимущества. Первым объектом настоящего изобретения является вакцина для профилактики или лечения опосредованной Т-клетками патологии или нерегулируемой репликации клонами Т-клеток млекопитающих, содержащая фармацевтически переносимую среду и активное вещество, представляющее собой рецептор Тклеток или его фрагмент, соответствующий рецептору опосредующих данную патологию Т-клеток, находящемуся на их поверхности, или антиидиотипические антитела, являющиеся внутренним изображением данного рецептора Т-клеток или его упомянутого фрагмента, причем активное вещество взято в иммуногенно эффективном количестве. Под понятием опосредованная Т-клетками патология в данном случае понимается любое состояние, в котором неадекватная реакция Т-клеток является компонентом патологии. Данное понятие здесь охватывает и болезни, непосредственно опосредованные Т-клетками, и болезни, например, миастению , которые прежде всего проявляются в нарушении, вызываемом связыванием антител, а также болезни, вызванные неадекватной реакцией Т-клеток, приводящей к производству таких антител. То есть, данное понятие охватывает и аутоиммунные болезни, опосредованные Т-клетками, и нерегулируемую репликацию клонами Тклеток. 3 3473 1 В нижеследующем оборот в основном последовательность в связи с последовательностью аминокислот следует понимать в смысле или описываемой последовательности, или другой последовательности, в которой добавлены, пропущены или заменены отдельные звенья, причем данные изменения несущественно влияют на способность последовательности вызывать иммунную реакцию против желаемой последовательности рецептора Т-клеток. Таким образом, участок описываемой иммунизирующей последовательности можно использовать всегда, когда он в достаточной степени является характерным для желаемого рецептора Т-клеток, с тем, чтобы вызывать эффективную иммунную реакцию против желаемых рецепторов Т-клеток, а не против нежелаемых рецепторов Т-клеток. Таких вариаций последовательности можно достичь простыми методами, например, путем синтеза другой последовательности, и их эффективность можно проверять, например, путем иммунизации млекопитающих. Понятие фрагмент в нижеследующем охватывает фрагменты в сочетании с дополнительными последовательностями или частями, в которых, например, пептид связан с другими последовательностями аминокислот или с носителем, или фрагменты, связанные с ними. Понятия фрагмент и пептид поэтому могут быть использованы в данном тексте как взаимозаменимые понятия, так как пептид будет являться самым распространенным фрагментом рецептора Т-клеток. Каждый фрагмент, согласно изобретению, может иметь измененную последовательность, как описано выше в разделе в основном последовательность. Когда в нижеследующем речь идет о фрагменте или участке рецептора Т-клеток, тогда это не означает,что они должны быть производными неповрежденных рецепторов Т-клеток. Такие фрагменты или участки можно производить с помощью разных известных методов, например путем ручного или автоматического синтеза пептида или путем клонирования. В нижеследующем в связи с отношением между фрагментом предлагаемого пептида и последовательностями рецепторов Т-клеток слово соответствующий означает, что фрагмент пептида имеет последовательность аминокислот, которая в достаточной степени гомологична последовательности рецептора Т-клеток, с тем, чтобы возбуждать регулирующую реакцию в индивидууме. Однако последовательности не обязательно тождественны с последовательностью рецептора Т-клеток, как видно в примерах 2 и 3. Под словами иммуногенно эффективный здесь понимается количество рецептора Т-клеток или его фрагмента, которое эффективно вызывает иммунную реакцию для профилактики или лечения опосредованной Т-клетками патологии или нерегулируемой репликации клонами Т-клеток в индивидууме. Само собой разумеется, что такое количество может колебаться в зависимости от существа и индивидуума и многих других факторов. Например, в общем для эффективной иммунной реакции у человека необходима большая доза,чем для мыши. В случае использования вакцины в жидком состоянии концентрация активного вещества составляет примерно 1 мкг-100 мг на мл. В случае использования предлагаемой вакцины в твердом состоянии активное вещество берут в соответствующей концентрации. В нижеследующем под 17 понимается определенный вариабельный участок -цепи рецептора Тклеток. 17 имеет следующую последовательность аминокислот . Гипервариабельные и связывающие участки являются наиболее полезными для вакцин. Один из гипервариабельных участков 17, а именно участок 2, имеющий последовательность аминокислот , является особенно полезным. Модификации данной последовательности,не затрагивающие способность рецептора к действию в качестве иммуногена, вызывая желаемую иммунную реакцию, также охватываются данным термином. Вариабельный участок может быть связан с любым - или- рецептора Т-клеток. Кроме того, иммуногенно действующие фрагменты 17 также охватываются определением 17. В нижеследующем под партнером (для связывания) понимается состав, способный к взаимодействию с рецептором Т-клеток. В общем данный состав представляет собой главный антиген тканевой совместимости(МНС), но он может быть любым составом, при обычном связывании рецептора Т-клеток приводящим к активации или пролиферации Т-клеток. Под понятием лиганд в нижеследующем понимается любая молекула, которая реагирует с другими молекулами с образованием комплекса. Слова избирательно связывается с в нижеследующем следует понимать так, что молекула связывается с одним видом молекул, но в основном не с другими. В отношении 17 избирательно связывается с включает связывание с рецепторами Т-клеток, содержащими 17, но в основном не с рецепторами Т-клеток, не содержащими 17. Иммунная система является главной биологической защитой хозяина (собственного организма) от возможно вредных (чужих) агентов. Такими вредными агентами могут быть, например, патогенные факторы,такие, как бактерии или вирусы, а также модифицированные собственные клетки, включая инфицированные вирусами клетки, опухолевые клетки и другие аномальные клетки хозяина. Все эти цели иммунной системы 4 3473 1 обобщенно называют антигенами. При узнавании антигена иммунной системой сразу же включается иммунный механизм для уничтожения антигена, защищая таким образом здоровье хозяина. Главными типами специфической для определенного антигена иммунной реакции являются гуморальный(опосредованный антителами) и клеточный (клеточно-опосредованный) иммунитет. Каждый из этих иммуннологических механизмов пускается активацией вспомогательными (4) Т-клетками. Данные 4 Тклетки стимулируют Б-клетки, способные к синтезу антител путм связывания антигенов, в результате чего они пролиферируют и секретируют антитела. Секретированные антитела связываются с антигенами и облегчают их уничтожение путем других иммунных механизмов. Подобным образом 4 Т-клетки отдают стимулирующие сигналы цитотоксическим (8) Т-клеткам, которые узнают и уничтожают соответствующие клетки (например, инфицированные вирусами клетки хозяина). Таким образом, активация 4 Тклеток является решающим фактором при стимуляции иммунной реакции. Поэтому ознакомление с механизмами, приводящими к специфической для определенного антигена активации 4 Т-клеток, важно при любой попытке избирательной модификации иммунологического действия. Специфичность Т-клеток относительно определенных антигенов обеспечивается рецептором Т-клеток,выраженным на поверхности клетки. Рецептор Т-клеток является гетеродимерным гликопротеином, состоящим из двух полипептидных нитей, каждая из которых имеет молекулярный вес примерно 45 пар оснований(п.о.). Известны две формы рецепторов Т-клеток. Одна состоит из альфа-нити и бета-нити, а другая - из гамма-нити и дельта-нити. Каждая из данных полипептидных нитей рецепторов Т-клеток кодирована определенным генетическим локусом, содержащим сложные прерывистые сегменты генов, представляющие собой,например, вариабельные (В), связывающиеили неменяющиеся (С) участки. Бета- и дельта-нити содержат дополнительный элемент, обозначаемый как диверзиционныйсегмент. (Так как диверзиционные сегментыи элементы содержатся лишь в некоторых генетических локусах рецепторов Т-клеток и полипептидах, в нижеследующем они приведены в скобках с тем, чтобы показать, что данные участки имеются лишь в соответствующих нитях рецепторов Т-клеток. Таким образом,относится или к последовательностинитей, имеющих -, или к последовательности , в которых не имеется -). Во время мейоза лимфоцитов отдельные -, (-) и -сегменты перегруппируются и формируют функциональный ген, определяющий последовательность аминокислот рецептора Т-клеток, выраженного данной клеткой. Так как запас -, (-) и -, который может перегруппироваться, содержит много членов и благодаря тому, что отдельные элементы данного запаса могут перегруппироваться с любой комбинацией, общий запас рецепторов Т-клеток является в высокой степени диверзиционным и способным к связыванию бесчисленных партнеров, которые могут наступать на организм. Однако каждая отдельная Т-клетка имеет лишь одну молекулу Т-рецептора, которая в основном, если не полностью, предопределяет специфичность данной Т-клетки относительно его партнера. Модели на животных значительно способствовали пониманию иммунологических механизмов аутоиммунных болезней. Одной моделью является экспериментальный аллергический энцефаломиелит (ЕАЕ),представляющий собой аутоиммунную болезнь центральной нервной системы, которую можно вызывать в мышах и крысах путем иммунизации с основным протеином миелина (МВР). Характеристика упомянутой болезни следующая клинически - паралич и легкая гипотрофия, а гистологически - периваскулярная мононуклеарная инфильтрация клеток паренхимы центральной нервной системы. Патогенез болезни опосредуется Т-клетками, специфическими в отношении основного протеина миелина. Разнообразные клоны специфических в отношении основного протеина миелина Т-клеток выделяли из животных, страдающих от экспериментального аллергического энцефаломиелита, и их амплифицировали путем последовательной культивации. После стимуляцииосновным протеином миелина данные Т-клетки сразу же вызывают экспериментальный аллергический энцефаломиелит, когда их адаптивно переносят здоровому хозяину. Важно при этом, что данные вызывающие экспериментальный аллергический энцефаломиелит Т-клетки специфические не только в отношении именно этого антигена (основного протеина миелина), но обычно в отношении одного единственного эпитопа на данном антигене. Все это означает, что малые количества аутоагрессивных Т-клеток ответственны за патогенез экспериментального аллергического энцефаломиелита. В результате анализа рецепторов Т-клеток, вызывающих экспериментальный аллергический энцефаломиелит, выявилось, что структура данных связанных с болезнью рецепторов имеет уменьшенную разнородность. В ходе анализа, в котором исследовали 33 взаимодействующие с основным протеином миелина Тклетки, обнаружили лишь два содержащих вариабельные участки сегмента альфа-нитей и один единственный сегмент альфа-нити, содержащий связывающий участок. В этой совокупности Т-клеток также обнаружили одинаково ограниченное использование генов рецепторов Т-клеток в бета-нитях. Имелись лишь два содержащих вариабельные участки сегмента бета-нитей и два сегмента, содержащих связывающие участки. Еще важнее, примерно 80 клонов Т-клеток на участках бета-нити имели идентичные последовательности аминокислот. Эти результаты подтверждают, что рецепторы Т-клеток с похожей специфичностью относительно антигенов также имеют одинаковую структуру, и показывают, что рецептор Т-клеток являет 5 3473 1 ся подходящей целью для иммунотерапевтических стратегий при борьбе с патогенезом экспериментального аллергического энцефаломиелита. Разнообразными методами пытались использовать специфичность аутоагрессивных Т-клеток относительно антигенов для выработки стратегий для лечения экспериментального аллергического энцефаломиелита. Например, использовали пассивное введение моноклональных антител, специфических для рецепторов, имеющихся на поверхности вызывающих экспериментальный аллергический энцефаломиелит Т-клеток. В случае мышиной модели экспериментального аллергического энцефаломиелита в результате инфузии моноклонального антитела, специфического для 8, представляющего собой больший вариабельный участок бета-нити, использованный в специфических относительно основного протеина миелина Т-клетках, восприимчивость мышей к последующей индукции экспериментального аллергического энцефаломиелита снизилась (Аха-Орбеа и др. ,54, стр. 263-273, 1988 г. и Урбан и др., ,54, стр. 577-592, 1988 г.). Подобная защита достигалась в случае экспериментального аллергического энцефаломиелита у крыс с помощью моноклонального антитела, способного к взаимодействию с неидентифицированной идиотипической детерминантой рецептора Т-клеток на специфических относительно основного протеина миелина Тклетках (Бэрнс и др., . . .,169, стр. 27-39, 1989 г.). Хотя терапия пассивными антителами, по всей видимости, положительно сказывается на восприимчивость к экспериментальному аллергическому энцефаломиелиту, она связана с потенциальными проблемами. Достигаемая защита исчезает, в связи с чем требуется повторное введение антитела. При многократной инфузии антител, однако, повышается вероятность того,что хозяин разовьет иммунную реакцию против подаваемых антител, в частности когда их получили в ксеногенном животном. Кроме того, реакция антител на патогенный клон Т-клеток представляет собой лишь одно из звеньев всей иммунной реакции и пренебрегает возможную роль клеточного иммунитета при преодолении аутореактивности. Роль клеточного иммунитета при снижении активности аутоагрессивных Т-клеток при экспериментальном аллергическом энцефаломиелите явилась предметом исследований, и предложены возможные терапии. Подобно методу пассивных антителполучили регулирующие Т-клетки, которые затем вновь ввели хозяину в рамках иммунотерапии. Например, недавно выделили клон 8 Т-клеток из выздоравливающих крыс, у которых путем адоптивного переноса специфической относительно основного протеина миелина линии 4 Т-клетки вызвали экспериментальный аллергический энцефаломиелит (Сан и др., ,332,стр. 843-845, 1988 г.). Данный клон 8 Т-клеткипроявил цитолитическую активность в отношении содержащей 4 Т-клетки, использованной для индукции болезни. Кроме того, адоптивный перенос данного клонаснизил восприимчивость соответствующих крыс при последующей подаче основного протеина миелина. Лидер и др. (,239, стр. 181-183, 1988 г.) также выделили клоны 8 Тклеток, обладающие супрессивной активностью относительно вызывающих экспериментальный аллергический энцефаломиелит Т-клеток. Данный клон 8 Т-клеток выделили из крыс, вакцинированных аттенуированными клонами Т-клеток, вызывающих болезнь, и, хотя он не проявлял цитолитической активности, он был способен к супрессии зависимой от основного протеина миелина пролиферации Т-клеток,вызывающих экспериментальный аллергический энцефаломиелит. Хотя данные анализы показывают, что содержащие 8 Т-клетки способны к сдерживанию экспериментального аллергического энцефаломиелита, все-таки невероятно, что данные определенные 8 будут играть важную роль для долгосрочной резистентности выздоровевших крыс, так как Седжвик и др. (. . ,18, стр. 495-502) ясно показали, что удаление содержащих 8 клеток с моноклональными антителами не влияет на протекание болезни или выздоровление. В вышеописанных опытах Сана и др. и Лидера и др. введение регулирующих Т-клеток приводит к преодолению важной проблемы пассивной терапии антителами, так как она позволяет достичь долгосрочной регулирующей реакции. Однако она требует культивациис использованием аттенуированных Т-клеток, вызывающих болезнь, с тем, чтобы развивать клоны таких регулирующих Т-клеток, что представляет собой дорогостоящий и трудоемкий процесс. Кроме того, в случае введения человеку из-за неидентичности главного антигена тканевой совместимости это требует в высокой степени индивидуализированной терапевтической стратегии, так как для каждого отдельного больного необходимо получение регулирующих клонов, которые затем дают исключительно этому больному с тем, чтобы исключить возможную реакцию трансплантат против хозяина. Непосредственную вакцинацию аттенуированными клонами Т-клеток, вызывающих болезнь, использовали для терапии экспериментального аллергического энцефаломиелита. Т-клетки, специфические относительно основного протеина миелина и способные к передаче болезни, аттенуировали путем облучения гамма-лучами или химическойфиксации и затем их использовали для вакцинации неинфицированных крыс. В некоторых случаях вакцинированные животные развивали резистентность относительно последующих попыток вызвать у них экспериментальный аллергический энцефаломиелит (Лидер и др., см. выше, а также у Кохена и Вайнера, -. ,9, стр. 332-335, 1988 г.). Однако эффективность такой вакцинации изменчивая, и степень защиты также значительно колеблется. Т-клетки содержат много разнообразных ан 6 3473 1 тигенов, которые вызывают иммунную реакцию, когда целую Т-клетку применяют в качестве вакцины. Это показали Оффнер и др. (. -.,21, стр. 13-22, 1989 г.), которые доказали, что иммунизация применением целой Т-клетки способствует аллергической реакции замедленного типа, определяемой на отек уха, на данные Т-клетки, который возрастает с увеличением числа вакцинаций. Однако четкие аллергические реакции замедленного типа определяли и у защищенных, и у незащищенных животных. Крысы показывали похожую реакцию при вакцинации вызывающих энцефалит Т-клеток и контрольных Т-клеток. И наоборот, вакцинация специфическими относительно очищенного деривата протеина Т-клетками из специфической относительно очищенного деривата протеина линии вызвала аллергическую реакцию замедленного типа и на клетки вакцины, и на вызывающий энцефалит клон, хотя не обнаруживалось никакой защиты. Похожая реакция вакцинированных крыс на вызывающие болезнь клетки и на контрольные клетки, определяемая на аллергической реакции замедленного типа (которая является мерой для клеточно-опосредованного иммунитета) указывает на то, что многочисленные антигены данных Т-клеток вызывают иммунную реакцию. Таким образом, недостатками вакцинации аттенуированными Т-клетками, вызывающими болезнь, является недостаточная специфичность относительно защитного антигена на поверхности данной Т-клетки, а также непостоянные результаты относительно иммунитета против данного антигена. Что касается применения данного метода для лечения людей, то он является таким же трудоемким, как и вышеописанная инфузия 8 клеток, и так же, как и последний, данный метод требует индивидуализированной терапии. Настоящее изобретение предлагает эффективный способ иммунотерапии патологий, опосредованных Тклетками, включая аутоиммунные болезни, не связанный с теми проблемами, с которыми связаны вышеописанные известные методы лечения. Путем вакцинации, а не путем пассивного введения гетерологических антител мобилизуется собственная иммунная система хозяина к супрессии аутоагрессивных Т-клеток. Таким образом, супрессия является постоянной и может охватывать любые и все иммунологические механизмы,приводящие к этой супрессии. Такая многосторонняя реакция является более эффективной, чем односторонняя супрессия, достигаемая путем пассивного применения моноклональных антител или клонов регулирующих Т-клеток. Так как предлагаемые вакцины служат для борьбы с аутоиммунными болезнями, они содержат рецепторы Т-клеток, опосредующих аутоиммунные болезни. Вакцины могут являться или целыми рецепторами Тклеток, в основном очищенными от клонов Т-клеток, или отдельными нитями рецепторов Т-клеток (например, альфа-, бета-, гамма-нитями), или частями таких нитей, или отдельно или в сочетании друг с другом. Вакцина может быть или гомогенной, например, включать лишь один пептид, или содержать более одного типа пептида, причем каждый пептид относится к разной части рецептора. Кроме того, данные пептиды могут происходить от разных рецепторов, когда оба рецептора способствуют к опосредованной Т-клетками патологии. Согласно особенной форме выполнения изобретения, иммунизирующий пептид может иметь последовательность аминокислот , если он призван служить для лечения рассеянного склероза. Любая иммуногенная часть данного пептида может быть эффективной. Таким образом, возможна замена аминокислот без потери иммуногенности пептида. Кроме того, данный пептид может быть связанным с носителем с тем, чтобы дальше повышать его иммуногенность. Согласно дальнейшему развитию изобретения, для иммунизации человека, страдающего от ревматоидного артрита, можно использовать рецепторы Т-клеток или фрагменты рецепторов, содержащие 17, для лечения или профилактики данной болезни. Вызываемая в человеке иммунная реакция может обезвреживать или уничтожать Т-клетки, имеющие 17, и таким образом предотвращать или лечить их вредное действие. Кроме того, в той степени, в которой 17 имеется также в рецепторах на патогенных Т-клетках, опосредующих аутоиммунные болезни в общем, предлагаемые вакцины можно использовать и для борьбы с такими другими аутоиммунными болезнями. Слова в основном чистый означают, что рецептор Т-клеток в основном свободен от других биохимических компонентов, с которыми он обычно связан в природе. Альтернативно вакцины содержат пептиды разной длины, соответствующей рецептору Т-клеток или его частям. Пептиды можно получать или путем синтеза, или путем рекомбинации с помощью известных для специалиста методов. Предпочтительно пептидные вакцины соответствуют участкам рецепторов Т-клеток, которыми данный рецептор отличается от других непатогенных рецепторов. Такие специфические участки могут находиться на отдельных(ом) участках(е) соответствующих полипептидных нитей рецептора, в частности на небольшой последовательности, включающей -часток, ограничивая таким образом иммунную реакцию на Т-клетки, содержащие данную детерминанту. Вакцины вводят в том случае, если хозяин показывает аутоиммунную реакцию или находится в такой опасности. Точный клинический диагноз определенной аутоиммунной болезни оправдывает введение необходимых специфических для данной болезни вакцин, содержащих рецепторы Т-клеток. Профилактическое введение оправдано там, где аутоиммунные механизмы предшествуют началу открытой клинической болезни (например, диабета типа ). Таким образом, данные вакцины можно до начала болезни профилактически 7 3473 1 применять у людей, у которых в семейном анамнезе имеется соответствующая болезнь и которые, судя по надежным показателям, находятся в опасности заболевания. Содержащие рецепторы Т-клеток вакцины можно применять с многими возможными составами, с фармацевтически переносимой средой. В случае короткого пептида последний может быть связан с носителем,например, выделенным из блюдечка гемоцианином, с тем, чтобы повысить его иммуногенность. Вакцину можно давать в сочетании с адъювантом (имеется несколько известных адъювантов). После начальной иммунизации вакциной можно подавать усилитель. Вакцины амплицируют известными методами в дозах, которые достаточны для индукции иммунной реакции и легко могут быть определены любым специалистом. Пригодные для иммунизации пептиды можно находить следующим образом. Клоны вызывающих болезнь Т-клеток, взаимодействующие с антигенами, с которыми хотят бороться, выделяют из зараженных индивидуумов. Такие Т-клетки получают предпочтительно в месте, где проявляется сильная аутоагрессивная активность, то есть, в месте патологического изменения в случае обыкновенной пузырчатки, из центральной нервной системы в случае рассеянного склероза, из синовиальной жидкости или ткани в случае ревматоидного артрита, или же из крови соответствующего зараженного индивидуума. Затем определяют последовательность аминокислот генов рецепторов аутоагрессивных Т-клеток. После этого для вакцин, используемых вышеописанным образом, можно выбирать полипептиды, соответствующие рецепторам Т-клеток или частям рецепторов, имеющимся, в частности, в вызывающих болезнь Т-клетках (по сравнению с непатогенными Тклетками). Вместо этого вакцина может содержать антиидиотипические антитела, являющиеся внутренними изображениями вышеописанных пептидов. Методы получения, отбора и применения таких антиидиотипических вакцин известны (например, Айхманн и др.,в ,7, стр. 193-227, 1987 г.). Опосредованные Т-клетками патологии со злокачественной этиологией. Полезность вакцинации рецепторами Т-клеток выше пояснялась на примере аутоиммунных болезней. Кроме того, и вызванная Т-клетками лимфома является патологией, поддающейся такому лечению. Применение данной технологии при лечении Т-лимфомы можно осуществлять в основном идентичным методом. Однако данная технология применяется скорее при Т-клеточной пролиферативной болезни, так как легче осуществлять выделение патогенных Т-клеток. После выделения клонов технологию осуществляют нижеописанным образом. В частности, определяют последовательность аминокислот генов рецепторов Т-клеток Т-лимфом и определяют подходящие участки данных рецепторов, которые используют в качестве вакцин. Вакцины могут содержать или простые, или сложные пептиды, и их можно применять известным образом в фармакологически переносимом составе с адъювантом или без него. Рассеянный склероз. Вызывающие рассеянный склероз Т-клетки до сих пор еще не идентифицировали, хотя из-за клинических и гистологических сходств рассеянного склероза и экспериментального аллергического энцефаломиелита предполагали, чтоТ-клетки, взаимодействующие с основным протеином миелина, при этом играют некоторую роль. При экспериментальном аллергическом энцефаломиелите на крысах и мышах энцефалогенные Тклетки, взаимодействующие с основным протеином миелина, показывают поразительное сохранение последовательности аминокислот на - -нити, несмотря на известные различия по рестрикции главного антигена тканевой совместимости и антигенной специфичности основного протеина миелина. Настоящее изобретение основывается на обнаружении того, что линия Т-клетки человека, взаимодействующая с основным протеином миелина и полученная от больного рассеянным склерозом, имеет -нить рецептора Т-клеток с -последовательностью аминокислот, соответствующей последовательности на -нитях Т-клеток, взаимодействующих с основным протеином миелина и вызывающих патогенез у экспериментального аллергического энцефаломиелита, представляющего собой модель рассеянного склероза у животных. Данная линия является специфической для другого эпитопа основного протеина миелина. Это открытие показывает, что взаимодействующие с основным протеином миелина Т-клетки участвуют в патогенезе рассеянного склероза и что рецепторные пептиды, подобные описанным для профилактики экспериментального аллергического энцефаломиелита, можно использовать для лечения рассеянного склероза. Ревматоидный артрит. Ревматоидный артрит является аутоиммунной болезнью, опосредованной Т-клетками. Изобретение описывает олигоклональные инфильтраты активированных Т-клеток, содержащих 17, в синовиальном слое больных ревматоидным артритом. Наличие данных Т-клеток в больной ткани всех осмотренных больных, их олигоклональность и цитотоксическая активность одной из этих Т-клеток для синовиальных присоединенных клеток показывает центральную роль содержащих 17 Т-клеток в патогенезе ревматоидного артрита. Активированные популяции Т-клеток в синовиальной ткани больных ревматоидным артритом исследовали путем анализа мРНК рецепторов Т-клеток, выделенных из синовиальных Т-клеток, положительных относительно рецептора -2 (-2). мРНК рецепторов Т-клеток амплифицировали известным образом путем цепной реакции с помощью полимеразы . В этом анализе выявилось, что олигоклональные 17 8 3473 1 перегруппировки обогащены в популяции 2-, что указывает на вероятность участия содержащих 17 Т-клеток в патогенезе ревматоидного артрита. Из пробы синовиальной ткани выделяли клон Т-клетки, содержащий 4, 17, и тот факт, что он обладает цитотоксичностьюотносительно синовиальных присоединенных клеток, подтверждает непосредственное участие содержащих 17 Т-клеток в ревматоидном артрите. Как уже указывалось, настоящее изобретение содержит чрезвычайно важное открытие, заключающееся в том, что специфический вариабельный участок -нити рецептора Т-клеток, обозначаемый как 17, тесно связан с ревматоидным артритом у человека. Данное открытие делает возможными обнаружение, профилактику и лечение ревматоидного артрита с использованием описанного в данном изобретении способа. Это дает возможность специалисту применять в отношении ревматоидного артрита терапевтические методы, подобные описанным выше, в связи с экспериментальным аллергическим энцефаломиелитом. Таким образом, вторым объектом изобретения является способ диагностики или прогнозирования восприимчивости к ревматоидному артриту или рассеянному склерозу индивидуума. В случае ревматоидного артрита способ включает обнаружение Т-клеток, содержащих обозначаемый как 17 вариабельный участок -нити в пробе индивидуума, причем наличие аномального количества содержащих 17 Т-клеток указывает на ревматоидный артрит или восприимчивость к ревматоидному артриту. Содержащую 17 Тклетку можно качественно или количественно сравнивать с клеткой нормального индивидуума. Такую диагностику можно осуществлять путем обнаружения части 17, которая не имеется на вариабельном участке-нити рецепторов Т-клеток, не связанных с ревматоидным артритом. 17 можно обнаруживать, например,путем приведения 17 в контакт с детекторным лигандом, способным к специфическому связыванию с 17. Известны многочисленные детекторные лиганды, например, связанное с ферментом антитело. Вместо этого для обнаружения содержащих 17 Т-клеток также можно использовать нуклеотидные пробы, комплементарные с кодирующими 17 последовательностями нуклеиновых кислот (пример 9). В случае диагностики или прогнозирования восприимчивости к рассеянному склерозу предлагаемый способ включает обнаружение в пробе индивидуума Т-клеток, имеющих в основном последовательность, причем наличие данной последовательности указывает на рассеянный склероз или восприимчивость к рассеянному склерозу. Последовательность можно обнаруживать, например, путем приведения в контакт с детекторным лигандом. Известны многочисленные детекторные лиганды, например, связанное с ферментом антитело. Вместо этого для обнаружении Т-клеток также можно использовать нуклеотидные пробы, комплементарные с кодирующей нуклеотидной последовательностью (пример 9). Третьим объектом изобретения является способ профилактики или лечения ревматоидного артрита или рассеянного склероза. В случае ревматоидного артрита способ включает предотвращение связывания содержащей 17 Т-клетки с ее партнером. Согласно одной форме выполнения изобретения, связывание предотвращается путем связывания лиганда с 17. Согласно другой форме выполнения изобретения, связывание предотвращается путем связывания лиганда с партнером 17. Связывание можно предотвращать известными методами, например, путем связывания антитела с 17 или связывающей частью для физического блокирования связывания. Согласно другой возможности выполнения изобретения, профилактику или лечение ревматоидного артрита можно также осуществлять путем цитотоксической или цитостатической обработки содержащих 17 Т-клеток в индивидууме. Согласно одному варианту, содержащие 17 Т-клетки обрабатывают цитотоксическим или цитостатическим агентом, избирательно связывающим 17. Агент может представлять собой радиоактивное или хемотерапевтическое вещество. Такое связывание и пригодные для этой цели агенты широко известны (например, Харлоу, Э. и Лейн, ,, Коульд спринт Харбор Лэборатори, 1988 г.). В случае профилактики или лечения рассеянного склероза способ включает предотвращение связывания содержащей в основном последовательностьТ-клетки с ее партнером. Согласно одной форме выполнения изобретения, связывание предотвращается путем связывания лиганда с последовательностью. Согласно другой форме выполнения изобретения, связывание предотвращается путем связывания лиганда с партнером. Связывание можно предотвращать известными методами, например, путем связывания антитела с последовательностью для физического блокирования связывания. Согласно другой возможности, профилактику или лечение рассеянного склероза можно осуществлять путем цитотоксической или цитостатической обработки содержащих в основном последовательностьТ-клеток в индивидууме. Согласно одному варианту, Т-клетки обрабатывают цитотоксическим или цитостатическим агентом, избирательно связывающим последовательность. Агент может представлять собой радиоактивное или хемотерапевтическое вещество. Четвертым объектом настоящего изобретения является способ выделения вакцины для лечения опосредованной Т-клетками патологии, включающий получение клонов Т-клеток, вызывающих данное состояние,определение последовательности аминокислот рецепторов Т-клеток клонов Т-клеток, связанных с данным 9 3473 1 состоянием, отбора сегментов данных рецепторов Т-клеток, характерных для упомянутых рецепторов Тклеток, а не для рецепторов Т-клеток, не связанных с данным состоянием, и отбора из упомянутых последовательностей тех последовательностей, которые способны к индукции иммуногенной реакции относительно упомянутого рецептора Т-клеток, и получаемое таким образом активное вещество соединяют с фармацевтически переносимой средой. Пятым объектом настоящего изобретения является содержащий последовательностьпептид, являющийся агентом для обнаружения, профилактики или лечения рассеянного склероза. Шестым объектом изобретения является способ согласно пп. 25-27 формулы изобретения. Изобретение поясняется нижеследующими примерами. Пример 1. Экспериментальный аллергический энцефаломиелит на крысах. Крыс-самок разновидности Льюиса (Чарлз Ривер Лабораториз, Ралей-Дэрхам, США) иммунизировали введением в заднюю лапу 50 мкм основного протеина миелина морской свинки в виде эмульсии в полном стимуляторе Фрейнда. Первые симптомы болезни обычно обнаруживали за 9-11 дней после иммунизации. Степень болезни оценивали с помощью шкалы с тремя разделами 1 - хромой хвост, 2 - слабость задних ног,3 - паралич задних ног. После продолжительности болезни примерно 4-6 дней большинство крыс спонтанно выздоравливало и было резистентным к последующему вызыванию экспериментального аллергического энцефаломиелита. Пример 2. Выделение вакцины. Вакцинации осуществляли пептидом рецептора Т-клеток, последовательность которого вывелииз последовательности ДНК бета-гена рецептора Т-клеток, преобладающего среди вызывающих экспериментальный аллергический энцефаломиелит Т-клеток мышей разновидности 10./. Последовательность ДНК соответствует указаниям Урбана и др. (см. выше). Пептид, содержащий девять аминокислот и имеющий последовательность-нити рецептора Т-клеток из мыши, синтезировали известным методом. Последовательность данного пептида следующая . Соответствующая последовательность в крысах гласит - (Бэрнс и др., . . .,169, стр. 27-39, 1989 г.). Пептид обессоливали путем колоночной хроматографии на колонне на Сефадекс Г-25 (Фармасия Фаин Кемикэлс, Пискатавей, Нью Джерси,США) с использованием в качестве элюента 0,1 М уксусной кислоты, и растворитель затем удаляли лиофилизацией в двух циклах. Часть пептида с помощью глутаральдегида конъюгировали с выделенным из блюдечка гемоцианиномв соотношении 7,5 мг пептида на мг гемоцианина. Конъюгат подвергали диализу с применением солевого фосфатного буфера (РВС). Пример 3. Вакцинация против экспериментального аллергического энцефаломиелита. Используемые в данных опытах вакцины состоят из свободного пептида с -участком, а также из пептида с -, конъюгированного с выделенным из блюдечка гемоцианином. Их разбавляли в солевом фосфатном буфере и эмульгировали равными частями или (1) неполного стимулятора Фрейнда, или (2) полного стимулятора Фрейнда, полученного путем суспендирования 10 мг/мл убитых термообработкой высушенныхН 37 га (Дифко Лабораториз, Дитройт, США) в неполном стимуляторе Фрейнда. Эмульсии вводили крысам-самкам разновидности Льюиса возрастом 8-12 недель в общем количестве 100 мкл на животное (50 мкл в заднюю лапу). Каждой крысе ввели 5 мкг неконъюгированногопептида. Конъюгат выделенного из блюдечка гемоцианина идали в количестве, соответствующем 10 мкг выделенного из блюдечка гемоцианина на животное. Через 29 дней после этого каждой крысе ввели 50 мкг основного протеина миелина морской свинки в полном стимуляторе Фрейнда в передние лапы. Животных наблюдали каждый день, начиная с 9-го дня, чтобы обнаруживать клинические симптомы экспериментального аллергического энцефаломиелита, и их оценивали вышеописанным образом. Результаты опыта приведены в табл. 1. Они показывают не только то, что у вакцинированных животных болезнь выявилась меньше,но и то, что у заболевших животных болезнь протекала менее тяжело и/или ее начало было замедленно. Степени защиты были разными, как и составы вакцин, причем вакцины, содержащие полный стимулятор Фрейнда, показывали наибольшую степень защиты. 3473 1 Таблица 1 Животное Вакцина Количество дней, истекших после индукции- нет симптомов 1 - хромой хвост 2 - слабость задних ног 3 - паралич задних ног. Пример 4. Вакцинация против экспериментального аллергического энцефаломиелита спептидами, полученными из крыс разновидности Льюиса.пептид, используемый в предыдущих примерах, синтезировали согласно последовательности молекул в -цепи рецептора Т-клеток, найденной в вызывающих экспериментальный аллергический энцефаломиелит Т-клетках мышей разновидности В 10 Данныепоследовательности являются гомологичными, а неидентичными с последовательностями, найденными в Т-клетках мышей разновидности В 10 Пептиды крыс синтезировали согласно последовательностям ДНК, названным Бэрнсом и др. и Клуба и др.(. . .,19, стр. 279-284, 1989 г.). Последовательности данных трех пептидов, обозначаемые как 1, 2 и 3, приведены ниже вместе с последовательностью мыши разновидности В 10., использованной в примерах 1 и 3 .-. Получение, введение и оценку данных вакцин осуществляли описанным в примерах 1-3 образом за следующими исключениями в составе вакцин, содержащих полный стимулятор Фрейнда, использовали 50 мкг отдельныхпептидов не использовали ни вакцины в неполном стимуляторе Фрейнда, ни вакцины,содержащие конъюгированные с выделенным из блюдечка гемоцианидом . Контрольные животные перед подачей основного протеина миелина (МБР) ничего не дали, или их вакцинировали эмульсией солевого фосфатного раствораи полного стимулятора Фрейндас тем, чтобы оценивать защитное действие одного адъюванта. Результаты приведены в нижеследующей табл. 2. 3473 1 Таблица 2 Животное Вакцина Количество дней, истекших после индукции- нет симптомов 1 - хромой хвост 2 - слабость задних ног 3 - паралич задних ног. Приведенные в табл. 2 результаты показывают, что у невакцинированных контрольных животных обнаружили болезнь уже в 10-й день. Болезнь проявилась в тяжелом параличе и ослаблении, продолжалась в течение 4-6 дней и затем спонтанно прекратилась. У крыс, вакцинированных -, болезнь протекала в основном таким же образом, как и у невакцинированных контрольных животных. В отличие от этого у некоторых животных, вакцинированных 1, 2 и 3, обнаруживали замедленное начало, а у других - и замедленное начало, и уменьшенную интенсивность и/или продолжительность болезни. Однако в общем вакцинацияпептидами крыс (1-3) была немного эффективней, чем вакцинацияпептидом мыши(пример 3). Однако вакцинация 9 привела к полной защите у всех четырех животных, на которых его исследовали. Важное значение имеет тот факт, что ни у одного из четырех животных, вакцинированных 9,не обнаруживали ни одного гистологического изменения, характерного для болезни, что указывает на то, что были предотвращены также субклинические симптомы болезни. Пример 5. Вакцинация пептидами, специфическими относительно вариабельного участка. Специфический для семейства 8 генов пептид исследовали в качестве вакцины против экспериментального аллергического энцефаломиелита. 8 является наиболее распространенным семейством -нити, и он используется в энцефалитогенных Т-клетках крыс и мышей. Пептид синтезировали согласно уникальной последовательности ДНК, которую нашли в гене , а не в других генах крысы, последовательности которых приведены у Морриса и др. (,27, стр. 174-179, 1988 г.). Последовательность данного 8 пептида, обозначаемого как 7, следующая 7 К. Эффективность данного пептида исследовали в экспериментальном аллергическом энцефаломиелите на крысах (пример 1) образом, описанным в примерах 2 и 3. 50 мкг пептида исследовали с полным стимулятором Фрейнда . Вакцинации в неполном стимуляторе Фрейнаили конъюгатом пептида с выделенным из блюдечка гемоцианиномне осуществляли. Результаты данных опытов приведены в табл. 3. 3473 1 Таблица 3 Животное Вакцина Количество дней, истекших после индукции- нет симптомов 1 - хромой хвост 2 - слабость задних ног 3 - паралич задних ног. Результат вакцинаций, осуществляемых 38 пептидом крысы, похож на результаты вакцинаций 1,2 и 3 пептидами мышей и крыс. На одном животном обнаруживали уменьшенную интенсивность и продолжительность болезни, а одно животное защищалось полностью. Пример 6. Вакцинация содержащими -участки пептидами. Пептид синтезировали согласно сегментуна -нити, ТА 39, нашли среди рецепторов энцефалитогенных Т-клеток и в крысах, и в мышах. Последовательность данного пептида, обозначаемого как 5, следующая 5 . Эффективность 39 пептида исследовали в экспериментальном аллергическом энцефаломиелите на крысах разновидности Льюиса (пример 1) описанным в примерах 2 и 3 образом. 50 мкг пептида исследовали в полном стимуляторе Фрейнда . Вакцинацию с неполным стимулятором Фрейндаили с конъюгатом пептида с выделенным из блюдечка гемоцианиномне осуществляли. Результаты данных опытов приведены в табл. 4. Таблица 4 Животное Количество дней, истекших после индукции 10 11 12 13 14 15 16 2 1- нет симптомов 1 - хромой хвост 2 - слабость задних ног 3 - паралич задних ног. Результаты вакцинации ТА 39 пептидом крысы являются более эффективными, чем результаты вакцинациипептидом мыши или 38 пептидом. Два из трех животных полностью защищались, а у третьего животного начало болезни было значительно замедленно. Кроме того, у этого животного интенсивность болезни также была снижена, несмотря на то, что болезнь имела нормальную продолжительность 5 дней. Важное значение имеет тот факт, что у обоих полностью защищенных животных не обнаруживали ни одного гистологического симптома инфильтрации Т-клеток в центральную нервную систему. Этот результат показывает, что вакцинация ТА 39 очень эффективно вызывает регулятивную реакцию, нацеленную на энцефалитогенные Т-клетки. Субклинических симптомов болезни даже не обнаруживалось. Пример 7. Вакцинация смесями пептидов рецепторов Т-клеток. Вакцинации осуществляли со смесью пептидов рецептора Т-клеток. Данная смесь содержала по 50 мкг пептидов 1, 2 и 3 ( пептидами трех крыс и пептидом 39 крысы). Эффективность данной смеси пептидов исследовали в экспериментальном аллергическом энцефаломиелите на крысах разновидности Льюиса (пример 1) образом, описанным в примерах 2 и 3. Пептиды исследовали в полном стимуляторе Фрейнда . Вакцинацию с неполным стимулятором Фрейндаили с конъюгатом пептида с выделенным из блюдечка гемоцианиномне осуществляли. Результаты данных опытов приведены в табл. 5. 3473 1 Таблица 5 Животное Вакцина Количество дней, истекших после индукции- нет симптомов 1 - хромой хвост 2 - слабость задних ног 3 - паралич задних ног. Результаты вакцинаций, осуществленных с использованием ТА 39 пептидом крысы и тремяпептидами, являются почти столь эффективными, сколь результаты вакцинации 9, приведенные в таблице 2. Все три животных полностью защищались. Наряду с отсутствием клинических симптомов экспериментального аллергического энцефаломиелита два из трех животных были полностью свободными от гистологических симптомов инфильтрации Т-клеток в центральную нервную систему, причем на третьем наблюдали лишь два маленьких очага лимфоцитарной инфильтрации на основании спинного мозга. Пример 8. Вакцина против рассеянного склероза. Взаимодействующие с основным протеином миелина Т-клетки человека. Линии взаимодействующих с основным протеином миелина Т-клеток человека получили из периферийных одноядерных клеток крови (РВМС) девяти больных хроническим прогрессирующим рассеянным склерозом и двух здоровых контрольных людей. Клетки в течение 3 дней держали в культуре при регулярной стимуляции очищенного основного протеина миелина человека и облученными аутологическими периферийными одноядерными клетками крови, а затем в течение 4 дней в содержащей -2 среде. Амплификация путем цепной реакции с помощью полимеразыгенов -нити рецептора Т-клеток из линий взаимодействующих с основным протеином миелина Т-клеток. Т-клетки выделяли из культур, получаемых после логарифмической фазы роста, и получили РНК, амплифицированную 16 мерным примером и примером С для осуществления 55 циклов согласно примеру 9. Последовательности -нитей рецептора Т-клеток человека, взаимодействующих с основным протеином миелина. С использованием примераопределяли последовательность амплифицированных 16 мером генов -нити рецептора линий Т-клеток человека, взаимодействующих с основным протеином миелина. Продукт амплификации очищали с помощью геля, денатурировали основания и с помощью примераопределяли его последовательности. Из пяти линий получили способные к считыванию последовательности ДНК, которые показывали, что доминирующие клоны Т-клеток получили путем длительного переноса. Одна из данных последовательностей, из клеточной линии(табл. 6), имелапоследовательность аминокислот -нити, в которой пять из первых шести и шесть из девяти в общем остатков идентичны с соответствующими остаткамипоследовательности аминокислот -нити, сохраняемых в энцефалогенных Тклетках, взаимодействующих с основным протеином миелина, в экспериментальном аллергическом энцефаломиелите на мышах разновидности В 10 Данная последовательность не имелась в численно преобладающих перегруппировках рецептора Т-клеток, найденных в остальных четырех линиях Т-клеток человека,взаимодействующих с основным протеином миелина. Для выяснения возможного наличия похожих последовательностей в -нитях линий Т-клеток, взаимодействующих с основным протеином миелина, других больных рассеянным склерозом осуществляли амплификациюс дегенерированным (1024) 21-нуклеотидным примером , соответствующим семи аминокислотам данной последовательности (таблицу 6). Осуществляли обратную транскрипцию РНК,которые 16 мерным примером и примеромамплифицировали реакцией в 20 циклах (стадиия ). 1 мкл аликвотной пробы продукта данных реакций стадииреамплифицировали в 35 циклах примерамии . 1 мкл аликвотной пробы продукта данных реакций исследовали путем гибридизации по Саутерну маркированной 32 Р пробы С человека. Данное исследование показало амплифицированный продукт с 300 п.о. в клеточной линиии в линии другого больного рассеянным склерозом, но не в Т-клетках, взаимодействующих с основным протеином миелина, контрольных индивидуумов или линиях и клонах не взаимодействующих с основным протеином миелина Т-клетках человека. Наличие данной последовательности в двух из девяти исследованных линий клеток больных рассеянным склерозом имеет важное значение. Так как данная последовательность, как известно, сохраняется среди энцефалогенных Т-клеток при экспериментальном аллергическом энцефаломиелите, ее обнаружение в Т-клетках, взаимодействующих с основным протеином 14 3473 1 миелина, больных рассеянным склерозом показывает, что имеющие этот детерминант Т-клетки играют некоторую роль в патогенезе рассеянного склероза. Иммуногенные пептиды, имеющие последовательность , можно получать путем синтеза описанным в примере 2 образом и их можно использовать для иммунизации людей описанным в примере 3 методом. Такая иммунизация может приводить к эффективной иммунной реакции. Таблица 6 Пример 9. Выделение олигоклональных инфильтратов 11 активированных Т-клеток содержащих 7, в си новии больных ревматоидным артритом. Получение Т-клеток из синовиальной ткани. Пробы синовиальной ткани получили от больных, у которых ревматоидный артрит подтверждался радиографией и которых лечили протезированием суставов. С использованием магнитных шариков и антител,взаимодействующих с 2- (2-), человека следующим образом получили активированные Т-клетки. Синовиальную ткань прогревали при температуре 37 С в течение 4 ч в средес 10 сывороткой плода коровы , содержащей 4 мг/мл коллагеназы (Вортингтон Биокемикэл, Фрихольд, Нью Дхерсей,США) и 0,15 мг/мл ДНКазы (Зигма, Ст. Луис, США). Прогретый продукт подали через 80- сито, и отдельные клетки собрали путем центрифугирования в градиенте плотности согласно Фиколлу. Клетки на поверхности раздела промывали и инкубировали в солевом фосфатном буфере , содержащем 2(-), 5 мкг/мл иммуноглобулинаконтрольных мышей (Коултер Иммунолоджи, Хайали, Флорида,США) в концентрации 106/мл при температуре 0 С в течение 30 мин. Клетки три раза промывали и инкубировали с магнитными шариками, конъюгированными с антимышиннымкозы (Адвансд Магнетикс,Кеймбридж, Массачьюсетс, США). Шарики магнитно отделяли и их трижды промывали -. Данный предварительный отбор с помощьюмышии магнитными шариками использовали для контроля неспецифической адсорбции Т-клеток. Оставшиеся в исходной суспензии клетки дополнительно инкубировали с 5 мкг/мл моноклональногомыши, взаимодействующего с 2- Т-клетки человека при температуре 0 в течение 30 мин (Коултер Иммунолоджи, Хайали, Флорида, США). Клетки промывали и отбирали вышеописанным образом с помощью магнитных шариков. Шарики предварительной адсорбциии отобранные антитела 2- сразу же ресуспендировали в подкисленной смеси гуанидина-фенол-хлороформа и РНК, полученной согласно Хонецынски и Саки (. .162, стр. 156, 1987 г). Так как РНК получили без культивирования клетоки возможно вызванного отклонения, они должны точно отражать количество Т-клеток в синовиальной ткани в момент ее оперативного удаления. Лишь половинаи шариков с 2- больного 1012 сразу же обрабатывали для получения РНК. Остальную часть культивировали в среде 1640 с 5, 20-1 (Вентрекс Лабораториз Инк., Портлэнд, США), 25 мМ , глугамином, антибиотиками и, в качестве источника -2, 20 надосадочной жидкости(Аллегретта и др.247, стр. 718, 1990 г.) в течение 5 дней. РНК экстрагировали из культур шариков 2(10122.5), а не из пробы 1012, так как не имелось жизнеспособных клеток в конце 5-дневной культивации. Клон Т-клетки выделяли из центрифугата от больного 1008. Имеющиеся в центрифугате клетки культивировали с концентрацией 2 х 10 /мл в среде, не содержащей -2, в течение двух недель. Неприсоединенные клетки данной культуры клонировали с использованием метода лимитирующего разбавления на аутологические монослои синовиальных клеток. Получили клон 1008.8 4 клетки, который приспосабливали к культивации путем регулярной стимуляции аутологическими синовиальными монослоями в течение 3 дней в среде,не содержащей -2, а затем культивировали в течение 4 дней в среде, содержащей надосадочную жидкость. Лизис синовиальных присоединенных к 1008.8 клеток. 3473 1 Лизис синовиальных присоединенных клеток 1008.8 демонстрировали следующим образом. Монослои синовиальных слоев маркировали, согласно Стэдмэн и Кэмпбелл (. . .,119, стр. 219,1989 г.), с помощьюв качестве маркера в опытах . Клетки обрабатывали трипсином, промывали и нанесли на круглодонную микротитровую пластину с 96 углублениями, причем в каждое углубление подали 2000 клеток. Клетки 1008.8, культивированные за 3 дня до исследования вместе с синовиальными присоединенными клетками и содержащей надосадочную жидкость средой, добавляли к маркерам с нижеприведенным соотношением эффекторов и маркеров. Культуры инкубировали при температуре 37 С в течение ночи, их центрифугировали при 300 хв течение 2 мин, и определяли радиоактивность в 50 мкл надосадочной жидкости. Специфический лизис высчитывали с помощью известных формул на основе лизированных в поверхностно-активном веществе маркеров. Данный клон является цитотоксическим относительно синовиальных присоединенных клеток в опытах(табл. 7). Таблица 7 Соотношение эффектора и маркераспецифического лизиса 51 7 101 16 251 32 Амплификация генов -нити рецептора Т-клеток путем цепной реакции с помощью полимеразы. Гены -нити рецептора Т-клеток амплифицировали с помощью примеров в разных комбинациях, приведенных на табл. 8. 16 мерный пример является дегенерированнымпримером (256), который предположительно связывается с 85 генов -нити рецептора Т-клеток человека на всех 16 остатках и с 95 на 15 остатках. Данный пример использовали для амплификации -нитей рецептора Т-клеток более 25 разных клонов, линий или препаратов первичной ткани человека. Определяли продолжительность многих разных геновданных амплифицированных ДНК, несмотря на значительное отклонение примера относительно некоторых групп . Таким образом, амплификацияс использованием 16 мерного примера облегчает исследование популяций Т-клеток, использование геновкоторых специалисту неизвестно. Гены -нити рецептора Т-клеток амплифицировали путем двухстадийных реакций с парами примеров,приведенными в табл. 8. РНК подвергали обратной транскрипции при температуре 42 С в течение 1 ч с 40 пмоль с использованиемпримера в 12 мгл в условиях, описанных Хартом и др., стр. 596(1988). Продукт реакций разбавляли смесью, содержащей 40 пмоль 16 мерного примера, нуклеотиды и буфер, как выше описано, но без МС 2 с тем, чтобы достичь конечной концентрации 3,6 мМ. Пробы денатурировали при температуре 95 С в течение 15 мин, добавляли 1 единицу теплостойкой рекомбинантной ДНК полимеразы (фирмы Ситэс Корпорейшн, Эмеривилль, Калифорния, США, название АмплитакТМ) и осуществляли 20 циклов . Каждый цикл состоял из денатурации при температуре 95 С в течение 1 мин,ренатурации в течение 2 мин и распространении при температуре 72 С в течение 2 мин. Продукт первых двух циклов ренатурировали при температуре 37 С и 45 С, а остаток - при температуре 50 С. Один мкг аликвотной пробы результата данных реакцийстадии добавляли к 100 мкг амплифицирующей стадии(Ситус,, ТМ), содержащим 100 пмольпримера и 100 пмоль примеров 8, 17 или 5 С,или 100 пмоль примеров мерный пример. Амплификацию стадииосуществляли вышеописанным образом при температуре ренатурации 50 С и без обработки при температуре 37 С и 45 С. Таблица 8 3473 1 Пробы РНК из культур 10122.5 и 1008.8 амплифицировали с помощью 16 мерного примера и примерав реакциях стадиии с помощью 16 мерного примера и примерав реакциях в 35 циклах стадии . Продукт реакций с помощью стеклянных шариков (Биолол, Сан Дьего, Калифорния, США) очищали от агарозного геля с низкой точкой плавления, его основания денатуризировали и его последовательность определяли Т 7 полимеразой (Секвенейз, Юнайтед Стейтс Байохем, Кливлэнд, Охайо, США) с использованиемпримера. Численно преобладающая последовательность , соответствующая отдельной перегруппировке 17 (табл. 9), в пробе 10122.5 легко поддавалась считыванию. Другие, менее распространнные перегруппировки являлись слабыми, не поддающимися считыванию фоновыми полосами в гелях, служащих для определения последовательности. По всей вероятности культура данных 1012.2 шариков, с содержащей 2 среде без добавления дополнительных клеток или антигена не приводит к повторной активации Т-клеток. Таким образом, преобладание одной единственной перегруппировки 17 в данной пробе отражает клональную экспансию, содержащий 17 Т-клеток в этом больном. Определение последовательности ДНК -нити рецептора Т-клеток, амплифицированной с применением цитотоксического клона Т-клеток, 1008.8, также указывает на перегруппировку 17 (табл. 9). Наличие данных двух видов проб синовиальных Т-клеток, полученных от двух больных ревматоидным артритом, предлагает участие содержащих 17 Т-клеток в патогенезе ревматоидного артрита. Таблица 9 Наличие перегруппировок 17 в остальных пробах синовиальной РНК определяли путем амплификации путемс применением специфического относительно 17 примера (табл. 8). ДНК содержащего 17 рецептора Т-клеток амплифицировали с применением проб на магнитных шариках, полученных от семи больных ревматоидным артритом. С помощью обработки продуктов электрофореза бромидом этидия обнаруживали большую амплификацию 17 в четырех из проб, содержащих 2-, чем в соответствующих контрольных пробах, содержащих . Данное обогащение являлось результатом не процесса выделения,так как при амплификации содержащих / рецепторов Т-клеток не обнаруживалась разница между пробами, содержащими , и пробами, содержащими 2-. Перегруппировки 17 двух из препаратов, содержащих РНК 2-, амплифицировали примерами 17 и , а последовательность продукта реакций определяли с использованием примера . Пробы 1014 и 1015 содержали отдельные последовательности (табл. 9), которые, так же, как и проба 101.22.5,указывают на клональную экспансию содержащих 17 Т-клеток. В отличие от этого, непосредственное определение последовательности перегруппировок, амплифицированных с помощью специфического относительно 8 примера, было невозможным из-за значительной разнородности -нити продукта. 17 имеет последовательность аминокислот . ДНК больных ревматоидным артритом. ДНК больных ревматоидным артритом осуществляли следующим образом. ДНК от каждого больного препарировали путем кипячения 105 синовиальных клеток в 200 мкл 2. 10 мкл амплифицировали в 35 циклах в 100 мкл среды (Ситус, Джин Амп КитТМ), содержащей 100 пмоль каждого примера для осуществления цепной реакциипри помощи полимеразы (табл. 10). 1/10 мкл данной среды реамплифицировали в 10 циклах в 10 мкл, содержащих лишь пример 2 и 17 пмоль 32 Р- в качестве единственного источника . Добавляли 200 мкМи осуществляли 2 цикла. Получаемые пробы (отрицательный тяж) в условиях, описанных Амором и др. (. .,138, стр. 1947, 1987 г.), гибридизи 17 3473 1 ровали с получением следов, содержащих 10 пмоль - аллель-специфических олиго (положительные тяжи). Следы два раза промывали хлоридом тетраметиламмония (Вуд и др., . . .,82,стр. 1585, 1985 г.) при температуре 65-68 С в течение 20 мин и затем их обрабатывали рентгеновскими лучами. Каждый больной в данном анализе имел, по крайней мере, один аллель генов -, а именно 44,1, 414 или 415, известных как вызывающие восприимчивость к ревматоидному артриту факторы (табл. 10). Таблица 10 Содержащие 17 рецепторы Т-клеток или их фрагменты, которые являются иммуногенными или которым можно придавать иммуногенность, можно использовать для иммунизации людей с помощью способов,описанных в примере 7. Такая иммунизация может привести к эффективной иммунной реакции. Хотя в данном тексте изобретение описано на одном предпочтительном примере его выполнения, следует указывать на то, что возможны разные модификации без выхода за рамки изобретательского замысла. Поэтому изобретение не ограничивается раскрытым в тексте описанием, а лишь формулой изобретения. Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66. 18
МПК / Метки
МПК: G01N 33/53, A61K 39/39, C07K 2/00, A61K 39/44
Метки: лечения, профилактики, диагностики, прогнозирования, артриту, репликации, рассеянному, т-клеток, патологии, склерозу, получения, восприимчивости, т-клетками, нерегулируемой, опосредованной, способ, вакцина, клонами, ревматоидному, вакцины, или
Код ссылки
<a href="https://by.patents.su/18-3473-vakcina-dlya-profilaktiki-ili-lecheniya-oposredovannojj-t-kletkami-patologii-ili-nereguliruemojj-replikacii-klonami-t-kletok-sposob-polucheniya-vakciny-sposob-diagnostiki-ili-progn.html" rel="bookmark" title="База патентов Беларуси">Вакцина для профилактики или лечения опосредованной Т-клетками патологии или нерегулируемой репликации клонами Т-клеток, способ получения вакцины, способ диагностики или прогнозирования восприимчивости к ревматоидному артриту или рассеянному склерозу, сп</a>
Предыдущий патент: Способ контроля толщины поверхностно-упрочненных слоев ферромагнитных изделий
Следующий патент: Композиции на основе фактора Лелистада
Случайный патент: Устройство для перемешивания малых объемов жидкости в узком сосуде