Моноклональное антитело, обладающее свойством вызывать апоптоз миелоидных клеток костного мозга, его F(ab)2 фрагмент и гибридома
Текст
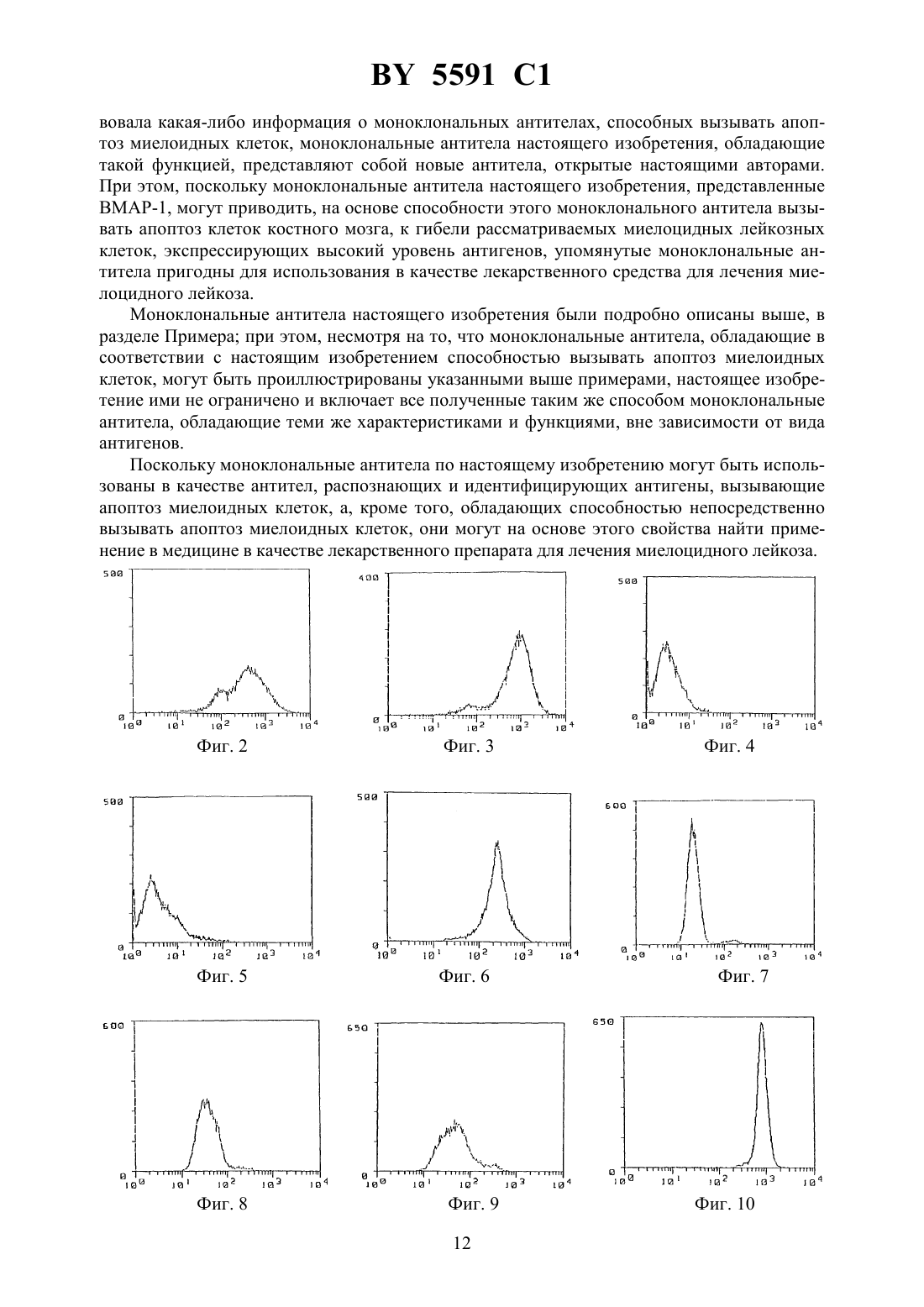
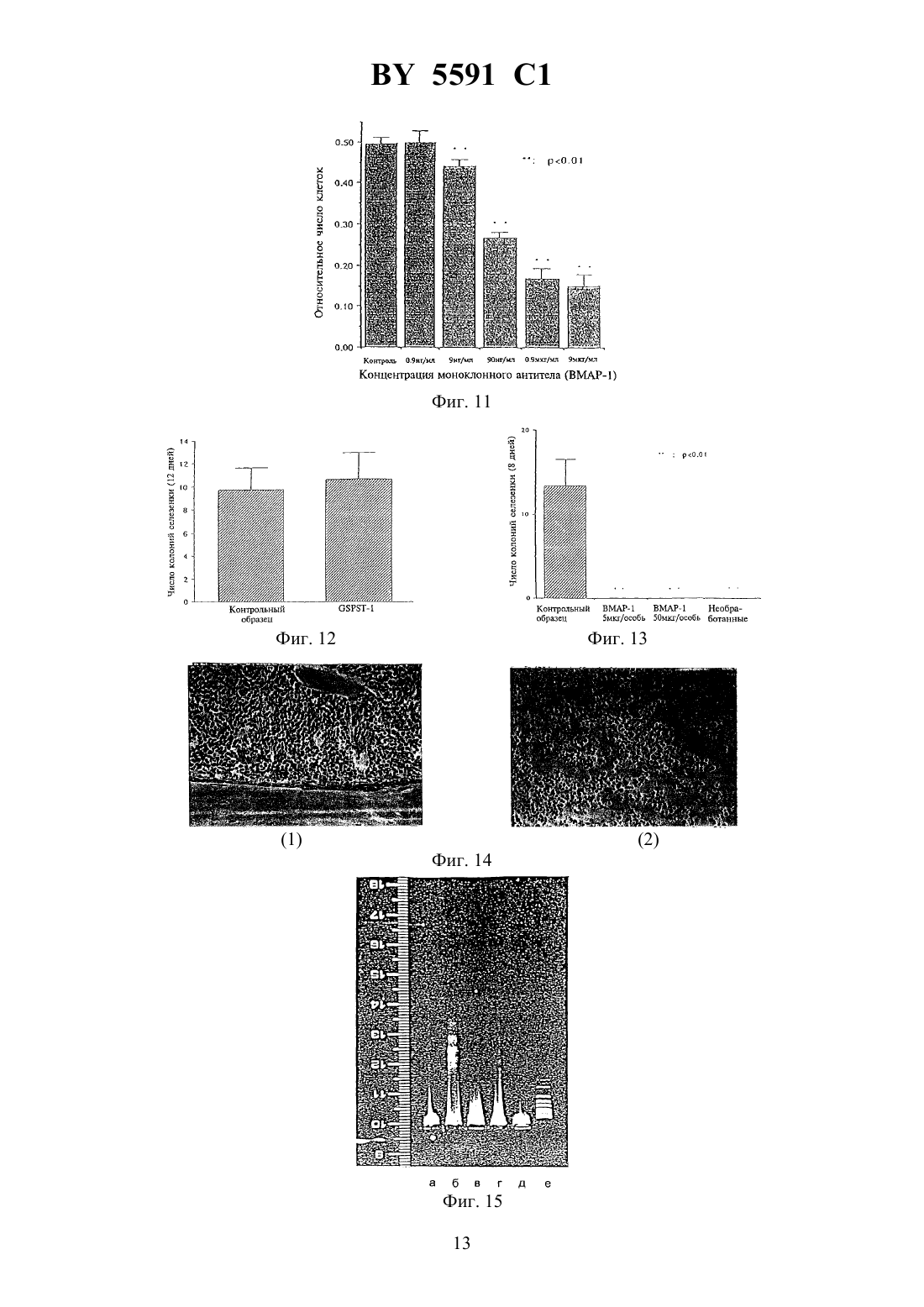
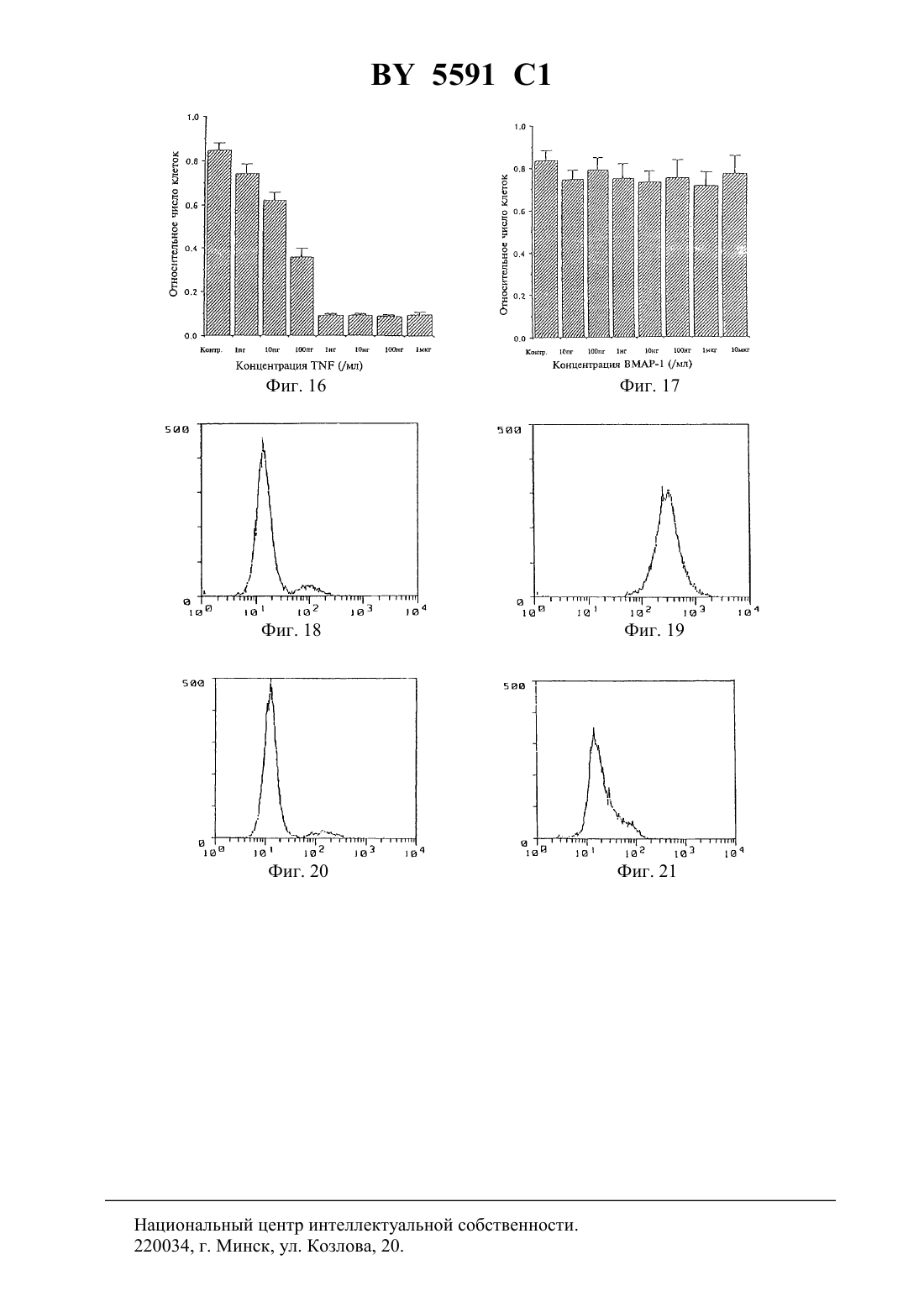
(12) НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ОБЛАДАЮЩЕЕ СВОЙСТВОМ ВЫЗЫВАТЬ АПОПТОЗ МИЕЛОИДНЫХ КЛЕТОК КОСТНОГО МОЗГА, ЕГО 2 ФРАГМЕНТ И ГИБРИДОМА(71) Заявитель Чугай Сейяку Кабусики Кайся(73) Патентообладатель Чугай Сейяку Кабусики Кайся(57) 1. Моноклональное антитело, способное распознавать антиген, вызывающий апоптоз миелоидных клеток костного мозга, получаемое с использованием стромальных клеток селезенки животных, которым вводили рекомбинантный гранулоцитарный колониестимулирующий фактор (-), и обладающее свойством вызывать апоптоз миелоидных клеток. 2. Моноклональное антитело по п. 1, отличающееся тем, что представляет собой . 3. Моноклональное антитело по п. 1, отличающееся тем, что получено с использованием человеческих спленоцитов стромальных клеток в качестве антигена. 4. Моноклональное антитело по п. 1, отличающееся тем, что представляет собой-1, продуцируемое гибридомой-4382. 5. 2 фрагмент моноклонального антитела по п. 1, обладающий свойством вызывать апоптоз миелоидных клеток. 6. Гибридома-4382, продуцирующая моноклональное антитело по п. 1. 5591 1 Изобретение относится к новым моноклональным антителам, обладающим способностью вызывать апоптоз миелоидных клеток и которые могут в этой связи рассматриваться как полезные лекарственные средства для применения в случае миелоцидного лейкоза, а также к фрагментам таких антител, кроме того, изобретение относится к гибридоме, продуцирующей моноклональные антитела. Поскольку моноклональные антитела по настоящему изобретению используются в качестве антител, специфически распознающих и идентифицирующих антигены, которые вызывают апоптоз миелоидных клеток, сами обладают способностью вызывать апоптоз миелоидных клеток, то на основе использования этих свойств они могут рассматриваться как лекарственные средства, эффективные для применения в случае миелоцидного лейкоза. Гранулоцитарные колониестимулирующие факторы, такие как, например, рекомбинантные гранулоцитарные колониестимулирующие факторы (-), были известны вначале как гуморальные факторы, стимулирующие дифференциацию и пролиферацию гранулоцитарных клеток, при этом в экспериментах на мышахбыло показано, что введение - стимулирует гемопоэз в костном мозге и, кроме того, вызывает выраженный экстрамедуллярный гемопоэз, осуществляемый в селезенке при пролиферации гемопоэтических стволовых клеток и всех клеток-предшественников, имеющихся в процессе кроветворения в селезенке. Считается при этом, что механизм гемопоэза в селезенке,будучи экстрамедуллярным по своей природе, осуществляется благодаря модификациям в микросреде в процессе кроветворения в селезенке, которые возникают в связи со стимулирующим действием -, повышающим гемопоэтический потенциал. В соответствии с этим авторы настоящего изобретения исследовали стромальные клетки селезенки, в которые был введен -, с целью определения уровня гемопоэтического потенциала в селезенке, далее установили гемопоэтическую клеточную линию стромы (-1 клетки) из селезенки мышей, которым был введен -, для исследования существования факта повышения гемопоэтического потенциала под действием стромальных клеток, содержащих введенный -, и с применением гемопоэтических стромальных клеток показали потенциальный эффект на гемопоэз и, наконец, определили колониестимулирующую активность,также способность поддерживать гемопоэтические стволовые клетки(, 80, 1914, 1992). Однако, хотя на основе ряда стромальных клеток селезенки удалось получить клеточные линии (-1 клетки) и определить их цитологические характеристики, до сих пор еще не были получены специфические антитела, распознающие клеточную поверхность их антигенов, как не известны до настоящего времени и характеристики таких антител. В этой связи, на основе использования приведенной выше информации, касающейся стромальных клеток селезенки, а также результатов проведенных исследований, авторы настоящего изобретения провели исследование с целью получения специфических антител, способных распознавать стромальные клетки селезенки, и получения далее моноклональных антител с использованием стромальных клеточных линий селезенки в качестве антигенов для иммунизации, в результате чего были получены новые, не известные ранее моноклональные антитела. В ходе изучения свойств полученных моноклональных антител авторы неожиданно обнаружили, что упомянутые антитела обладают способностью вызывать апоптоз миелоидных клеток, и этот факт явился основой исследований, составивших предмет настоящего изобретения. Задачей настоящего изобретения является создание новых моноклональных антител,обладающих способностью вызывать апоптоз миелоидных клеток и в этой связи применимых для лечения миелоцидного лейкоза, кроме того, получение их фрагментов, а также гибридомы, способной к продуцированию моноклонального антитела. Моноклональное антитело по настоящему изобретению является полезным в качестве антитела, распознающего антигены, вызывающие апоптоз который называют также са 2 5591 1 моразрушением клеток - явление, при котором ДНК ядерного хроматина расщепляется в нуклеосоме (с образованием так называемой лэддер-последовательности), которое приводит к гибели клетки миелоидных клеток, а также использования свойственной ему функции идентификации таких антигенов или функции, определяемой их способностью вызывать апоптоз миелоидных клеток. Между тем, миелоидные клетки включают клетки,отличные от лимфоидных клеток, такие как нейтрофилы, мегакариоциты, миелобласты,миелоциты, тучные клетки, макрофаги, моноциты и эритробласты, так что в контексте настоящего изобретения термин миелоидные клетки имеет приведенные выше значения. До сих пор не были известны моноклональные антитела, обладающие способностью вызывать апоптоз миелоидных клеток, поэтому моноклональные антитела настоящего изобретения включают в себя все моноклональные антитела, способные вызывать апоптоз миелоидных клеток. В общих чертах моноклональные антитела по настоящему изобретению могут быть получены с помощью указанного ниже способа. А именно, моноклональное антитело по настоящему изобретению может быть получено, например, путем использования стромальных клеток селезенки, взятых от животных, с введенным в качестве антигена -, иммунизации их, которую осуществляют по традиционно принятой методике слияния иммунизированных клеток с помощью стандартной процедуры слияния и клонирования слитых клеток с использованием известного метода клонирования. В качестве предпочтительного способа получения моноклональных антител настоящего изобретения может быть приведен метод, включающий использование в качестве антигена -1 клеток, представляющих собой стромальные клетки селезенки животного,которому вводят -, и которые выведены авторами настоящего изобретения в качестве культуральной клеточной линии (, 80, 1914, 1992), слияние плазматических клеток (иммуноцитов) из млекопитающего, иммунизированного антигеном, с миеломными клетками млекопитающего, в частности мыши, клонирование полученных слитых клеток (гибридом), селекцию клонов, продуцирующих антитело настоящего изобретения,которое способно распознавать указанную клеточную линию среди других, и культивирование их с выходом целевого антитела. Однако этот метод приведен лишь в качестве одного из возможных примеров, так что в данном случае для получения, на основе того же способа, что и в случае -1 клеток, антител, связывающихся с интересующими миелоидными клетками человека, в качестве антигенов могут использоваться не только вышеупомянутые -1 клетки, но также и клеточные линии, полученные способом, аналогичным примененному в случае -1 клеток, из стромальных клеток селезенки человека. В соответствии со способом получения таких моноклональных антител использование тех или иных млекопитающих, которые могут быть иммунизированы вышеупомянутым антигеном, особо не ограничено однако предпочтительно проводить отбор, принимая во внимание соответствие миеломных клеток для их использования в процедуре слияния клеток, при этом по данному способу оказывается предпочтительно работать с мышами,крысами и хомячками. Иммунизацию осуществляют в соответствии с общепринятой методикой, например,посредством введения с помощью инъекции стромальных клеток селезенки, таких как вышеупомянутые -1 клетки, в брюшную полость млекопитающего. Более специфично предпочтительно вводить их животному при разбавлении или суспендировании в соответствующем количестве фосфатно-буферного раствораили изотонического раствора хлорида натрия несколько раз в месяц. Предпочтительно использовать в качестве иммуноцитов клетки селезенки, отобранные по завершении последнего введения вышеупомянутых клеток. В качестве второго компонента, необходимого для проведения слияния клеток, который представляет собой миеломные клетки, предпочтительно использование ряда извест 3 5591 1 ных клеточных линий, которые включают РЗ (РЗХ 63 Ад 8.653) (. ., 123, 1548,1978), 3-1 (, 81, 1-7, 1978), -1 (. .., 6, 511-519, 1976), -11 (, 8, 405-415, 1976),2/- 14 (, 276,269-270, 1978),(. , ., 35, 1-21, 1980),194 (. . ., 148, 313-323,1978) и 210 (, 277, 131-133, 1979). Слияние клеток при использовании вышеупомянутого иммуноцита и миеломной клетки может быть проведено в целом с помощью одного из традиционных способов, например, по методу Мильштейна и др. ( ., 73, 3-46, 1981). Более специфично вышеупомянутое слияние клеток может быть проведено, например,в простой питательной среде в присутствии вещества, ускоряющего слияние. В качестве такого ускоряющего слияние клеток агента может использоваться полиэтиленгликоль и вирус, а, кроме того, при необходимости усилить эффективность слияния практикуется добавление адъювантов, таких как диметилсульфоксид. Что касается коэффициентов отношения иммуноцитов и миеломных клеток, то предпочтительно использование первого из них в 1-10-кратном количестве относительно второго компонента смеси для слияния клеток. В качестве примеров среды, применимой для проведения вышеупомянутой процедуры слияния, можно привести среду 1-1640 исреду (минимальную поддерживающую среду), которые хорошо подходят для осуществления пролиферации упомянутых миеломных клеток, а также ряд других сред, традиционно используемых для культивирования такого рода клеток, которые, кроме того,могут содержать дополнительно сыворотку, в частности фетальную телячью сыворотку. Клеточное слияние проводят при смешивании описанных ранее количеств вышеупомянутых иммуноцитов и миеломных клеток в вышеупомянутой среде, при добавлении в среду, обычно в концентрации 30-60(вес/объем), раствора , предварительно нагретого до температуры около 37 С, например такого , который имеет средний молекулярный вес в диапазоне от 1000 до 6000, с последующим перемешиванием. Затем последовательно, при повторении процедур добавления соответствующих сред друг за другом, центрифугировании реакционной смеси и удалении супернатантов могут быть получены целевые гибридомы. Упомянутые гибридомы подвергают селекции при культивировании на обычной селективной среде, в частности насреде (среде, содержащей гипоксантин, аминоптерин и тимидин). Культуру выращивают насреде в течение периода времени, достаточного для того, чтобы клетки, отличные от гибридом (неслитые клетки), погибли, обычно от нескольких дней до нескольких недель. Затем с применением обычного метода ограниченных разведении проводят скрининг и клонирование гибридом. Полученные гибридомы, способные к продуцированию моноклинальных антител по настоящему изобретению, могут быть далее подвергнуты субкультивированию, после чего они могут храниться в жидком азоте в течение длительного времени. Для получения моноклональных антител по настоящему изобретению от гибридом может быть применен метод, включающий культивирование гибридом по обычной методике с получением их из супернатантов, или метод, включающий введение гибридомы с целью ее пролиферации в организм подходящего млекопитающего с получением их из асцита. Первый способ применяется для случаев получения антител высокой чистоты, тогда как второй - для целей массовой продукции антител. Кроме того, антитела, получаемые при использовании вышеуказанных методов, могут быть очищены до высокой степени чистоты с помощью традиционных способов очистки,таких как высаливания, гель-фильтрация и аффинная хроматография. Моноклональное антитело по настоящему изобретению может быть любым таким антителом, обладающим специфическим свойством, более подробно описанным далее в примере, а именно свойством вызывать апоптоз миелоидных клеток, при этом все несу 4 5591 1 щие такое свойство антитела включены в рамки настоящего изобретения, независимо от вида антигенов моноклональное антитело настоящего изобретения может быть применено на основе реализации этого его свойства в качестве лекарственного средства для лечения миелоцидного лейкоза. Нет необходимости говорить о том, что создание на основе моноклональных антител настоящего изобретения специфичной системы для идентификации и распознавания антигенов, вызывающих апоптоз миелоидных клеток, или для использования в качестве лекарственного средства при лечении миелоцидного лейкоза, на основе реализации специфического свойства антител, а также все виды модификации и применения такой системы включены в рамки настоящего изобретения, в той мере, в какой все они применимы на практике с использованием метода, очевидного для каждого специалиста, обладающего средним уровнем знаний в данной области. Ниже приведено детальное описание настоящего изобретения в соответствии с эталонным примером и примером, не ограничивающих объем изобретения, со ссылками на фиг. 1-21. На фиг. 1 приведены результаты иммунофлюоресцентного анализа (контроль в отсутствие антитела, -1 клетка). На фиг. 2 приведены результаты исследования способности к связыванию -1 антитела с -1 клетками на основе иммунофлюоресцентного анализа. На фиг. 3 приведены результаты исследования способности к связыванию ВМАР-1 антитела с -1 клетками на основе иммунофлюоресцентного анализа. На фиг. 4 приведены результаты иммунофлюоресцентного анализа (контроль в отсутствие антитела, клетка костного мозга). На фиг. 5 приведены результаты исследования способности к связыванию 1 антитела с клетками костного мозга на основе иммунофлюоресцентного анализа. На фиг. 6 приведены результаты исследования способности к связыванию ВМАР-1 антитела с клетками костного мозга на основе иммунофлюоресцентного анализа. На фиг. 7 приведены результаты иммунофлюоресцентного анализа (контроль в отсутствие антитела, -60). На фиг. 8 приведены результаты исследования способности к связыванию -1 антитела с -60 клетками на основе иммунофлюоресцентного анализа. На фиг. 9 приведены результаты иммунофлюоресцентного анализа (контроль относительно 1, -60). На фиг. 10 приведены результаты исследования способности к связыванию ВМАР-1 антитела с -60 клетками на основе иммунофлюоресцентного анализа. На фиг. 11 проиллюстрирован метод количественного определения моноклонального антитела (ВМАР-1), ингибирующего пролиферацию -60 клеток. На фиг. 12 проиллюстрирован метод количественного определения моноклонального антитела ( -1), ингибирующего трансплантацию костного мозга. На фиг. 13 проиллюстрирован метод количественного определения моноклонального антитела (ВМАР-1), ингибирующего трансплантацию костного мозга. На фиг. 14 показаны микрофотография (окраска гематоксилинэозином) образцов костного мозга (400) клетки костного мозга (2), погибшие на 6 день после введения моноклонального антитела ВМАР-1 по настоящему изобретению, и контроль (1) в отсутствие антитела. На фиг. 15 показано (фотография движения в электрофорезе) образование лэддерпоследовательности ДНК в клетках костного мозга, которое наблюдается в том случае,когда вводят моноклональное антитело ВМАР-1 по настоящему изобретению. На фиг. 16 проиллюстрирован количественный метод определения цитотоксичности с использованием 929 клеток и(фактора некроза опухолевых клеток альфа). На фиг. 17 проиллюстрирован количественный метод определения цитотоксичности с помощью моноклонального антитела (ВМАР-1). 5 5591 1 На фиг. 18 приведены результаты иммунофлюоресцентного анализа (контроль относительно 2 крысы, 1). На фиг. 19 приведены результаты исследования способности к связыванию антитела к мышиному главному комплексу чисто совместимости МНС класса 1 с 1 клетками на основе иммунофлюоресцентного анализа. На фиг. 20 приведены результаты иммунофлюоресцентного анализа (контроль относительно 1 крысы, 1). На фиг. 21 приведены результаты исследования способности к связыванию ВМАР-1 антитела с 1 клетками на основе иммунофлюоресцентного анализа. Приведенные на фиг. 15 обозначения означают а - ДНК из тимуса мыши, которой был введен ВМАР-1 (24 часа) б - ДНК из костного мозга мыши, которой был введен ВМАР-1 (24 часа) в - ДНК из костного мозга мыши, которой был введен ВМАР-1 (8 часов) г - ДНК из костного мозга мыши, которой был введен ВМАР-1 (4 часа) д - ДНК из костного мозга необработанной мыши (клетки костного мозга) е - маркер молекулярной массы. Эталонный пример Создание линии стромальных клеток селезенки и ее характеристика 1) Создание линии стромальных клеток селезенки Линию стромальных клеток селезенки создают на основе первичной культуры клеток селезенки мыши 57/6, которой вводили - в количестве 100 мкг/кг в течение 5 дней. Процедура заключалась в следующем после завершения введения - в асептических условиях из животного удаляют селезенку, культивируют ее в инкубаторе при температуре 37 С в условиях 5 содержания С 2 в течение 6 недель в пластиковой колбе с площадью основания 25 см 3 ( .), используя средув модификации(- .), в которую внесены инактивированная нагреванием 10 фетальная телячья сыворотка( , ) 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина, при этом указанную среду заменяют свежей средой культивирования два раза в неделю. В конфлюентной культуре отбирают популяции слипшихся клеток (стромальных клеток) из колбы с применением , не содержащего Са и М, в который внесены 0,95 трипсин и 0,02(.), и переносят в новые колбы. Такие действия повторяют один или два раза в неделю. Сначала (первые десять раз) коэффициент расщепления клеток составляет от 1/4 до 1/8, впоследствии он снижается до величин в диапазоне от 1/16 до 1/32. Приблизительно после 10-го переноса стромальные клетки становятся гомогенными и фибробластоидными. К 20-му разу проведения вышеописанной процедуры стромальные клетки отбирают и направляют на клеточное клонирование с использованием методики ограниченных разведении клеточное клонирование повторяют дважды с установлением линии стромальных клеток (клеточная линия -1). Далее эти клетки поддерживают в колбе с площадью основания 25 см 3 ( .) в 5 мл среды 1 с добавлением 10 инактивированной нагреваниеми проводят субкультивирование каждые пять дней при коэффициенте расщепления 1/32. Линии стромальных клеток селезенки могут быть созданы не только на основе мыши, но и из других животных так, например, с использованием вышеописанного способа могут быть получены стромальные клеточные линии человека посредством трансформации клеток вектором аденовируса -40 (.., 148, 245, 1991). 2) Характеристика -1 клеток-1 клетки, установленные описанным выше способом в виде клеточной линии, исследовали с применением стандартных цитохимических методов анализа на содержание 6 5591 1 щелочной фосфатазы, кислой фосфатазы, -глюкуронидазы, -нафтил-ацетат-эстеразы. При изучении -1 клеток методами иммуноферментной гистохимии использовали следующие моноклональные и поликлональные антитела( .), антиген, связанный с фактором, коллаген типа , коллаген типаи фибронектин(.). Фагоцитоз исследовали по поглощению латексных гранул(размер частиц 1,09 мкм. ), а способность -1 клеток превращаться в адипоциты определяли при воздействии фосфата гидрокортизонав дозе 10-6 моль/л в течение 4 недель на конфлюентную культуру, находящуюся в колбе с площадью основания 25 см 2. В результате проведенных исследований было показано, что -1 клетки не содержат щелочной фосфотазы, антигена, связанного с фактором ,1, кроме того, при исследовании фагоцитоза были получены отрицательные результаты, тогда как положительные данные были показаны при тестировании их на наличие коллагена типа ,коллагена типаи фибронектина. -1 клетки не демонстрировали трансформации в адипоциты в течение 4 недель в конфлюентной культуре при наличии гидрокортизона в дозе 10 моль/л, хотя -1 клетки содержат, как было показано, следы липида. На основании этих результатов был сделан вывод о том, что -1 клетки не обладают свойствами преадипоцитов, макрофагов и эндотелиальных клеток, и в этой связи их происхождение из других клеток, а именно из стромальных клеток. 3) Поддержание гемопоэтических стволовых клеток клетками -1 Для того, чтобы определить, способны ли -1 клетки поддерживать рост гемопоэтических стволовых клеток, с помощью техникибыло проведено тестирование на образование колониеобразующей единицы клеток селезенки (КОЕ-С) - тест на колониеобразующую способность селезеночных клеток. В ходе тестирования группу из 10 мышей облучали дозой в 900(-1520 , ), после чего животным инъецировали внутривенно моноядерные клетки костного мозга (ВМ клетки) (1,0105/организм, 5,0104/организм или 2,5104/организм) и 1 клетки (1,0105/организм), а на 12-й день в селезенке подсчитывали количество образовавшихся колоний в виде КОЕ-С клонов(селезеночные колонии). Было показано, что при трансплантации в организм облученных мышей моноядерных клеток костного мозга (ВМ клеток) и -1 клеток количество колоний каждой группы ВМ клеток значительно возрастает (от 1,4 до 1,8 раз) в сравнении с мышами, которым не вводили -1 клетки, при этом происходит также снижение уровня смертности, поскольку на 12-й день после трансплантации коэффициент выживания мышей с трансплантированными ВМ клетками и -1 клетками был выше, чем в случае мышей, несущих в качестве трансплантированных только ВМ клетки эти результаты демонстрируют очевидную способность -1 клеток поддерживать рост гемопоэтических стволовых клеток. Оптимальный способ осуществления изобретения Ниже приводится подробное описание такого варианта настоящего изобретения. Пример. Получение моноклональных антител 1) Антигены и иммунизация Иммунизацию проводят с применением в качестве антигенов -1 клеток, полученных по вышеприведенной стандартной процедуре. Клетки культивируют в инкубаторе при температуре 37 С и содержании 5 СО 2, в средев модификации(1 среде) (- .), содержащей 10 фетальную телячью сыворотку . Клетки обрабатывают 1 мМ / и с помощью пипетки отбирают из культуральной колбы. Затем клетки суспендируют в 1 мМ / до концентрации клеток примерно 1107 мл, после чего полученную суспензию вводят крысам линиивозраст 7 недель, самки, из. Один мл клеточной суспензии, содержащей около 1107 клеток/мл, инъецируют в брюшную полость 7 5591 1 крысы в ходе первичной иммунизации, а через месяц вводят еще 1 мл клеточной суспензии, содержащей примерно 1107 клеток/мл. Далее с интервалом в один месяц вводят еще несколько раз 1 мл клеточной суспензии, содержащей приблизительно 1107 клеток/мл, а затем, после наблюдения реакции между антителом иммунизированной крысы и -1 клетками, вводят завершающую дозу иммунизации в 1 мл клеточной суспензии, содержащей около 1108 клеток/мл. Спустя три дня после введения завершающей дозы, крыс забивают и удаляют из них селезенки. 2) Слияние клеток Селезенку после удаления из организма крысы измельчают, выделенные селезеночные клетки центрифугируют, суспендируют в 1 среде (- .) и тщательно промывают. С другой стороны, клетки, полученные при культивировании миеломной клеточной линии мышей 2/0-4 (, 276, 269-270, 1978) и находящиеся в среде 1 (- Со.) с добавлением 10 фетальной телячьей сыворотки , также промывают в вышеприведенной 1 среде, после чего из них отбирают 1108 клеток, а из описанных ранее селезеночных клеток отбирают соответственно 2108 клеток и помещают обе аликвоты в центрифужную пробирку для осуществления по традиционной методике процесса слияния клеток под влиянием полиэтиленгликоля 4000 ( ) (. . ., 42, 458-462, 1980). Далее полученные слитые клетки распределяют по 96-гнездному планшету в 1 среде, содержащей 20, и культивируют при температуре 37 С и содержании 5 СО 2. На следующий день их осторожно переносят на селективнуюсреду, продолжая на ней культивирование. С момента начала культивирования два раза в неделю заменяют супернатанты на свежуюсреду с целью продолжения роста культуры к поддержания пролиферации клеток. После этого полученные после слияния гибридные клетки клонируют по традиционной методике с использованием способа ограниченных разведении. А именно в соответствии с указанной традиционной методикой с применением способа ограниченных разведении клонируются только те клоны, которые обладают выраженными способностями к связыванию, при этом отслеживают их связывающую способность с антигенами, которые соединяются с антителами, находящимися в супернатантах таких гибридных клеток. 3) Скрининг Скрининг слитых клеток (гибридом) проводят на основе опосредованной флюоресценции антител с использованием проточной цитометрии. Скрининг клонов, продуцирующих целевые антитела, осуществляют с помощью -1 клеток в качестве клеток-мишеней. При этом клетки, суспендированные в реакционном буфере ( с добавлением 2 ФТС и 0,023), центрифугируют, а осадок вновь суспендируют в 100 мкл культурального супернатанта от выращивания гибридом (примерно 1106 клеток/100 мкл) и проводят реакцию при температуре 4 С в течение 1 часа. После этого клетки промывают еще раз вышеописанным буфером, добавляют меченное флуоресцином козлиное антитело ккрысыи проводят инкубацию в течение 1 часа. По окончании еще одной стадии промывания клетки анализируют методом проточной цитометрии (,). 4) Очистка антител После скрининга по приведенному в 3) методу слитые клетки культивируют с использованием обычной методики, при этом образуемые антитела выделяют из супернатантов с помощью традиционной процедуры и далее очищают. В соответствии с этой процедурой гибридом с высокими титрами антител к антигенам отбирают из ячеек, распределяют в культуре ткани на пластиковой чашке Петри (.), культивируют с целью пролиферации при температуре 37 С и содержании 5 СО 2 и затем подвергают очистке по обычной методике для получения моноклональных антител -1 и ВМАР-1. 8 5591 1 Для выделения -1 полученные клетки инъецируют в брюшную полость лишенных волосяного покрова мышей./ - мыши самцы, 8-недельного возраста,. Возникший асцит вскрывают через 10-14 дней, высаливают с применением 33 сульфата аммония и диализуют против . Что касается ВМАР-1 антител проводят крупномасштабное культивирование в минимальной поддерживающей среде , модифицированной по методу , содержащей 10, после чего супернатанты концентрируют, высаливают с применением 33 сульфата аммония,диализуют против , снова очищают с применением набора колонок с протеином и диализуют против . Далее, как было описано в примере, -1 клетки используют в качестве антигенов для проведения иммунизации однако возможно с применением того же способа получение моноклональных антител в случае использования других стромальных клеток, обладающих способностью поддерживать рост гемопоэтических стволовых клеток, так что настоящее изобретение не ограничивается вышеприведенными антителами, но включает также все моноклональные антитела, имеющие такие характеристики, а также все гибридомы, продуцирующие моноклональные антитела. Гибридома, продуцирующая моноклональное антитело ВМАР-1 настоящего изобретения, представляет собой гибридную клетку, полученную путем слияния селезеночной клетки из крысыи миеломной клетки из клеточной линии мышей 2/014, которая была депонирована 9 августа 1993 г. под названием ВМАР-1 (гибридома из материала крысы и мыши) под депозитным номером-4382 в Национальном Институте Биологических Наук и Технологии Исследования Человека Агентства Промышленной Науки и Технологии в Японии (адрес 1-3, Хигаши 1-хом, Тсукуба-ши, Ибараки 305, Япония),(1-3,1-, -,305, ) международного депозитарного управления, действующего на основе Будапештского Договора по международной классификации депозитов микроорганизмов с целью их патентования. 5) Свойства антител(Реактивность относительно -1 клеток) Результаты исследования с применением иммунофлюоресцентного анализа реакционной способности моноклональных антител -1 и ВМАР относительно -1 клеток показаны на фиг. 1-3. Так, на фиг. 1 приведены данные по изучению контроля в отсутствие антитела, на фиг. 2 представлены результаты исследования способности -1 к связыванию с -1 клетками, а на фиг. 3 - результаты анализа связывающей способности ВМАР-1 также с -1 клетками. На этих фигурах вертикальные оси показывают относительное количество клеток, тогда как на горизонтальных осях приведены данные по интенсивности флюоресценции. Как следует из фиг. 1-3, моноклональные антитела -1 и ВМАР-1 характеризуются способностью как к связыванию с -1 клетками, так и к распознаванию поверхностных антигенов -1 клеток.(Реактивность относительных клеток костного мозга) Далее, на фиг. 4-6 представлены результаты исследования с применением метода проточной цитометрии (,) реакционной способности -1 и ВМАР-1 относительно клеток костного мозга. Так, на фиг. 4 приведены данные по изучению контроля в отсутствие антитела, на фиг. 5 представлены результаты исследования способности -1 к связыванию с клетками костного мозга, а на фиг. 6 - результаты анализа связывающей способности ВМАР-1 также с клетками костного мозга. На этих фигурах вертикальные оси показывают относительное количество клеток, тогда как на горизонтальных осях приведены данные по интенсивности флюоресценции. 9 5591 1 Как следует из фиг. 4-6, у -1 полностью отсутствует способность к связыванию с клетками костного мозга, тогда как для ВМАР-1 характерна способность к связыванию со всеми клетками костного мозга.(Реакционная способность относительно клеток миелоцитарной лейкозной клеточной линии (-60 Результаты исследования с применением метода проточной цитометрии (, ) реакционной способности -1 и ВМАР-1 относительно -60 клеток (. . . , , 82, 6687-6691, 1985) представлены на фиг. 7-10. Так, на фиг. 7 приведены данные по изучению контроля в отсутствие антитела, на фиг. 8 представлены результаты исследования способности -1 к связыванию с -60 клетками, на фиг. 9 - результаты анализа контроля с использованием имеющегося на рынке 1 крысы , тогда как на фиг. 10 показаны результаты изучения связывающей способности ВМАР-1 также с -60 клетками. На этих фигурах вертикальные оси показывают относительное количество клеток, тогда как на горизонтальных осях приведены данные по интенсивности флюоресценции. Как показано на фиг. 7-10, -1 не взаимодействует с -60 клетками, тогда как ВМАР-1 обладает способностью к связыванию с -60 клетками.(Тестирование способности ВМАР-1 ингибировать профилерацию -60 клеток) На фиг. 11 приведены результаты исследования действия ВМАР-1 на -60 в присутствии 100 нг/мл - и 10-6 М циклогексимида в соответствии с МТТ тестом. С использованием 96-ячеечных микротитрационных плато к каждой ячейке, содержащей в 100 мкл 4103 -60 клеток, добавляют по 10 мкл раствора ВМАР-1 в концентрациях 0, 10,100 нг/мл, а также 1, 10, 100 мкг/мл и подсчитывают через два дня с применением МТТ метода количество живых клеток. Как показано на фиг. 11, происходит выраженное ингибирование профилерации 60 клеток под действием ВМАР-1. Определение типа антител Далее в результате типирования подклассаполученных моноклональных антител с использованием набора (-- , ) и биотин-меченного мышиного антитела к 1 крысыбыло показано, что -1 представляет собой 2, а ВМАР-1 является 1. Способность ингибировать трансплантацию костного мозга С целью дальнейшего изучения антитела настоящего изобретения были использованы в экспериментах по ингибированию трансплантации костного мозга. На фиг. 12 и 13 представлены полученные при этом результаты. Как следует из данных, приведенных на этих фигурах, ВМАР-1 демонстрирует ингибирующий трансплантацию костного мозга эффект,тогда как -1 такое действие не свойственно. Указанные результаты получены при введении через хвостовые вены облученным летальной дозой радиации (900 ) мышам 57/6 клеток костного мозга в количестве 1,0105 в расчете на одно животное и моноклональных антител с последующим подсчетом числа клеточных колоний в селезенке. Вариант Не обработанные на фиг. 13 относится к случаю, при котором клетки костного мозга не вводятся в исследуемое животное. Как показано на фиг. 13, в описываемом исследовании по ингибированию трансплантации костного мозга было подтверждено представление о том, что именно потому, что ВМАР-1 может вступать во взаимодействие с клетками костного мозга, приводя в итоге к апоптозу, моноклональное антитело полностью ингибирует трансплантацию костного мозга в данном тесте. При этом, когда гибридому, продуцирующую ВМАР-1, вводят в брюшную полость лишенной волосяного покровамыши, она погибает в тот момент, когда содержимое асцита сосредоточивается в малом объеме. Кроме того, было показано, что все клетки костного мозга погибают при внутривенном введении ВМАР-1 нормальным мышам 57/6 в расчете 50 мкг на животное, при этом на фиг. 14 приве 10 5591 1 дена микрофотография, демонстрирующая гибель клеток костного мозга на 6-й день после внутривенного введения ВМАР-1. Как видно из данной фотографии, в этом случае погибают не только лимфоидные клетки, но также нейтрофилы, мегакариоциты, миелобласты,миелоциты, тучные клетки, макрофаги, моноциты и эритробласты (так называемые миелоидные клетки). Кроме того, как следует из фиг. 15, при исследовании ДНК клеток костного мозга мыши, которой было введено ВМАР-1 антитело в расчете 30 мкг на животное,был продемонстрирован факт очевидного образования лэддер-последовательности ДНК,при этом было установлено, что указанная выше реакция ВМАР-1 с клетками костного мозга имеет место благодаря апоптозу. Участокантитела ВМАР-1 переварили пепсиноми очистили с помощьюколонки в виде 2, после чего его ввели внутривенно мышам 57/6 в расчете на одно животное в количестве 33,5 мкг (что соответствует 50 мкг на животное) в результате этого эксперимента было показано, что клетки костного мозга погибают в костном мозге. На основе вышеизложенных данных очевидно, что гибель клеток костного мозга под действием ВМАР-1 не связана ни с зависимой от антитела цитотоксичностью, ни с комплемент-зависимой клеточной цитотоксичностью. В качестве антигена, вызывающего апоптоз, описан белковыйантиген клеточной поверхности при этом экспрессия соответствующихантигену мРНК была обнаружена в тимусе, сердце, печени, легких и яичнике, тогда как в костном мозге был продемонстрирован лишь невысокий уровень мРНК (. ., 148, 1274-1279, 1992), и в этой связи очевидно, что антигены, распознаваемые ВМАР-1, отличны от обычного известногоантигена. Кроме того, с целью выяснения, не представляет ли антиген, распознаваемый ВМАР-1, рецептор ( - фактор некроза опухолевых клеток), исследовали функционирование ВМАР-1 с использованием -929 клеток, реагирующих с , которые вызывают гибель клеток. Конечная концентрация мышиногосоставляла в эксперименте 0,1, 10, 100 пг/мл, а также 1, 10, 100 нг/мл и 1 мкг/мл, тогда как концентрация ВМАР-1 равнялась 0, 10, 100 пг/мл, 1, 10, 100 нг/мл, а также 1, 10 мкг/мл, а количество живых -929 клеток измеряли по методу МТТ на второй день после добавленияи ВМАР-1. Результаты эксперимента, как следует из данных фиг. 16 и 17, показывают, что тогда как под действиемпроисходит выраженное снижение количества -929 клеток, ВМАР-1 такого эффекта на -929 клетки не демонстрирует. Эти результаты наглядно показывают,что антиген, распознаваемый ВМАР-1, не являетсярецептором. Результаты исследования с применением проточной цитометрии (,) с целью выяснения, не представляют ли антигены, распознаваемые ВМАР-1,антигены класса 1 главной системы тканевой совместимости (МНС), представлены на фиг. 18-21. Так, на фиг. 18 показаны результаты анализа контроля с использованием 1 крысы, на фиг. 19 - результаты анализа способности антитела к главной системе тканевой совместимости, класса (крысиный 2, ) связываться с 1 клетками (мышиная лимфома, полученная на основе 5147 клеток), на фиг. 20 приведены данные анализа контроля с использованием 1 крысы , а на фиг. 21 приведены результаты исследования связывающих способностей ВМАР-1 в отношении 1 клеток. На данных фигурах вертикальные оси показывают относительное количество клеток, тогда как на горизонтальных осях приведены данные по интенсивности флюоресценции. Как следует из приведенных результатов, ВМАР-1 не распознает 1 клетки, тогда как антитело из класса 1 главной системы тканевой совместимости (МНС) реагирует с 1 клетками. Как уже было упомянуто выше, экспериментально был подтвержден тот факт, что ВМАР-1 обладает способностью вызывать апоптоз миелоидных клеток в соответствии с тем, что, как известно авторам настоящего изобретения, до настоящего времени отсутст 11 5591 1 вовала какая-либо информация о моноклональных антителах, способных вызывать апоптоз миелоидных клеток, моноклональные антитела настоящего изобретения, обладающие такой функцией, представляют собой новые антитела, открытые настоящими авторами. При этом, поскольку моноклональные антитела настоящего изобретения, представленные ВМАР-1, могут приводить, на основе способности этого моноклонального антитела вызывать апоптоз клеток костного мозга, к гибели рассматриваемых миелоцидных лейкозных клеток, экспрессирующих высокий уровень антигенов, упомянутые моноклональные антитела пригодны для использования в качестве лекарственного средства для лечения миелоцидного лейкоза. Моноклональные антитела настоящего изобретения были подробно описаны выше, в разделе Примера при этом, несмотря на то, что моноклональные антитела, обладающие в соответствии с настоящим изобретением способностью вызывать апоптоз миелоидных клеток, могут быть проиллюстрированы указанными выше примерами, настоящее изобретение ими не ограничено и включает все полученные таким же способом моноклональные антитела, обладающие теми же характеристиками и функциями, вне зависимости от вида антигенов. Поскольку моноклональные антитела по настоящему изобретению могут быть использованы в качестве антител, распознающих и идентифицирующих антигены, вызывающие апоптоз миелоидных клеток, а, кроме того, обладающих способностью непосредственно вызывать апоптоз миелоидных клеток, они могут на основе этого свойства найти применение в медицине в качестве лекарственного препарата для лечения миелоцидного лейкоза. Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20.
МПК / Метки
МПК: C12P 21/08, A61K 39/395, C12N 5/22, C07K 16/00, C12N 15/16
Метки: фрагмент, вызывать, мозга, миелоидных, клеток, свойством, апоптоз, моноклональное, гибридома, f(ab)2, обладающее, антитело, костного
Код ссылки
<a href="https://by.patents.su/14-5591-monoklonalnoe-antitelo-obladayushhee-svojjstvom-vyzyvat-apoptoz-mieloidnyh-kletok-kostnogo-mozga-ego-fab2-fragment-i-gibridoma.html" rel="bookmark" title="База патентов Беларуси">Моноклональное антитело, обладающее свойством вызывать апоптоз миелоидных клеток костного мозга, его F(ab)2 фрагмент и гибридома</a>
Следующий патент: Производные антрациклина и фармацевтическая композиция
Случайный патент: Спеченный фрикционный материал на основе меди