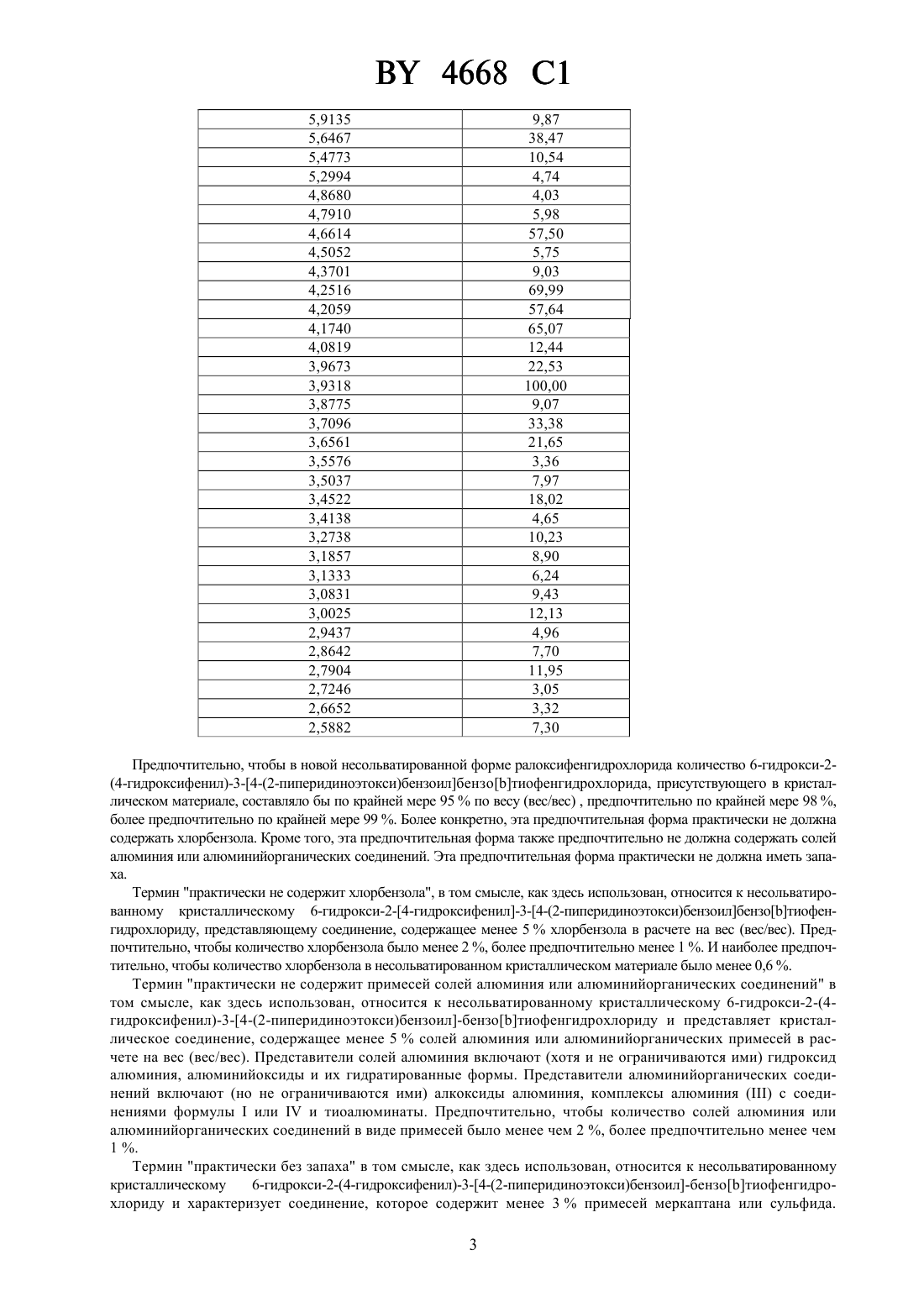
Несольватированный кристаллический 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидиноэтокси)бензоил]бензо[b]тиофенгидрохлорид и фармацевтическая композиция на его основе
Номер патента: 4668
Опубликовано: 30.09.2002
Авторы: ЛЮК, Вейн Дуглас, МАКДЖИЛЛ, Джон Макнейлл, III, ЛАБЕЛЛЬ, Элизабет Смит, МИЛЛЕР, Рендал Скот
Текст
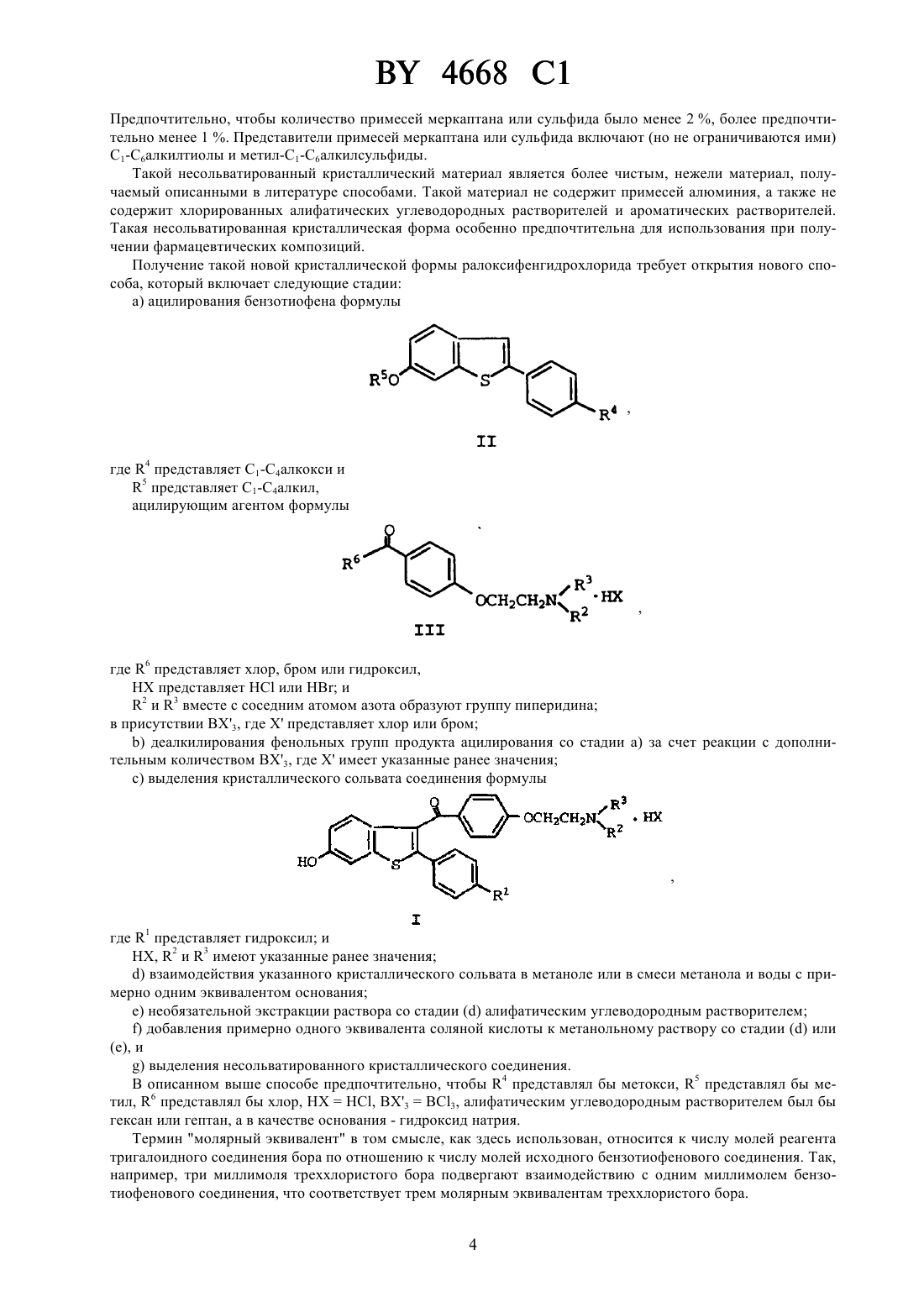
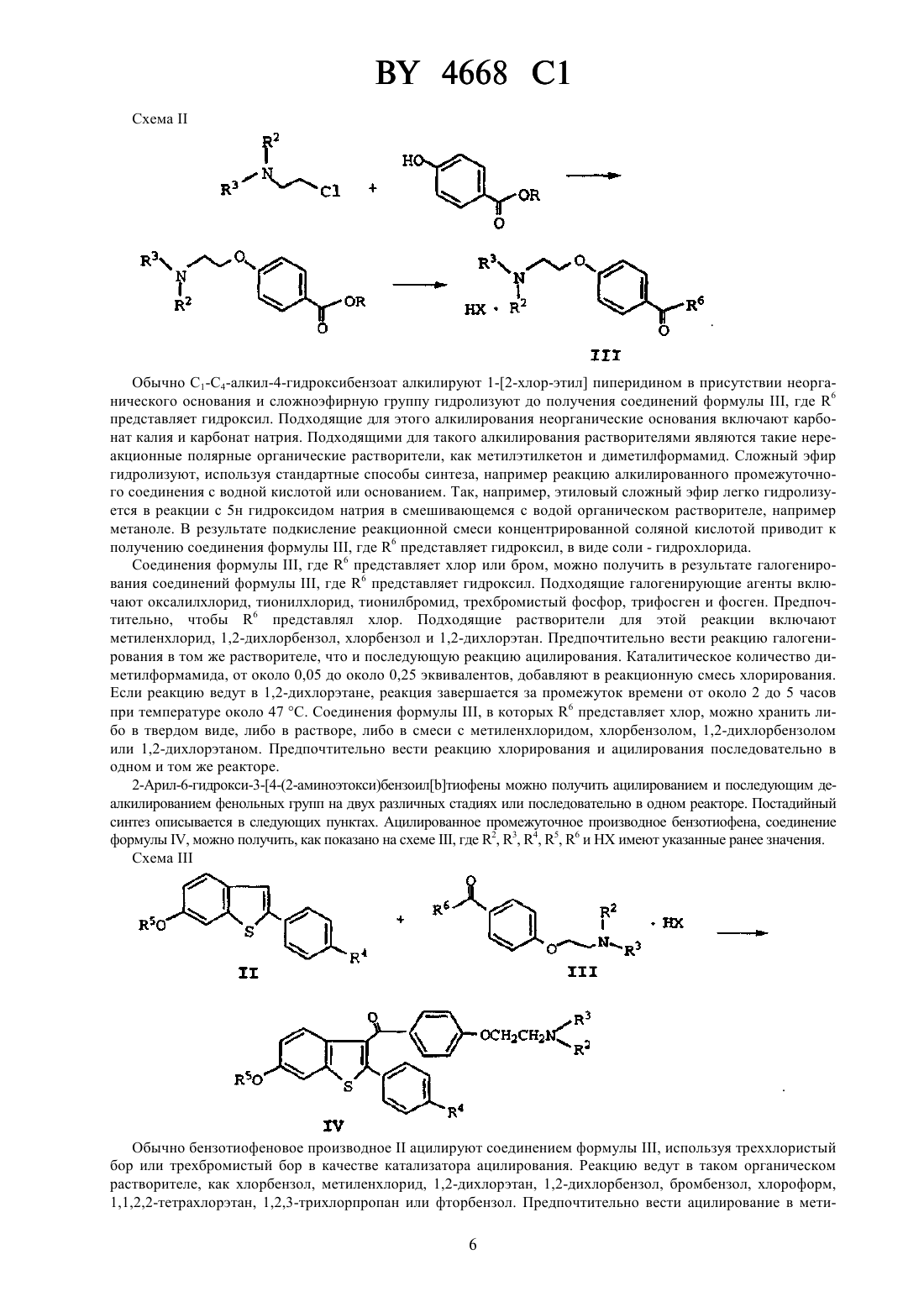
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ НЕСОЛЬВАТИРОВАННЫЙ КРИСТАЛЛИЧЕСКИЙ 6-ГИДРОКСИ-2-(4 ГИДРОКСИФЕНИЛ)-3-4-(2-ПИПЕРИДИНОЭТОКСИ)БЕНЗОИЛБЕНЗОТИОФЕНГИДРОХЛОРИД И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ(71) Заявитель Эли Лилли энд Компани(73) Патентообладатель Эли Лилли энд Компани(57) 1. Несольватированный кристаллический 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорид, который имеет следующую дифракционную картину рентгеновских лучей, полученную с медным излучателем Параметры -линий (ангстремы) 4668 1 3,4522 18,02 3,4138 4,65 3,2738 10,23 3,1857 8,90 3,1333 6,24 3,0831 9,43 3,0025 12,13 2,9437 4,96 2,8642 7,70 2,7904 11,95 2,7246 3,05 2,6652 3,32 2,5882 7,30. 2. Несольватированный кристаллический 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорид по п. 1, отличающийся тем, что количество 6-гидрокси-2-(4 гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида составляет, по меньшей мере, 95 мас. . 3. Фармацевтическая композиция, обладающая антиэстрогенной и антиандрогенной активностью, содержащая эффективное количество несольватированного кристаллического 6-гидрокси-2-(4-гидроксифенил)-34-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида по любому из пп. 1-2 и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. 4. Несольватированный кристаллический 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорид по любому из пп. 1-2, обладающий антиэстрогенной и антиандрогенной активностью. Настоящее изобретение относится к новому фармацевтическому продукту. Более конкретно, оно относится к новой, несольватированной кристаллической форме 2-арил-6-гидрокси-3-4-(2-аминоэтокси)бензоилбензотиофена. В патенте США 4418068 раскрыт 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорид, известный как ралоксифенгидрохлорид, который, как было показано, обладает перспективой применения в качестве фармацевтически активного агента. К сожалению оказалось, что это соединение чрезвычайно трудно получить в чистом виде. Конкретная проблема связана с примесями за счет растворителя. Так,например, в способе получения ралоксифена, описанном в, 27(8), 1057-1066 (1984),серьезным недостатком является то, что получают сольватированное соединение, загрязненное хлорбензолом, который, как известно, является канцерогеном. Далее, другие способы, описанные в .литературе, используют классическое ацилирование Фриделя-Крафтса с алюминийхлоридным катализатором. Получаемый этими способами продукт содержит примесь алюминия и различные побочные продукты - тиоэфиры, которые трудно поддаются удалению. Кроме того, продукт, описанный в этих литературных ссылках, отличается неприятным запахом тиола или сульфида. В соответствии с настоящим изобретением заявители обнаружили, что можно получать новую, несольватированную кристаллическую форму ралоксифена, не содержащую, например, таких примесей, как хлорбензол и алюминий, за счет неизвестного до настоящего времени способа синтеза. Новая кристаллическая форма изобретения демонстрирует дифракционную картину рентгеновских лучей,представленную в табл. 1. Таблица 1 Дифракционная картина рентгеновских лучей для несольватированной кристаллической формы Положение -линий (Ангстрем) 13,3864 9,3598 8,4625 7,3888 6,9907 6,6346 6,1717 5,9975 Предпочтительно, чтобы в новой несольватированной форме ралоксифенгидрохлорида количество 6-гидрокси-2(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида, присутствующего в кристаллическом материале, составляло бы по крайней мере 95 по весу (вес/вес) , предпочтительно по крайней мере 98 ,более предпочтительно по крайней мере 99 . Более конкретно, эта предпочтительная форма практически не должна содержать хлорбензола. Кроме того, эта предпочтительная форма также предпочтительно не должна содержать солей алюминия или алюминийорганических соединений. Эта предпочтительная форма практически не должна иметь запаха. Термин практически не содержит хлорбензола, в том смысле, как здесь использован, относится к несольватированному кристаллическому 6-гидрокси-2-4-гидроксифенил-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлориду, представляющему соединение, содержащее менее 5 хлорбензола в расчете на вес (вес/вес). Предпочтительно, чтобы количество хлорбензола было менее 2 , более предпочтительно менее 1 . И наиболее предпочтительно, чтобы количество хлорбензола в несольватированном кристаллическом материале было менее 0,6 . Термин практически не содержит примесей солей алюминия или алюминийорганических соединений в том смысле, как здесь использован, относится к несольватированному кристаллическому 6-гидрокси-2-(4 гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоил-бензотиофенгидрохлориду и представляет кристаллическое соединение, содержащее менее 5 солей алюминия или алюминийорганических примесей в расчете на вес (вес/вес). Представители солей алюминия включают (хотя и не ограничиваются ими) гидроксид алюминия, алюминийоксиды и их гидратированные формы. Представители алюминийорганических соединений включают (но не ограничиваются ими) алкоксиды алюминия, комплексы алюминияс соединениями формулыилии тиоалюминаты. Предпочтительно, чтобы количество солей алюминия или алюминийорганических соединений в виде примесей было менее чем 2 , более предпочтительно менее чем 1 . Термин практически без запаха в том смысле, как здесь использован, относится к несольватированному кристаллическому 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоил-бензотиофенгидрохлориду и характеризует соединение, которое содержит менее 3 примесей меркаптана или сульфида. 3 4668 1 Предпочтительно, чтобы количество примесей меркаптана или сульфида было менее 2 , более предпочтительно менее 1 . Представители примесей меркаптана или сульфида включают (но не ограничиваются ими) С 1-С 6 алкилтиолы и метил-С 1-С 6 алкилсульфиды. Такой несольватированный кристаллический материал является более чистым, нежели материал, получаемый описанными в литературе способами. Такой материал не содержит примесей алюминия, а также не содержит хлорированных алифатических углеводородных растворителей и ароматических растворителей. Такая несольватированная кристаллическая форма особенно предпочтительна для использования при получении фармацевтических композиций. Получение такой новой кристаллической формы ралоксифенгидрохлорида требует открытия нового способа, который включает следующие стадии а) ацилирования бензотиофена формулы, где 6 представляет хлор, бром или гидроксил, представляетилии 2 и 3 вместе с соседним атомом азота образуют группу пиперидина в присутствии 3, гдепредставляет хлор или бром) деалкилирования фенольных групп продукта ацилирования со стадии а) за счет реакции с дополнительным количеством 3, гдеимеет указанные ранее значения) выделения кристаллического сольвата соединения формулы, 2 и 3 имеют указанные ранее значения) взаимодействия указанного кристаллического сольвата в метаноле или в смеси метанола и воды с примерно одним эквивалентом основания) необязательной экстракции раствора со стадииалифатическим углеводородным растворителем) добавления примерно одного эквивалента соляной кислоты к метанольному раствору со стадииили) выделения несольватированного кристаллического соединения. В описанном выше способе предпочтительно, чтобы 4 представлял бы метокси, 5 представлял бы метил, 6 представлял бы хлор,, 3 ВС 3, алифатическим углеводородным растворителем был бы гексан или гептан, а в качестве основания - гидроксид натрия. Термин молярный эквивалент в том смысле, как здесь использован, относится к числу молей реагента тригалоидного соединения бора по отношению к числу молей исходного бензотиофенового соединения. Так,например, три миллимоля треххлористого бора подвергают взаимодействию с одним миллимолем бензотиофенового соединения, что соответствует трем молярным эквивалентам треххлористого бора. 4 4668 1 Термин сольват означает агрегат, который содержит одну или более из молекул такого растворенного вещества, как соединение формулы , с молекулой растворителя. Представительные сольваты образуются с хлорбензолом и 1,2-дихлорэтаном. В новом способе, который используют для получения новой кристаллической формы настоящего изобретения,используют треххлористый бор или трехбромистый бор в качестве катализатора ацилирования вместо алюминийхлорида, как указано в известных из литературы способах получения ралоксифена. С алюминийхлоридом трудно работать, особенно в промышленном масштабе. Кроме того, для ацилирования или деалкилирования необходимо большое количество алюминийхлорида, обычно шесть эквивалентов. Алюминийхлорид образует большое количество побочных продуктов, которые вовлекаются в процесс осаждения продукта и которые затем трудно удалить из фармацевтически активных 2-арил-6-гидрокси-3-4-(2-аминоэтокси)бензоилбензо-тиофенов. Реакции, катализируемые алюминийхлоридом, обычно являются реакциями гетерогенной смеси. Описанный выше способ является гомогенным, и побочные продукты бора являются растворимыми в используемых на дальнейших стадиях растворителях. Далее, деалкилирование, катализируемое алюминийхлоридом, требует добавления меркаптана или сульфида для расщепления алкиларилэфира, что приводит к образованию диалкилсульфидов, которые обладают неприятным запахом. Эти меркаптаны или сульфиды можно удалить за счет перекристаллизации, однако в результате получается растворитель перекристаллизации с пахучими примесями. Новый способ исключает применение алюминия и применение меркаптанов и сульфидов с неприятным запахом. Известными ранее способами получали большое количество родственных соединений и много остаточных солей алюминия в конечном продукте. Примеры родственных веществ включают 6-гидрокси-2-(4-метоксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофен, 2-(4-гидроксифенил)-6-метокси-3-4-(2-пиперидиноэтокси) бензоилбензотиофен, 6-гидрокси-3-(4-гидроксибензоил)-2-(4-гидроксифенил)бензо-тиофен, пропил-4-(2-пиперидиноэтокси)тиобензоат, метил-4-(2-пиперидиноэтокси)бензоат, 6 гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоил-5-4-(2-пиперидиноэтокси)бензоил-бензотиофен и 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоил-7-4-(2-пиперидиноэтокси)бензоилбензо-тиофен. Побочные продукты, содержащие бор, легко удалить из конечного продукта. Кроме того, новый способ позволяет избежать удаления отработанных соединений алюминия. Если реакцию ведут в 1,2-дихлорэтане, реакции являются гомогенными, что позволяет использовать более высокие концентрации и получать кристаллические сольваты, которые легко выделять. Соединения формули , исходные материалы настоящего изобретения, можно получить, используя известные методы органического синтеза. Исходное соединение формулыможно легко получить по схеме синтеза, которая изображена на схемеи проиллюстрирована в примере получения 1 Схема Соединения формулы , где 4 представляет С 1-С 4 алкокси, а 5 представляет С 1-С 4 алкил, можно получить, вначале подвергая взаимодействию 3-алкоксибензолтиол с 4-алкоксифенацилбромидом в присутствии сильного основания. Подходящие основания для этого превращения включают (но не ограничиваются ими) гидроксид калия и гидроксид натрия. Реакцию обычно ведут в этаноле или в смеси воды и этанола при температуре от около 0 до около 50 . Следующая стадия является циклизацией 3-алкокси-фенилфенацилсульфида. Циклизацию обычно ведут, нагревая 3-алкоксифенилфенацилсульфид в полифосфорной кислоте. Обычно циклизацию ведут при температуре от около 80 до около 120 , предпочтительно от 85 до 90 . Бензотиофен формулыобычно очищают за счет перекристаллизации. Так, например, если 4 представляет метокси,5 представляет метил, соединение формулыможно перекристаллизовать из этилацетата. Ацилирующий агент для рассматриваемого способа, соединение формулы , можно получить, как показано на схеме , где 2, 3, 6 иимеют указанные ранее значения,представляет С 1-С 4 алкил. Обычно С 1-С 4-алкил-4-гидроксибензоат алкилируют 1-2-хлор-этил пиперидином в присутствии неорганического основания и сложноэфирную группу гидролизуют до получения соединений формулы , где 6 представляет гидроксил. Подходящие для этого алкилирования неорганические основания включают карбонат калия и карбонат натрия. Подходящими для такого алкилирования растворителями являются такие нереакционные полярные органические растворители, как метилэтилкетон и диметилформамид. Сложный эфир гидролизуют, используя стандартные способы синтеза, например реакцию алкилированного промежуточного соединения с водной кислотой или основанием. Так, например, этиловый сложный эфир легко гидролизуется в реакции с 5 н гидроксидом натрия в смешивающемся с водой органическом растворителе, например метаноле. В результате подкисление реакционной смеси концентрированной соляной кислотой приводит к получению соединения формулы , где 6 представляет гидроксил, в виде соли - гидрохлорида. Соединения формулы , где 6 представляет хлор или бром, можно получить в результате галогенирования соединений формулы , где 6 представляет гидроксил. Подходящие галогенирующие агенты включают оксалилхлорид, тионилхлорид, тионилбромид, трехбромистый фосфор, трифосген и фосген. Предпочтительно, чтобы 6 представлял хлор. Подходящие растворители для этой реакции включают метиленхлорид, 1,2-дихлорбензол, хлорбензол и 1,2-дихлорэтан. Предпочтительно вести реакцию галогенирования в том же растворителе, что и последующую реакцию ацилирования. Каталитическое количество диметилформамида, от около 0,05 до около 0,25 эквивалентов, добавляют в реакционную смесь хлорирования. Если реакцию ведут в 1,2-дихлорэтане, реакция завершается за промежуток времени от около 2 до 5 часов при температуре около 47 . Соединения формулы , в которых 6 представляет хлор, можно хранить либо в твердом виде, либо в растворе, либо в смеси с метиленхлоридом, хлорбензолом, 1,2-дихлорбензолом или 1,2-дихлорэтаном. Предпочтительно вести реакцию хлорирования и ацилирования последовательно в одном и том же реакторе. 2-Арил-6-гидрокси-3-4-(2-аминоэтокси)бензоилтиофены можно получить ацилированием и последующим деалкилированием фенольных групп на двух различных стадиях или последовательно в одном реакторе. Постадийный синтез описывается в следующих пунктах. Ацилированное промежуточное производное бензотиофена, соединение формулы , можно получить, как показано на схеме , где 2, 3, 4, 5, 6 иимеют указанные ранее значения. Схема Обычно бензотиофеновое производноеацилируют соединением формулы , используя треххлористый бор или трехбромистый бор в качестве катализатора ацилирования. Реакцию ведут в таком органическом растворителе, как хлорбензол, метиленхлорид, 1,2-дихлорэтан, 1,2-дихлорбензол, бромбензол, хлороформ,1,1,2,2-тетрахлорэтан, 1,2,3-трихлорпропан или фторбензол. Предпочтительно вести ацилирование в мети 6 4668 1 ленхлориде, хлорбензоле или 1,2-дихлорэтане. Более предпочтительно проводить стадию ацилирования в метиленхлориде. Скорость ацилирования соединения формулыи скорость деалкилирования фенольных эфиров формулименяются в зависимости от выбора растворителя, температуры реакции и выбора тригалоида бора. Так как соединения формулысодержат одну или более из незащищенных фенольных групп,их нелегко ацилировать в таких условиях и степень деалкилирования следует свести к минимуму. Так как трехбромистый бор наиболее предпочтителен для деалкилирования фенольных эфиров, предпочтительным тригалоидом бора для катализа ацилирования является треххлористый бор. Для реакций с катализатором треххлористым бором в метиленхлориде реакцию ацилирования можно вести при комнатной температуре с минимальным деалкилированием соединений формули . В других растворителях реакцию ацилирования ведут при более низких температурах, таких как -10 до 10 , для того, чтобы свести к минимуму степень деалкилирования в реакции исходных материалов и продукта. Если 6 представляет хлор, для реакции ацилирования необходимы по крайней мере 2 молярных эквивалента такого реагента, как тригалоид бора. Если в качестве ацилирующего агента используют бензойную кислоту (6 ОН), тогда обычно используют пять эквивалентов тригалоида бора. Соединение формулыможно выделить в виде соли - гидробромида или гидрохлорида, или в виде свободного основания. В постадийном способе ацилированное промежуточное соединение (соединение формулы ) деалкилируют до получения соединения формулы , как показано на схеме , где 1, 2, 3, 4, 5 иимеют указанные ранее значения. Схема Соединение формулыможно получить при взаимодействии гидрохлоридной или гидробромидной соли соединения формулыс трехбромистым бором или треххлористым бором. Предпочтительным тригалоидом бора для деалкилирования является трехбромистый бор. Такую реакцию деалкилирования можно вести в различных органических растворителях, таких как метиленхлорид, 1,2-дихлорэтан, хлороформ, 1,1,2,2 тетрахлорэтан, 1,2,3-трихлорпропан, 1,2-дихлорбензол или фторбензол. Предпочтительным растворителем является 1,2-дихлорэтан. Если в качестве исходного соединения используют соль присоединения кислоты,количество побочного продукта, образующегося при деалкилировании аминоэтильной группы, сводится к минимуму. Если в качестве растворителя используют метиленхлорид, а реагентом бора является треххлористый бор, реакцию обычно ведут при температуре от около 55 до около 75 , получая соединение формулыбез заметного отщепления аминоэтильной группы. В таких других растворителях, как хлороформ,1,2-дихлорэтан, 1,2-дихлорбензол или фторбензол, деалкилирование происходит легко при температуре окружающей среды. Так, например, если растворителем является 1,2-дихлорэтан, реакцию обычно ведут при 25-35 С без заметного отщепления аминоэтильной группы. Для завершения реакции в разумное время обычно используют четыре эквивалента реагента - тригалоида бора. Предпочтительно получать соединения формулыв реакции в одном реакторе, синтезируя их из соединений формули , как представлено на схеме , где 1, 2, 3, 4, 5, 6 иимеют указанные ранее значения. Бензотиофен соединения формулыацилируют соединением формулыв присутствии треххлористого бора или трехбромистого бора треххлористый бор предпочтителен для способа в одном реакторе. Реакцию можно вести в таких различных органических растворителях, как хлороформ, метиленхлорид, 1,2 дихлорэтан, 1,2,3-трихлорпропан, 1,1,2,2-тетрахлорэтан, 1,2-дихлорбензол или фторбензол. Предпочтительным растворителем для этого синтеза является 1,2-дихлорэтан. Реакцию ведут при температуре от около 10 до около 10 , предпочтительно при 0 . Реакцию лучше вести при концентрациях бензотиофенового соединения формулыот около 0,2 М до около 1,0 . Реакция ацилирования обычно завершается примерно через два-восемь часов. Ацилированный бензотиофен соединения формулыпревращают в соединение формулыбез выделения. Это превращение осуществляют, добавляя дополнительное количество тригалоида бора и нагревая реакционную смесь. Предпочтительно добавлять от двух до пяти эквивалентов треххлористого бора к реакционной смеси, более предпочтительно три молярных эквивалента. Эту реакцию ведут при температуре около 25-40 С, предпочтительно при 35 . Обычно реакция завершается спустя примерно 4-48 часов. Реакцию ацилирования/деалкилирования гасят спиртом или смесью спиртов. Подходящие для целей гашения реакции спирты включают метанол, этанол и изопропанол. Предпочтительно, реакционную смесь ацилирования/деалкилирования добавлять к 955 смеси этанола и метанола (3 А). 3 А этанол может быть комнатной температуры или может быть нагрет до кипения с обратным холодильником, предпочтительно при кипении с обратным холодильником. Если реакцию гасят таким образом, соединение формулылегко кристаллизуется из полученной спиртовой смеси. Обычно используют 1,25-3,75 мл спирта на миллимоль исходного бензотиофена. Если используют 3, кристаллический продукт этого процесса в одном реакторе выделяют в виде сольвата гидрохлоридной соли. Такие кристаллические сольваты получают в различных условиях. Обычно форма продукта, получаемого таким способом, определяется выбором растворителя ацилирования/деалкилирования, тригалоида бора и условий обработки. Так, например, если растворителем ацилирования/деалкилирования служит 1,2-дихлорэтан, 1,2,3-трихлорпропан или фторбензол, выделяемый продукт представляет собой кристаллический сольват, содержащий 1,2-дихлорэтан, 1,2,3-трихлорпропан или фторбензол, соответственно. Наиболее подходящим сольватом соединения формулыявляется сольват 1,2-дихлорэтана. Этот сольват получают, проводя процесс ацилирования/деалкилирования в одном реакторе в 1,2-дихлорэтане. Если 1 представляет гидроксил, 2 и 3 вместе с соседним атомом азота образует группу пиперидина, апредставляет , тогда сольват 1,2-дихлорэтана может существовать в двух различных формах. Одна форма кристаллического сольвата, называемая кристаллической формой , получается, когда катализируемую треххлористым бором реакцию ацилирования/деалкилирования гасят этанолом. Предпочтительно использовать смесь этанола и метанола (955) при получении этой кристаллической формы. Такой конкретный кристалл характеризуется дифракционной картиной рентгеновских лучей, представленной в табл. 2. Таблица 2 Дифракционная картина рентгеновских лучей для кристаллической формыПоложение -линий (Ангстрем) 4668 1 7,2701 5,06 6,5567 70,77 6,2531 6,79 5,5616 24,05 5,3879 100,00 5,0471 89,64 4,7391 85,96 4,6777 39,36 4,6332 62,60 4,5191 77,56 4,2867 36,82 4,2365 41,66 4,1816 49,60 4,0900 11,28 3,9496 11,85 3,7869 36,25 3,7577 56,16 3,6509 40,62 3,5751 15,65 3,5181 21,52 3,4964 18,53 3,4361 33,60 3,3610 6,21 3,3115 4,95 3,2564 7,36 3,2002 3,80 3,1199 15,77 3,0347 14,84 2,8744 9,67 2,8174 10,82 2,7363 11,51 Количество 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида,находящееся в этом кристаллическом материале, составляет около 87,1 по данным жидкостной хроматографии высокого разрешения (ЖХВР), что раскрыто далее. Количество 1,2-дихлорэтана, присутствующее в этом кристаллическом материале, составляет около 0,55 молярных эквивалента по данным спектроскопии протонного ядерного магнитного резонанса. Крупный, аналитически чистый отдельный кристалл формысольвата 1,2-дихлорэтана получают для анализа дифракции рентгеновских лучей отдельного кристалла. Такой отдельный кристалл получают, помещая насыщенный метанольный раствор 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоил-бензотиофенгидрохлорида в атмосферу, насыщенную 1,2-дихлорэтаном (пример 6). Получают всего 8419 рефлексов для 2 менее 116 и их используют для определения структуры. По данным дифракции рентгеновских лучей четко видно, что кристаллический материал представляет собой сольват 1,2-дихлорэтана с отношением числа молекул растворителя к растворенному материалу 12. Теоретический спектр дифракции рентгеновских лучей порошка, рассчитанный на основании данных для дифракционной картины отдельного кристалла, идентичен тому, который представлен в табл. 2, что свидетельствует об идентичности обоих сольватов. Новая, несольватированная кристаллическая форма 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоил-бензотиофенгидрохлорида, представленная в настоящем изобретении, предпочтительна для применения в фармацевтических композициях, так как в ней отсутствует растворитель, который может оказать вредное воздействие на пациента. Эту кристаллическую форму можно получить в результате перекристаллизации сольватированной гидрохлоридной соли, получаемой в процессе ацилирования/деалкилирования, описанного ранее и катализируемого треххлористым бором. Обычно сольватированную гидрохлоридную соль добавляют к раствору гидроксида натрия в метаноле или в смеси метанола и воды. Используют по крайней мере один эквивалент основания для растворения и для обеспечения того, чтобы гидрохлоридная соль была бы превращена в свободное основание. Необязательно добавляют активированный уголь к полученному раствору, чтобы облегчить удаление примесей. Полученную смесь фильтруют для удаления активированного угля, если он присутствует, а также всех нерастворимых примесей. Полученный фильтрат необязательно экстрагируют алифатическим углеводородным растворителем, таким как гексан или гептан, для удаления части оставшегося растворителя, который был использован в реакции ацилирования/деалкилирования. Стадия экстракции необходима, если реакцию ацилирования/деалкилирования ведут в таких ароматических растворителях, как о-дихлорбензол. Метанольный раствор подкисляют соляной кисло 9 4668 1 той, например газообразной или водной соляной кислотой, вызывая кристаллизацию 6-гидрокси-2-(4 гидроксифенил)-3-4-(2-пиперидиноэтоксибензоил)-бензотиофена в виде несольватированной гидрохлоридной соли. Полученную кристаллическую суспензию предпочтительно перемешивают при температуре окружающей среды в течение около 1-2 часов, чтобы обеспечить завершение кристаллизации. Несольватированную кристаллическую форму выделяют фильтрованием с последующей сушкой в вакууме. Нижеследующие примеры иллюстрируют далее настоящее изобретение. Эти примеры не предназначены для того, чтобы ограничить объем изобретения каким-либо образом. Все эксперименты по ацилированию и деалкилированию ведут при положительном давлении сухого азота. Все растворители и реагенты используют сразу по получении. Проценты обычно выражаются как весовые проценты (вес/вес), за исключением растворителей ЖХВР, которые рассчитывают в расчете на объем (объем/объем). Данные протонного ядерного магнитного резонанса (1 ЯМР) получены на спектрометре-300 с рабочей частотой 300,135 МГц. Температуры плавления определяют с помощью дифференциального сканирующего калориметра в ТА приборе 2920, используя закрытую кювету при скорости нагревания 2 С/минуту. Дифракционный спектр рентгеновских лучей для порошков получают на рентгеновском порошковом дифрактометре 5000, используя излучение меди идетектор. За окончанием реакции обычно следят с помощью жидкостной хроматографии высокого разрешения(ЖХВР). За реакцией получения хлорангидрида, соединения формулы , где 6 представляет хлор, следят с помощью-8 колонки (25 см 4,6 мм внутр.д., 5 мкм размер частиц), элюируя смесью 60 мМ фосфата (24) и 10 мМ октансульфоната (рН 2,0)/ацетонитрила (6040). Соединение формулыобрабатывают метанолом и анализируют, используя в качестве стандарта для сравнения метиловый сложный эфир. Реакцию контролируют, добавляя около 0,3 мл раствора хлорангидрида к 1 мл метанола ВЭЖХ степени чистоты. Полученную смесь интенсивно встряхивают и оставляют реагировать. Через 30 минут добавляют 6 мл ацетонитрила, а затем разбавляют до 100 мл указанным ранее элюентом. За завершением реакций ацилирования, деалкилирования или ацилирования/деалкилирования следят с помощью ВЭЖХ. Образцы реакционной смеси анализируют, используя колонку-8 (25 см 4,6 мм внутр.д., 5 мкм размер частиц), используя в качестве элюента градиент системы растворителей, представленный ниже. Градиент системы растворителей Время (мин) А В 0 60 40 5 60 40 10 45 55 20 38 62 25 45 55 32 45 55 37 60 40 42 60 40 А 0,05 М 4 (2,0). В ацетонитрил. Реакционную смесь анализируют, разбавляя 0,1-0,2 мл образец до объема 50 мл смесью 6040 А/В. Аналогично, маточный раствор перекристаллизации исследуют, отбирая образцы. Количество (в процентах) 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида в кристаллическом материале (степень чистоты) определяют следующим образом. Образец кристаллического твердого вещества (5 мг) взвешивают в 100-мл мерной колбе и растворяют в смеси 70/30 (объем/объем) 75 мМ буфера фосфата калия (рН 2,0) и ацетонитрила. Аликвот этого раствора (10 мкл) анализируют с помощью жидкостной хроматографии высокого разрешения, используя колонку-8 (25 см 4,6 мм внутр.д., размер частиц 5 мкм) и детектор УФ (280 нм). При этом используют следующий градиент системы растворителей. Градиент системы растворителей (чистота) Время (мин) А В 0 70 30 12 70 30 14 25 75 16 70 30 25 70 30 А 75 мМ 24 буфер (рН 2,0). В ацетонитрил. 4668 1 Процентное содержание 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида в образце рассчитывают, используя площадь пика, наклони отсекаемый отрезоккалибровочной кривой, по следующему уравнению площадь пикаобъем образца (мл)чистоты вес образца (мг ) Процентное содержание растворителя, такого как метанол, этанол или 1,2-дихлорэтан, присутствующего в кристаллическом материале, определяют с помощью газовой хроматографии. Образец твердого кристаллического вещества (50 мг) взвешивают в 10-мл мерной колбе и растворяют в растворе 2-бутанола (0,025 мг/мл) в диметилсульфоксиде. Образец этого раствора анализируют с помощью газовой хроматографии, используя колонку(30 м 0,52 мм внутр.д., размер частиц 1 мкм), при скорости потока 10 мл/мин с пламенно-ионизационным детектором. Температуру колонки повышают с 35 до 230 за 12 минут. Количество растворителя определяют по сравнению с внутренним стандартом (2-бутанолом), используя следующую формулу где С - отношение растворителя в образце, - среднее отношение стандарта для конкретного растворителя, - средний вес стандарта, - вес образца (мг), - объем образца (10 мл), - объем стандарта (10,000 мл), - чистота стандарта . Пример получения 1. 6-Метокси-2-(4-метоксифенил)бензо-тиофен Раствор 3-метоксибензолтиола (100 г) и гидроксида калия (39,1 г) в 300 мл воды добавляют к денатурированному этанолу (750 мл) и полученную смесь охлаждают примерно до 0 . Эту холодную смесь обрабатывают 4-метоксифенацилбромидом (164 г) несколькими небольшими порциями. После завершения добавления полученную смесь охлаждают еще 10 минут, затем дают ей нагреться до комнатной температуры. Через три часа эту смесь концентрируют в вакууме, а остаток обрабатывают водой (200 мл) . Полученную смесь обрабатывают этилацетатом и фазы разделяют. Органическую фазу промывают дважды водой, раствором бикарбоната натрия тоже дважды и дважды раствором хлорида натрия. Органическую фазу сушат над сульфатом магния, фильтруют и выпаривают досуха в вакууме до получения 202 г -(3 метоксифенилтио)-4-метоксиацетофенона. Неочищенный продукт кристаллизуют из метанола и промывают гексаном до получения 158 г вещества. .плавления 53 . 930 г полифосфорной кислоты нагревают до 85 и обрабатывают промежуточным продуктом, полученным ранее (124 г), небольшими порциями за 30 минут. После завершения добавления полученную смесь перемешивают при 90 . Еще спустя 45 минут реакционной смеси дают остыть до комнатной температуры. Полученную смесь обрабатывают измельченным льдом, охлаждая смесь на ледяной бане. Полученную смесь обрабатывают водой (100 мл), в результате чего образуется светло-розовый осадок. Этот осадок выделяют фильтрованием, промывают водой и метанолом и сушат в вакууме при 40 до получения 119 г 6-метокси 1-(4-метоксифенил)бензотиофена. Этот неочищенный продукт суспендируют в горячем метаноле, фильтруют и промывают холодным метанолом. Полученный твердый материал перекристаллизовывают из этилацетата (4 л), фильтруют, промывают гексаном и сушат в вакууме до получения 68 г указанного в заглавии соединения. .плавления 187-190,5 . Пример получения 2. Этил-4-(2-пиперидиноэтокси)бензоат Смесь этил-4-гидроксибензоата (8,31 г), 1-(2-хлорэтил)-пиперидинмоногидрохлорида (10,13 г), карбоната калия (16,59 г) и 60 мл метилэтилкетона нагревают до 80 . Спустя один час полученную смесь охлаждают до 55 и обрабатывают дополнительным количеством 1-(2-хлорэтил)пиперидинмоногидрохлорида (0,92 г). Полученную смесь нагревают до 80 . За реакцией следят с помощью тонкослойной хроматографии ,используя пластины силикагеля и смесь этилацетат/ацетонитрил/триэтиламин (1061 объем/объем). Добавляют дополнительную порцию 1-(2-хлорэтил)-пиперидингидрохлорида до исчерпания исходного 4-гидроксибензоатного сложного эфира. После завершения реакции реакционную смесь обрабатывают водой (60 мл) и оставляют остывать до комнатной температуры. Водный слой сливают, а органический слой концентрируют в вакууме при 40 и 40 мм рт.ст. Полученное масло используют на следующей стадии без дополнительной очистки. 4668 1 Пример получения 3. 4-(2-Пиперидиноэотокси)бензойной кислоты гидрохлорид Раствор соединения, полученного в примере получения 2, (около 13,87 г) в 30 мл метанола обрабатывают 5 н гидроксидом натрия (15 мл) и нагревают до 40 . Спустя 4,5 часа добавляют 40 мл воды. Полученную смесь охлаждают до 5-10 и медленно добавляют концентрированную соляную кислоту (18 мл). В процессе подкисления кристаллизуется указанное в заглавии соединение. Кристаллический продукт собирают фильтрованием и сушат в вакууме при 40-50 до получения 83 выхода указанного в заглавии соединения. .плавления 270-271 . Пример получения 4. 4-(2-Пиперидиноэтокси)бензоилхлорида гидрохлорид Раствор соединения, полученного по способу примера получения 3 (30,01 г), и 2 мл диметилформамида в 500 мл метиленхлорида обрабатывают оксалилхлоридом (10,5 мл) в течение 30-35 минут. После перемешивания в течение примерно 18 часов реакционную смесь анализируют на предмет завершения реакции с помощью ВЭЖХ. Если в смеси еще присутствует исходная карбоновая кислота, добавляют дополнительно оксалилхлорид. После завершения реакции реакционный раствор выпаривают досуха в вакууме. Остаток растворяют в 200 мл метиленхлорида и полученный раствор выпаривают досуха. Эту процедуру растворения/выпаривания повторяют до получения указанного в заглавии соединения в виде твердого вещества. Указанное в заглавии соединение можно хранить в виде твердого вещества или в виде 0,2 М раствора в 500 мл метиленхлорида. Пример 1. 6-Метокси-2-(4-метоксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорид Смесь соединения, полученного по способу примера получения 1 (8,46 г), и хлорангидрида, полученного по способу примера получения 3 (10,0 г) в 350 мл метиленхлорида охлаждают примерно до 20-25 . Охлажденную смесь обрабатывают треххлористым бором (2,6 мл) и все это механически перемешивают. За реакцией следят с помощью ВЭЖХ, используя указанный ранее анализ. Спустя 85 минут по данным ВЭЖХвыход в расчете на 6-метокси-2-(4-метоксифенил)-3-4-(2-пиперидиноэтокси)бензоил-бензотиофеновый стандарт составляет 88 . Пример 2. 6-Гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида 1,2 дихлорэтановый сольват (кристаллическая форма ) Раствор 6-метокси-2-(4-метоксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида (2,0 г) в 20 мл 1,2-дихлорэтана обрабатывают треххлористым бором (2,0 мл). Полученную смесь перемешивают при 35 в течение 18 часов. Смесь этанола и метанола (10 мл, 955, 3 А) обрабатывают полученной реакционной смесью, что приводит к кипению с обратным холодильником спиртовой смеси. После завершения добавления образовавшуюся кристаллическую суспензию перемешивают при 25 . Спустя час кристаллический продукт отфильтровывают, промывают холодным этанолом (10 мл) и сушат при 40 в вакууме до получения 1,78 г указанного в заглавии соединения. Дифракционная картина рентгеновских лучей порошка идентична картине, приведенной в табл. 1. .плавления 255 . Степень чистоты 80,2 . 1,2-дихлорэтан 7,5(по данным газовой хроматографии). Пример 3. 6-Гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида 1,2-дихлорэтановый сольват (кристаллическая форма ) Смесь соединения, полученного, как указано в примере получения 2 (15 г), и диметилформамида (0,2 мл) в 250 мл 1,2-дихлорэтана охлаждают до 0 . 8,25 мл фосгена конденсируют в холодной воронке (снабженной рубашкой) (-10 ) и добавляют к холодной смеси за 2 минуты. Полученную смесь нагревают примерно до 47 . Спустя два с половиной часа реакционную смесь анализируют с помощью ВЭЖХ. Для завершения реакции может понадобиться добавление дополнительного фосгена. Избыток фосгена удаляют вакуумной перегонкой при 30-32 и давлении 105-110 мм рт.т. Спустя примерно три-четыре часа реакционный раствор обрабатывают соединением, полученным, как указано в примере получения 1 (13,52 г). Полученный раствор охлаждают до 0 . Треххлористый бор (12,8 мл) конденсируют в мерном цилиндре и добавляют к холодной реакционной смеси. Спустя восемь часов при 0 реакционный раствор обрабатывают дополнительным количеством треххлористого бора (12,8 мл). Полученный раствор нагревают до 30 . Через 15 часов реакционную смесь контролируют с помощью ЖХВР. Смесь этанола и метанола (125 мл, 955, 3 А) нагревают до кипения с обратным холодильником и обрабатывают реакционным раствором, полученным ранее, в течение 60 минут. После завершения добавления колбу для реакции ацилирования/деметилирования промывают дополнительным количеством этанола (30 мл). Полученную суспензию оставляют охлаждаться до комнатной температуры при перемешивании. Через час при комнатной температуре отфильтровывают кристаллический продукт, промывают его этанолом (75 мл) и 4668 1 сушат при 40 в вакууме до получения 25,9 г указанного в заглавии соединения. Дифракционная картина рентгеновских лучей порошка представлена в табл. 1. Т.плавления 261 . Степень чистоты 87,1. 1,2-дихлорэтан 0,55 молярных эквивалентов (1 ЯМР). Пример 4. 6-Гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофен-гидрохлорида 1,2-дихлорэтановый сольват (кристаллическая форма ) Смесь соединения, полученного, как указано в примере получения 1 (2,92 г), соединения, полученного,как указано в примере получения 4 (3,45 г), и 1,2-дихлорэтана (52 мл) охлаждают до примерно 0 . Треххлористый бор конденсируют в холодный мерный цилиндр (2,8 мл) и добавляют к указанной холодной смеси. Через 8 часов при 0 реакционную смесь обрабатывают дополнительным количеством треххлористого бора (2,8 мл). Полученный раствор нагревают до 35 . Спустя 16 часов реакция завершается. 30 мл метанола обрабатывают реакционной смесью, полученной ранее, в течение 20 минут, что приводит к кипению метанола с обратным холодильником. Полученную суспензию перемешивают при 25 . Спустя час кристаллический продукт отфильтровывают, промывают холодным метанолом (8 мл) и сушат при 40 в вакууме до получения 5,14 г указанного в заглавии соединения. Из-за различий в условиях обработки кристаллический сольват отличается от сольвата, полученного в примере 3. .плавления 225 . Степень чистоты 86,8 . 1,2-дихлорэтан 6,5(по данным газовой хроматографии). Пример 5. 6-Гидрокси-2-4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорид Соединение, полученное по способу примера 3 (4,0 г), суспендируют в 30 мл метанола при комнатной температуре. Полученную смесь обрабатывают раствором гидроксида натрия (0,313 г) в 10 мл метанола. После завершения растворения к раствору добавляют активированный уголь(0,4 г,-60,. ., ., ). Через 30 минут суспензию отфильтровывают через фильтровальную бумагу Ватман 1, предварительно покрытую диатомовой землей (,. .). Фильтровальную лепешку промывают метанолом (10 мл). Объединенные фильтраты обрабатывают (каплями) 2 н соляной кислоты (4 мл). Полученную суспензию перемешивают в течение 60 минут при комнатной температуре и фильтруют. Фильтровальную лепешку промывают холодным метанолом (14 мл, 0 ) и сушат в вакууме при 60 в течение около 18 часов до получения 3,00 г грязно-белого свободно пересыпающегося порошка. Т.плавления 262 . Дифракционная картина рентгеновских лучей порошка такая же, как и представленная в табл. 1. Степень чистоты 99,1 . Родственные вещества 0,85 . Пример 6. 6-Гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида 1,2-дихлорэтановый сольват (кристаллическая форма ) Насыщенный раствор 6-гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорида получают при перемешивании суспензии соединения, полученного по способу примера 5, в метаноле при комнатной температуре в течение ночи. Полученную смесь отфильтровывают(фильтровальная бумага Ватман 1). Часть фильтрата (20-25 мл) помещают в колбу Эрленмейера емкостью 50 мл. Эту колбу помещают в стеклянный сосуд (8,510 см), содержащий 1,2-дихлорэтан (около 10 мл). Этот сосуд герметизируют и все это оставляют при комнатной температуре. Спустя 24 часа отдельные кристаллы образуются из метанольного раствора. Эти кристаллы отфильтровывают и сушат в вакууме. Т.плавления 273 . Структуру кристаллов определяют с помощью автоматического дифрактомера 3/, используя монохроматическое излучение меди (1,54178). Кристаллическую структуру определяют, используя непосредственные методикипрограммной библиотеки. Уточнение с помощью полной матрицы наименьших квадратов отклонений осуществляют с температурными факторами анизотропии для всех атомов, кроме водородов, которые включены в расчетные положения с изотропными температурными факторами. Окончательный -фактор составил 8,02 . Результаты исследования кристаллов приведены далее. Результаты исследования кристаллов Пространственная группа С 2/С Параметры решетки а 20,720 (7)9,492 (2)с 28,711 (4)96,50 (2) Объем 5610 (2) 3 Плотность (расчетная) 1,409 мг/м 3 Коэффициент поглощения 3,951 мм-1 13 4668 1 Рентгеноструктурный анализ четко показывает, что кристаллический материал представляет 1,2 дихлорэтановый сольват с отношением молекул 1,2-дихлорэтана к молекулам 6-гидрокси-2-(4 гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоил-бензотиофенгидрохлорида 12. Пример 7. 6-Гидрокси-2-(4-гидроксифенил)-3-4-(2-пиперидиноэтокси)бензоилбензотиофенгидрохлорид Раствор гидрохлорида натрия (0,313 г) в метаноле (10 мл) разбавляют еще 50 мл метанола. Этот раствор обрабатывают соединением, полученным по способу примера 4 (4,0 г) . После 45 минут при комнатной температуре полученный раствор фильтруют (фильтровальная бумага Ватман 1) и эту фильтровальную бумагу промывают метанолом (3 мл). Полученный фильтрат обрабатывают 2 н соляной кислотой (4 мл), в результате чего получают кристаллическую суспензию. Спустя 1,5 часа этот кристаллический продукт отфильтровывают, промывают метанолом (5 мл) и сушат при 45-50 в вакууме до получения 2,103 г указанного в заглавии соединения. Дифракционная картина рентгеновских лучей та же, что и представленная в табл. 1. .плавления 261 . Степень чистоты 96,5 . Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66.
МПК / Метки
МПК: C07D 333/52, A61P 43/00, A61K 31/381
Метки: композиция, основе, 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидиноэтокси)бензоил]бензо[b]тиофенгидрохлорид, кристаллический, фармацевтическая, несольватированный
Код ссылки
<a href="https://by.patents.su/14-4668-nesolvatirovannyjj-kristallicheskijj-6-gidroksi-2-4-gidroksifenil-3-4-2-piperidinoetoksibenzoilbenzobtiofengidrohlorid-i-farmacevticheskaya-kompoziciya-na-ego-osnove.html" rel="bookmark" title="База патентов Беларуси">Несольватированный кристаллический 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидиноэтокси)бензоил]бензо[b]тиофенгидрохлорид и фармацевтическая композиция на его основе</a>
Предыдущий патент: Покрытие для семян и способ защиты семян от грибковых заболеваний
Следующий патент: Электролит оловянирования
Случайный патент: Бактерицидное средство для аэрозольной дезинфекции объектов ветеринарного надзора