Способ улучшения органолептических качеств мяса некастрированных самцов домашних животных
Номер патента: 3685
Опубликовано: 30.12.2000
Авторы: Клэр Шуве, Мишель Бернар Бонно, Раймон Дюфур, Клод Руле
Текст
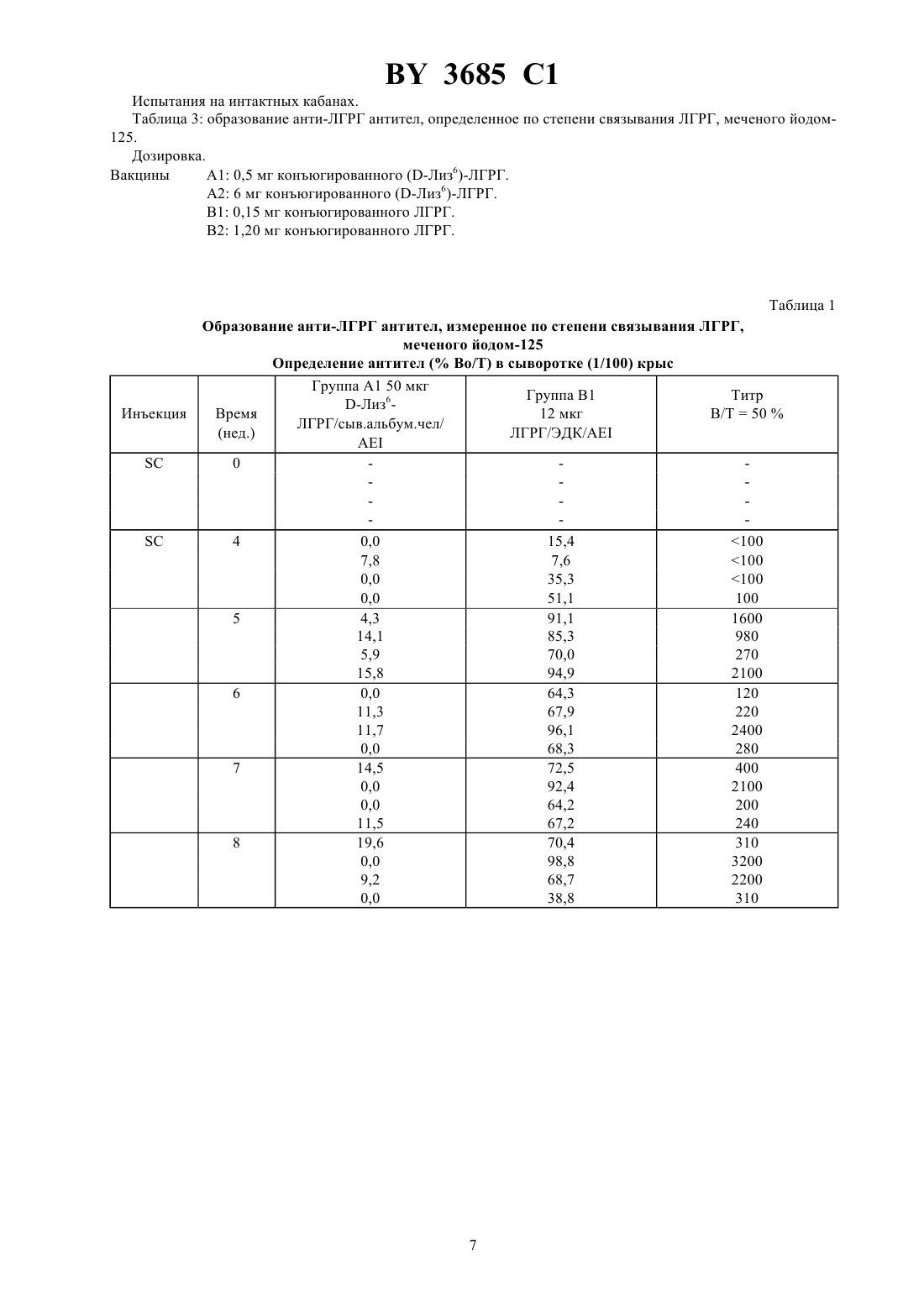
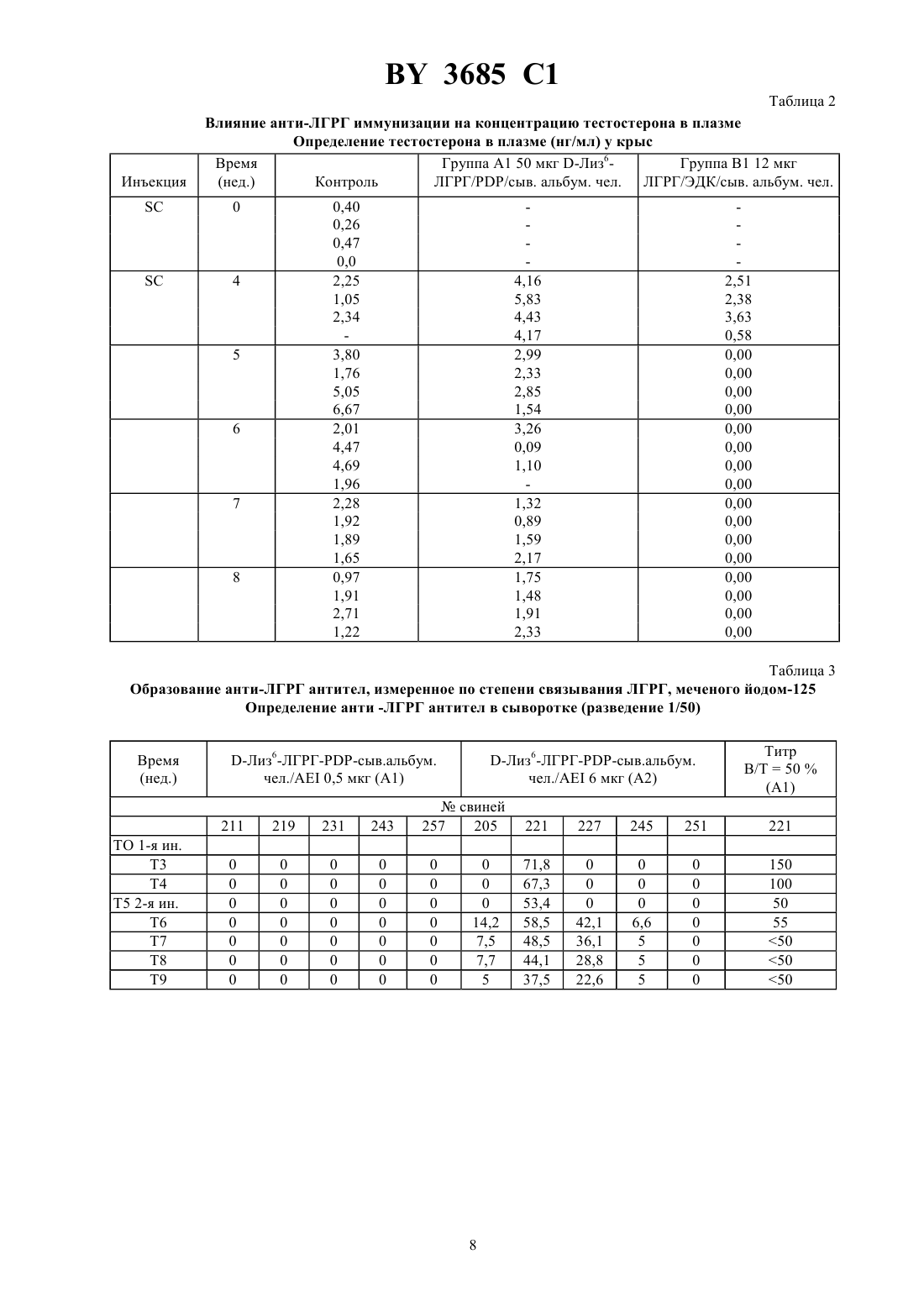
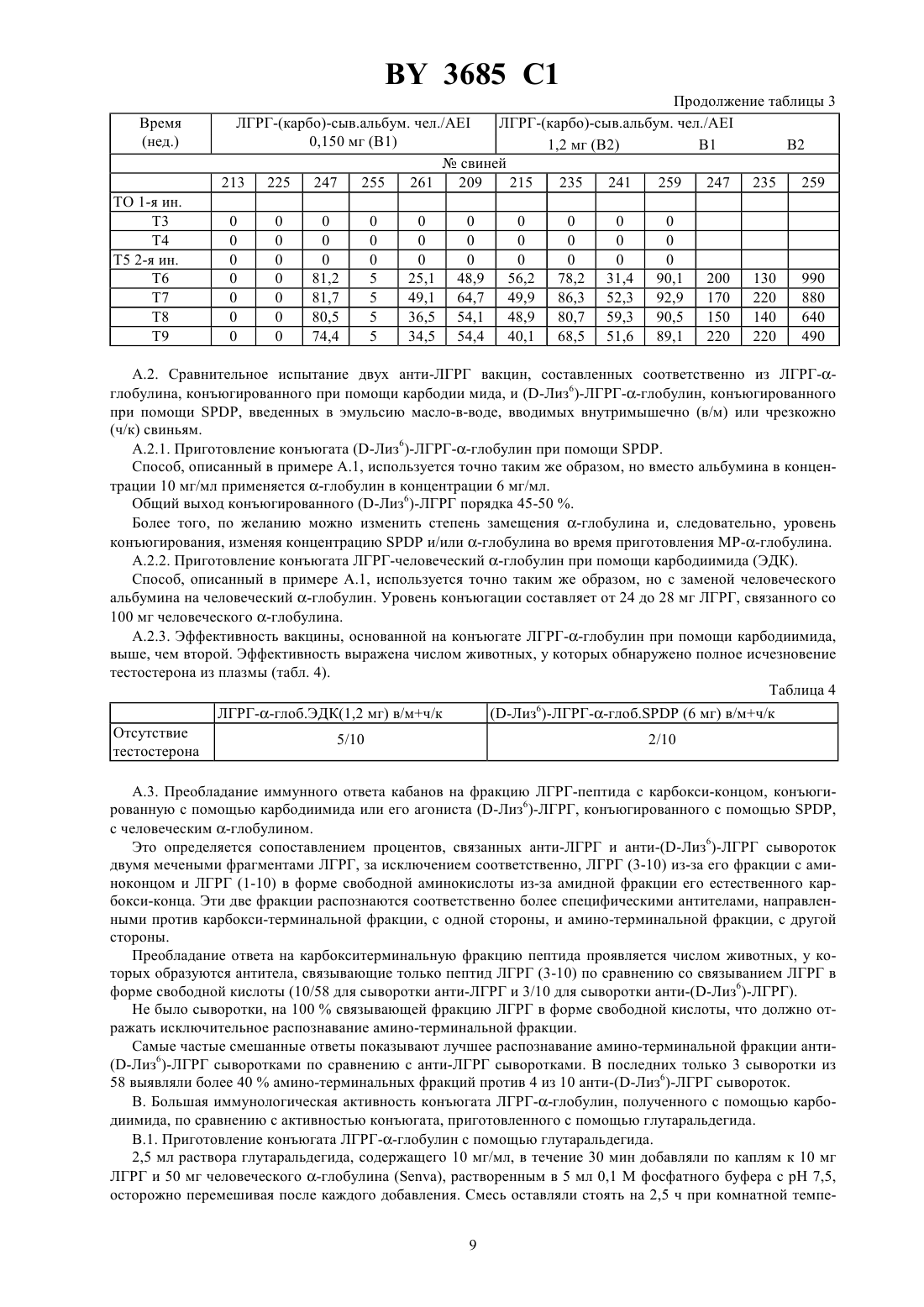
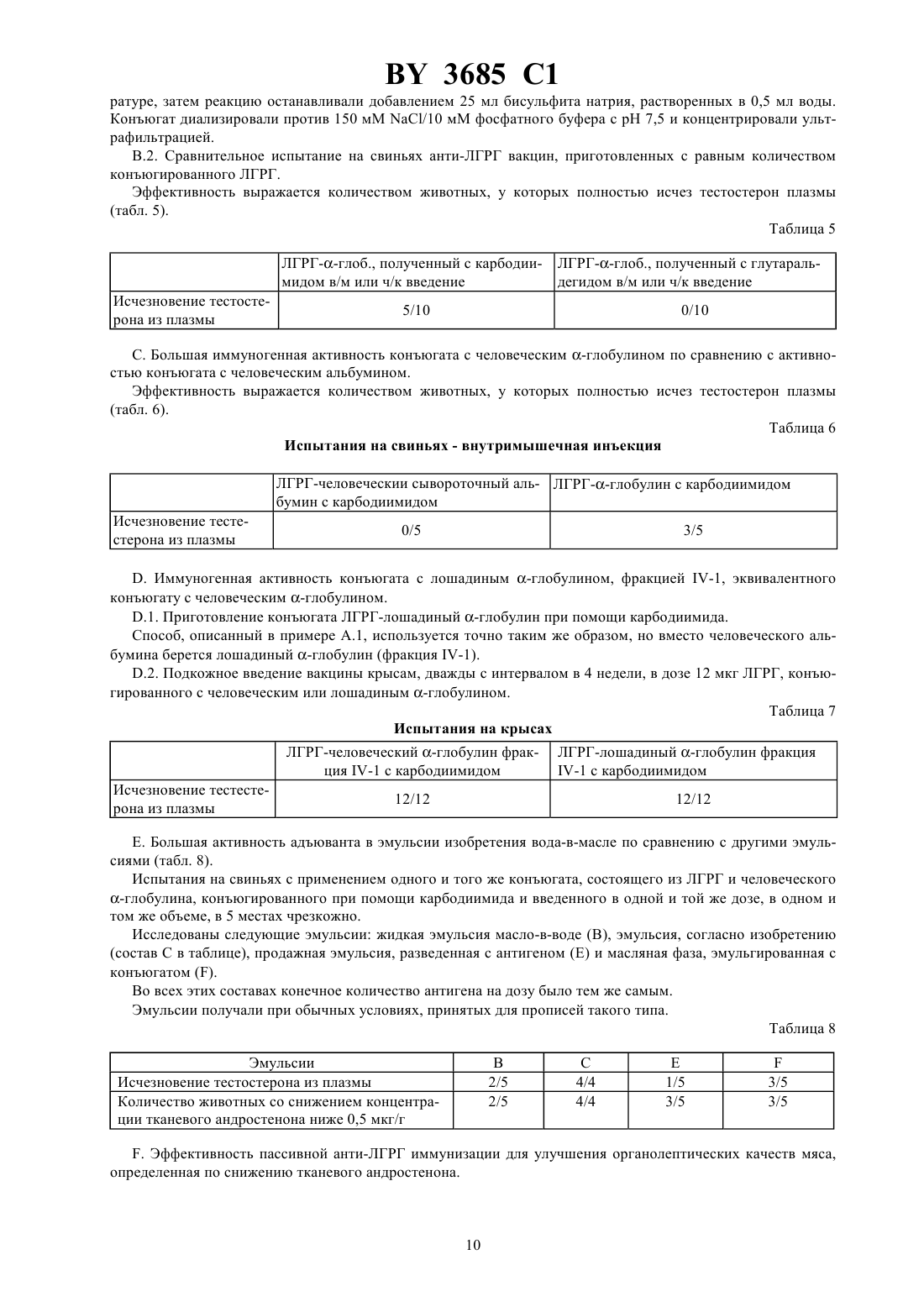
61 39/385, 61 39/395, 07 7/23 ГОСУДАРСТВЕННЫЙ ПАТЕНТНЫЙ КОМИТЕТ РЕСПУБЛИКИ БЕЛАРУСЬ СПОСОБ УЛУЧШЕНИЯ ОРГАНОЛЕПТИЧЕСКИХ КАЧЕСТВ МЯСА НЕКАСТРИРОВАННЫХ САМЦОВ ДОМАШНИХ ЖИВОТНЫХ(57) 1. Способ улучшения органолептических качеств мяса некастрированных самцов домашних животных путем активной анти-ЛГРГ иммунизации, отличающийся тем, что вакцину, предназначенную вызвать первичный иммунный ответ низкой интенсивности без значительного или даже без измеримого влияния на секрецию половых стероидов, вводят до или во время фазы откорма животного, а затем незадолго перед убоем вводят вакцину с составом, предназначенным для значительного снижения или исключения секреции стероидов без побочной местной или общей реакции, способной не ухудшить внешний вид или качество мяса. 2. Способ по одному из п. 1, отличающийся тем, что вакцину анти-ЛГРГ, которую вводят первой, является вакциной в виде эмульсии. 3. Способ по одному из пп. 1, 2, отличающийся тем, что анти-ЛГРГ вакцину вводят свиньям перед забоем с адъювантом водного типа. 4. Способ по п. 3, отличающийся тем, что в качестве адъюванта водного типа используют гель гидроксида алюминия или сапонин. 5. Способ по п. 3 или 4, отличающийся тем, что вакцину вводят в водном адъюванте за 15-21 день до забоя. 6. Способ по одному из пп. 1, 2, отличающийся тем, что анти-ЛГРГ вакцину вводят телятам и овцам перед забоем в адъюванте в виде эмульсии. 7. Способ по п. 6, отличающийся тем, что вакцину в эмульсионной форме вводят за 1-2 месяца до забоя. 8. Способ по п. 6 или 7, отличающийся тем, что вакцину в виде эмульсии вводят через 4 недели и до нескольких месяцев после того, как было произведено первое введение. 9. Способ по любому из пп. 2 или 6-8, отличающийся тем, что вакцина в виде эмульсии является вакциной в виде эмульсии вода-в-масле. 10. Способ по п. 9, отличающийся тем, что эмульсию вода-в-масле получают из смеси высокоочищенных минеральных масел и неионных поверхностно-активных веществ. 11. Способ по любому из пп. 1-10, отличающийся тем, что вводят анти-ЛГРГ иммуногенный конъюгат,включающий цельный или модифицированный ЛГРГ пептидный фрагмент ЛГРГ, модифицированный или в другом виде или агонист ЛГРГ,соединенные с иммуногенным белком-носителем, выбранным из бычьего или человеческого сывороточного альбумина тиреоглобулина яичного альбумина анатоксинов, в частности, столбнячного анатоксина человеческого или лошадиного глобулинов. 3685 1 12. Способ по п. 11, отличающийся тем, что конъюгат, включающий ЛГРГ, конъюгируют с лошадиным альфа-глобулином, в частности с фракциями - и/или -4. 13. Способ по п. 11, отличающийся тем, что конъюгат, включающий ЛГРГ, конъюгируют с яичным альбумином. 14. Способ по п. 12 или 13, отличающийся тем, что ЛГРГ/ЛГРГ (3-10) и иммуногенный белок-носитель конъюгируют с карбодиимидом. 15. Способ по любому из пп. 1-10, отличающийся тем, что указанные вакцины содержат иммуногенно активный агент, который содержит ЛГРГ-пептид. 16. Способ по п. 14 или 15, отличающийся тем, что конъюгат вводят подкожно или внутримышечно за 5-15 дней до забоя. 17. Способ по любому из пп. 1-16, отличающийся тем, что вакцину вводят трансдермально, предпочтительно в нескольких местах, при помощи безыгольного инъекционного аппарата, дающего струю под давлением.(56) 1.4556555, А 1985. 2.9011298, А 1990. 3.8800056, А 1988. Настоящее изобретение относится к способу улучшения органолептических качеств, особенно запаха,вкуса и нежности, мяса некастрированных самцов домашних животных, в частности бычков, баранов и хряков. Преимущества использования интактных самцов по сравнению с кастрированными при откармливании домашних животных, предназначенных для производства мяса, подчеркивается специалистами по зоотехнике в течение нескольких десятилетий. Это касается большей скорости роста, особенно у бычков и баранов,лучшей утилизации пищевого рациона и соединительнотканных образований, которые постнее, но лучше соотносятся с мышечной массой у всех видов домашних животных. Основные недостатки использования интактных самцов связаны с неприятным запахом и вкусом мяса хряков и баранов и с меньшей нежностью мяса интактных бычков и баранов, что оправдывает существующую практику хирургической кастрации. Фактически, хотя андрогенные стероиды, включая андростендиол, андростендион и тестостерон, являются решающими факторами в преимуществах, имеющихся у всех видов домашних животных, в отношении ускоренного роста и лучшей усвояемости пищевого рациона, они несут ответственность за меньшую нежность мяса интактных бычков и баранов. Неандрогенные стероиды или производные 16-андростена, включая 5-андростенон (5-андрост-16-ен-3-он), в частности, ответственны за неприятный запах и вкус мяса многих интактных хряков, достигших половой зрелости, эти факторы ухудшают качество мяса и являются препятствием для продажи его в свежем виде. Скатол, продукт обмена триптофана и жизнедеятельности микрофлоры кишечника, является соединением, частично ответственным за неприятный запах и вкус мяса интактных хряков. Его образование зависит от факторов окружающей среды, питания и породы. Накопление его в жировой ткани выше у хряков и считается зависящим от секреции половых стероидных гормонов. В эксперименте уже предпринималась попытка уменьшить или исключить развитие мужских половых признаков у молодых животных или нарушить секрецию гормонов яичек, в частности тестикулярных стероидов,путем активной или пассивной иммунизации против этих гормонов или против гормонов, участвующих в их секреции, в частности, против лютеинизирующего гормона (ЛГ) и гормона гонадолиберин (ГРГ), также известного как гормон, высвобождающий лютеинизирующий гормон (ЛГРГ). Также проводились на свиньях исследования по снижению уровня 5-андростенона в тканях (гормона из группы 16-андростена) путем активной иммунизации против этого соединения ( - а.,, 1985, 12, 251-264) или пассивной иммунизации против этого же соединения (. ,, ., , 1975). Можно добиться прекращения или снижения секреции тестикулярных стероидов при помощи иммунонейтрализации гонадотропного гормона ЛГ, специфического для данного вида (., . . , 1986, 63, 986-994) или путем анти-ЛГРГ иммунонейтрализации эндогенного ЛГРГ. Различные авторы рекомендуют только активную анти-ЛГРГ иммунизацию. Этим способом было получено снижение уровня -андростенона у свиней (.М. , . . , 1986, 303,(16) 673-676 а., . . ., 1986, 63, 986-994).(. . , 1982, 242, 201-205) рекомендует анти-ЛГРГ иммунизацию, чтобы задержать развитие яичек и вызвать эффект кастрации у молодых барашков. Анти-ЛГРГ иммунологическая кастрация телят описывается в работе (. ., 1979, 105, 516-517). Исследования анти-ЛГРГ иммунонейтрализации у лабораторных животных ( . ., ,1973, 93, 1092-1103 а., . ., 1974, 63, 399-406 Т.а., , 1973, 8(2),133-145 С.а., . . . . , 1982, 79, 5392-5395) и у нескольких видов домашних жи 2 3685 1 вотных (а., , 1978, 10(4), 323-335 а.,, 1979, 105,556, . . , 1982, 242, 201-205) показали, что можно добиться прекращения секреции тестостерона, обратного развития с уменьшением массы яичек и придаточных желез, прекратить сперматогенез и, на поведенческом уровне, исчезновения либидо. Эта работа привела к предложению прибегнуть к ранней иммунонейтрализации, в частности, анти-ЛГРГ,для замены традиционной хирургической кастрации в животноводстве. В 1 описан способ пассивной иммунизации животных до полового созревания при помощи антисыворотки, содержащей антитела к гонадотропину. В 2 описывается способ улучшения качества мяса свиней при помощи анти-ЛГРГ иммунизации новорожденных препаратом, состоящим из 2 последовательностей ЛГРГ, соединенных с белковым носителем. В 3 описывается способ улучшения социального и сексуального поведения самцов животных при помощи анти-ЛГРГ иммунологической кастрации вместо хирургической кастрации, нарушающей скорость роста. Бычков вакцинировали в возрасте от 8 до 40 недель и затем ревакцинировали несколько раз.. (. . ., 1986, 63, 986-994) иммунизировали несколько групп хряков ЛГРГсывороточным глобулином человека, конъюгированным с полным адъювантом Фрейнда или с мурамилпептидом в качестве адъюванта. После вакцинации и нескольких ревакцинаций авторы наблюдали высокие титры анти-ЛГРГ антител, но чтобы поддерживать высокий титр антител необходимо производить повторные реиммунизации. описывает способ иммунизации ЛГРГ, конъюгированным со столбнячным анатоксином или с тиреоглобулином, и высказывает предположение, что иммунологический подход сделает возможной позднюю кастрацию, от которой можно ожидать преимуществ с точки зрения прироста веса. Однако он приходит к выводу, что для разработки способа кастрации, который можно было бы применять на практике, необходимы дальнейшие усовершенствования как самого способа, так и адъюванта, поскольку адъювант Фрейнда запрещено применять в практических целях. Позже .и М.( . . , . 303,, 16, 1986) осуществили антиЛГРГ иммунизацию кабанов. Авторы высказывают предположение, что блокада продукции стероидов за 2-3- недели до забоя даст возможность использовать высокий потенциал этого типа животных для производства мяса без затруднений, связанных с накоплением андростерона в жировой ткани. Однако они пришли к заключению, что необходимо значительно улучшить технику иммунизации прежде, чем станет возможным предложить активную анти-ЛГРГ иммунизацию в качестве методики, которую можно применять в свиноводстве. Более того, поздняя иммунонейтрализация создает для практики значительную проблему безопасности этого воздействия и, в частности, проблему местных реакций, вызванных вакцинами и особенно масляными вакцинами, с риском вызвать этим отказ в реализации мяса или снижения оценки качества. Улучшение органолептических качеств мяса телят и овец не предлагалось. Заявитель фактически нашел применимый в производстве способ улучшения органолептических качеств мяса животных, при котором незадолго до забоя животного значительно уменьшается действие андрогенных и неандрогенных стероидов при помощи активной или пассивной анти-ЛГРГ иммунонейтрализации, в то время, как преимущества, связанные с мужским полом животного, сохраняются почти до забоя. В соответствии с первым предпочтительным воплощением этого способа анти-ЛГРГ вакцина вводится животному, предпочтительно в виде эмульсии, предпочтительно до или во время фазы откорма животного, а затем, незадолго перед убоем животного, анти-ЛГРГ вакцина вводится снова. Процедура может осуществляться путем двух раздельных введений или способом регулируемого выделения. У свиней особенно благоприятные результаты дает введение перед убоем анти-ЛГРГ вакцины с адъювантом водного типа, в частности с гелем гидроксида алюминия и/или сапонином. Это введение предпочтительно производить за 15-21 день до забоя. Напротив, телятам и, где уместно, овцам введение перед забоем предпочтительно производить с адъювантом в эмульсионной форме и, предпочтительно, за 1-2 месяца до забоя. Это введение предпочтительно производить не менее, чем через 4 недели, и предпочтительно через несколько месяцев после первого введения. Во всяком случае для вакцины в форме эмульсии, предназначенной для первого введения и у телят для второго введения, предпочтительно, чтобы вакцина была в виде эмульсии вода-в-масле. Однако могут предусматриваться другие виды эмульсий. Эта вакцина, предпочтительно эмульсионногого типа, предназначается, согласно этому изобретению, для того, чтобы вызвать первичный иммунный ответ низкой интенсивности без значительного или даже измеримого действия на секрецию половых стероидов. Предпочтительна технология приготовления в виде эмульсии, но другие формы выпуска средства могут использоваться в том случае, если они оказывают такое же действие. Введение, предшествующее забою, производится вакциной, предназначенной для значительного снижения или исключения секреции стероидов без побочной общей или местной реакции, способной не ухудшить внешний вид или качество мяса. 3 3685 1 Предпочтительным, в частности для свиней, является конъюгат в водном растворе, приготовленный в виде следующих двух прописей первой, в виде стабильной эмульсии вода-в-масле из смеси высокоочищенного минерального, животного или растительного масла с неионным поверхностно-активным веществом, для индукции иммунного ответа малой интенсивности без измеримого действия на секрецию половых стероидов, и второй, не эмульгированной, с гелем гидроксида алюминия и сапонином, запускающей быструю и интенсивную иммунную реакцию, приводящую к достаточной выработке нейтрализующих анти-ЛГРГ антител для того, чтобы вызвать снижение или устранение половых стероидов и снизить сопутствующий транспорт скатола кишечного происхождения. Применявшаяся эмульсия является в отличие от тех, что получены с полным или неполным адъювантом Фрейнда, стабильной эмульсией, дающей возможность приготовить готовую к употреблению вакцину. Воспалительная реакция кожи остается очень слабым и ограниченным местом введения двух форм выпуска вакцин и проявляется в виде четко отграниченной папулы при наружном осмотре. Ее развитие ограничивается пределами поверхностной дермы. К моменту забоя животного она исчезает, не оставляя заметной гранулемы. Соответственно другому воплощению этого способа животному за несколько дней до забоя, в частности за 5-15 дней, вводят гипериммунную анти-ЛГРГ сыворотку или плазму, или альтернативно, анти-ЛГРГ моноклональные антитела. Пассивная анти-ЛГРГ иммунизация, приводящая к снижению или даже исчезновению секреции андрогенных и неандрогенных стероидов, была получена при внутримышечном введении гипериммунной лошадиной плазмы. Осуществленная до достаточного уровня, измеряемого титром анти-ЛГРГ антител в сыворотке реципиента, эта иммунизация вызывает снижение тестостерона в плазме, начиная с 3-го дня поддерживаемая на том же уровне в течение следующих 12 дней, она достаточна, чтобы снизить содержание андростерона в тканях ниже 0,50 мкг, при таком уровне неприятный запах и привкус у мяса хряка не должны ощущаться потребителем. Этот способ пассивной иммунизации показал, что сохранение в течение 12 дней значительного снижения тестостерона достаточно для снижения концентрации андростерона в тканях ниже пороговых величин. Эта пассивная иммунизация может осуществляться при помощи анти-ЛГРГ моноклональных антител,секретируемых свиными гибридомами или гетерогибродомами. Способ введения этих форм выпуска предпочтительно через кожу, в частности, с помощью безыгольного инъекционного аппарата, дающего струю под давлением, в частности, соответствующего патенту по заявке 2652257 А. Способ, соответствующий этому изобретению, имеет большое преимущество, являясь полностью безопасным, в частности, не вызывающим местной реакции, способной привести к снижению качества мяса. Воспалительная реакция кожи ограничивается местами введения двух вакционных прописей и проявляется в виде четко отграниченных папул при наружном осмотре. Ее развитие ограничивается поверхностным слоем дермы. Она исчезает к моменту забоя животного, не оставляя заметной гранулемы. Воспалительная реакция, ограниченная по времени и местом введения, отражает толерантность к двум вакцинным прописям и получается при транскутанном введении вакцин безыгольным инъектором. Для анти-ЛГРГ иммунизации нужно конъюгировать ЛГРГ-пептид или его фрагмент, не являющиеся иммуногенным в том виде, в котором они выпускаются для широкого применения, с иммуногенным белком,называемым носителем, при помощи ковалентной связи. ЛГРГ или ГРГ как естественного происхождения, так и синтетические, составлены из 10 аминокислот с порядковыми номерами от 1 до 10, в последовательности от аминоконца к карбоксиокончанию, в соответствии со следующей формулой пироГлу-Гис-Три-Сер-Тир-Гли-Лей-Арг-Про-Гли 1 2 3 4 5 6 7 8 9 10 Эти общепринятые сокращения обозначают пироГлу - пироглутаминовая кислота Гис - гистидин Три триптофан Сер - серин Тир - тирозин Гли -глицин Лей - лейцин Арг - аргинин Про - пролин. Анти-ЛГРГ иммуногенные конъюгаты, описанные различными авторами, можно получить, в зависимости от гаптена, в виде а) цельного ЛГРГ или ЛГРГ с модификациями в одном или нескольких участках, чтобы получить желаемую конъюгацию с аминоконцом, карбоки-окончанием или с другими участками б) одного из фрагментов его пептида, состоящего из 5-7 аминокислот, модифицированного или нет, чтобы получить желаемую конъюгацию с аминоконцом, карбокси-концом или с другими участками в) агониста, несущего замещенную аминокислоту, чаще всего в положении 6, чтобы получить конъюгацию с серединой молекулы. В качестве белка-носителя использовались бычий сывороточный альбумин, сывороточный альбумин человека, тиреоглобулин, яичный альбумин и глобулины человека или лошади. 3685 1 Так, в ЕР 181236 А описаны иммуногенные конъюгаты, включающие нонапептид или декапептид с последовательностью, соответствующей последним 8 аминокислотам молекулы ЛГРГ, к которой со стороны аминоконца добавлен лизин или последовательность цистеин-лизин. Более того, в 3 описываются конъюгаты, сделанные из фрагментов природной молекулы, состоящих из 5, 6 или 7 соседствующих аминокислот, в которых каждый фрагмент включает пироглутаминовую кислоту с аминоконцом или глицинамид с карбокси-концом и к которым можно добавить дополнительную аминокислоту или аминокислотную последовательность, чтобы связать с концом иммуногенный белок. Конъюгирующие вещества можно разделить на три основные категории активирующие вещества, гомобифункциональные вещества и гетеробифункциональные вещества. В то время как с активирующими веществами связь между двумя молекулами осуществляется между двумя, уже существующими функциональными группами, с другими веществами связь устанавливается через углеводный остаток, которым оканчивается лиганд. Среди активирующих веществ можно упомянуть перйодную кислоту, применяемую для окисления олигосахаридных остатков гликопротеинов до альдегидов, с которыми впоследствии вступают в реакцию аминогруппы другой молекулы, образующей конъюгат. Карбодиимиды являются активирующими веществами, широко использующимися для соединения антигенов с белками, и самым часто применяющимся из них несомненно является -этил-1-(3 диметиламинопропил)карбодиимид (ЭДК) гидрохлорид, который дает возможность проводить реакцию в водной среде. Их действие ведет к образованию амидной связи между карбоксильной группой одного белка, активированного в виде промежуточной О-алкилизомочевины, и аминогруппой, которую несет другая молекула. Их преимущество связано с простотой их применения. Гомобифункциональные вещества являются молекулами, обладающими двумя идентичными реактивными группами, разделенными углеводородной цепью. Из них можно упомянуть глутаральдегид, который вступает в реакцию двумя первичными аминогруппами, алкил или арилдиизоцианаты, которые реагируют с первичными аминами и тиолами, и бисдиазотизированный бензидин, который соединяется с ароматическими остатками тирозина. Для полноты можно упомянуть бисмалеимиды и бисамидинаты. Главным недостатком гомобифункциональных веществ является слабая возможность влиять на природу образующихся конъюгатов, так как эти вещества могут вступать в реакцию с двумя молекулами одной и той же природы и приводить к образованию олигомеров или полимеров. Чтобы это исправить, химики ввели гетеробифункциональные вещества, у которых две группы имеют различные характеристики. В общем случае одна из этих групп является -гидроксисукцинимидэфиром, который, в мягких условиях, реагирует со свободными аминогруппами белков, давая, с одной стороны, гидроксисукцинимид, а с другой - белок, несущий через ковалентную амидную связь соединяющее вещество, у которого имеется вторая функциональная группа. С довольно общей точки зрения, последнее может реагировать с тиолами, соединенными с молекулой, которую нужно соединить, эти тиолы либо изначально присутствуют в молекуле в виде цистеиновых остатков (для последнего они могут быть естественными составными частями или, в случае пептидов, введенными специально во время синтеза), либо вводятся веществами, такими как 2-иминотиолан или -3-(2-пиридил-тио)пропаноилоксисукцинимидпосле восстановления. Из вышеуказанных возможностей предпочтительно использовать цельный ЛГРГ. В таком случае естественный ЛГРГ предпочтительнее агонистов, таких как (-Лиз 6)-ЛГРГ, в отношении иммуногенной активности конъюгатов, получаемых с этими пептидами. Карбодиимид предпочтительнее глутаральдегида в качестве реактива для конъюгирования естественной формы ЛГРГ с альфа-глобулином. Человеческий или лошадиный альфа-глобулин, фракция -1 или -4, предпочтительнее человеческого или бычьего сывороточного альбумина. Предпочтительно, чтобы вакцины включали одно и то же активное начало, предпочтительно включающее конъюгат альфа-глобулин-ЛГРГ ЛГРГ предпочтителен в естественной форме и альфа-глобулин, полученный от человека или лошади, в частности, фракции -1 и/или -4. Конъюгат предпочтительно получать добавлением 0,5-2 объемов 2,5 -го раствора -этил-1-(3-диметиламинопропил)карбодиимид (ЭДК) гидрохлорида в 0,9 до 1 объема смеси альфа-глобулин, ЛГРГ в растворе, содержащем от 2 до 20 мг/мл в 0,9. После перемешивания смесь оставляют на ночь и затем очищают гель-проникающей хроматографией. В отношении белка-носителя возможно использовать альбумины сыворотки, в частности, бычьей или человеческой, тиреоглобулин, яичный альбумин, глобулины человека или лошади и анатоксины, в частности,столбнячный анатоксин. Преобладание иммунного ответа кабанов на фракцию ЛГРГ-пептида с карбокси-концом, конъюгированным с карбодиимидом, или его агониста (-Лиз 6)-ЛГРГ, конъюгированного с , перед альфаглобулином, которое наблюдалось, привело к определению анти-ЛГРГ иммуногенного конъюгата, использующего преимущественный пептид, обладающий карбокси-терминальным концом ЛГРГ. 5 3685 1 Изобретение будет описано более подробно при помощи, с одной стороны, сравнительных испытаний нескольких продуктов и способов вакцинации, соответственно изобретению, и, с другой стороны, испытаний, показывающих иммунный ответ кабанов на фракцию ЛГРГ-пептида с карбоксильным концом, и испытания анти-ЛГРГ вакцинации кабанов, произведенной соответственно изобретению. 1. Использование цельного ЛГРГ А. Большая иммуногенная активность конъюганта, сохраняющая интактной самую крупную фракцию пептида ЛГРГ с карбоксиконцом, и выбор конъюгата, основанный на предпочтении конъюгата, образованного с агонистом (-Лиз 6)-ЛГРГ, конъюгату с естественным составом ЛГРГ. А.1. Анти-ЛГРГ иммунизация интактных кабанов исамцов крыс. Сравнение активности двух анти-ЛГРГ вакцин, состоящих из конъюгатов с естественной формой ЛГРГ(В 1 и В 2) или (-Лиз 6)-ЛГРГ (А 1 и А 2) и с человеческим альбумином, конъюгатов, полученных при помощи карбодиимида в водной фазе исоответственно, введенных в эмульсию масло-в-воде и введенных внутримышечно свиньям и подкожно крысам, приводит к следующим выводам большая активность вакцины, основанной на естественной форме ЛГРГ масса конъюгированного ЛГРГпептида меньше, чем масса конъюгированного (-Лиз 6)-ЛГРГ-пептида, для получения большего количества животных, проявляющих иммунный ответ (табл. 1 и 3) эффект дозы, который проявляется в получении большего количества животных, дающих иммунный ответ на один и тот же конъюгат (табл. 3). А.1.1. Приготовление конъюгантов (-Лиз 6)-ЛГРГ-альбумин при помощи . Приготовление конъюгантов (-Лиз 6)-ЛГРГ-альбумин проводится в 3 стадии приготовление -3-(2 пиридилдитио)пропаноил-(-Лиз 6)-ЛГРГ, приготовление -(3-меркаптопропаноил)альбумина и конъюгирование.-3-(2-Пиридилдитио)пропаноил-(-Лиз 6)-ЛГРГ готовится путем реакции избыткас ЛГРГ в водном растворе (6 мольна моль ЛГРГ) в течение ночи при 4 С и последующего центрифугирования. Полученный продукт растворяют в 8 М мочевине и оценивают присутствие 2-пиридилдитиогрупп.-(3-Меркаптопропаноил)альбумин получают путем воздействия 0,2 ммольна 1 г человеческого альбумина, растворенного в 100 мл 0,1 М фосфатного буфера, в течение ночи при 4 С и последующего подкисления до рН 6 путем восстановления дитиотреитолом. Затем его очищают гель-фильтрационной хроматографией. Анализ тиола и белка показывает средний уровень замещения. Конъюгирование производят, взяв одну 2-пиридилдитио-группу на 1,25 тиоловой группы. Доводят рН до 7-7,5 и через 1 ч определяют выход путем измерения освобожденного 2-пиридинтиона. Из этого выводят средний уровень замещения. Наконец, конъюгат очищают хроматографией и концентрируют ультрафильтрацией. А.1.2. Приготовление конъюгата ЛГРГ-альбумин при помощи карбодиимида. 1000 мг -этил-1-(3-диметиламинопропил)-карбодиимида гидрохлорида, растворенные непосредственно перед употреблением в 40 мл 0,9, добавляют к 300 мг ЛГРГ и 300 мг человеческого альбумина,растворенным в 30 мл 0,9. После перемешивания смесь оставляют стоять в течение ночи при комнатной температуре, защитив от света. Затем ее хроматографируют на-50 геле, фракции, соответствующие конъюгату, собирают, при необходимости концентрируют и замораживают. По фракциям, содержащим несвязанный ЛГРГ, определяют количество несвязанного ЛГРГ и, следовательно, средний уровень конъюгации. Последнее является воспроизводимым и варьирует от 8 до 10 мг ЛГРГ конъюгированного со 100 мг альбумина. Определение УФ спектра конъюгата до и после хроматографии позволяет вычислить хроматографический выход конъюгата и, следовательно, количество (или концентрацию) конъюгированного ЛГРГ. А.1.3. Методики анализов. Титр антител определяется по методике, описанной -.,., ., 1974, 75, 625635. Тестотерон определяется непосредственно в плазме методом радиоиммунного анализа, используя радиолиганд тестостерона С 19-карбоксиметиловый эфир 125 гистамина. Связывание с меченым пептидом определяется после мечения различных пептидов йодом-125 согласно., ., 1979, 104, 1504-1506 и определения по методике, описанной.,.1.4. Иллюстрации. Испытания на крысах. Таблица 1 образование анти-ЛГРГ антител, определенное по степени связывания ЛГРГ, меченого йодом 125. Таблица 2 влияние анти-ЛГРГ иммунизации на концентрацию тестостерона в плазме. Дозировка. Вакцины А 1 50 мкг конъюгированного (-Лиз 6)-ЛГРГ. В 1 12 мкг конъюгированного ЛГРГ. 3685 1 Испытания на интактных кабанах. Таблица 3 образование анти-ЛГРГ антител, определенное по степени связывания ЛГРГ, меченого йодом 125. Дозировка. Вакцины А 1 0,5 мг конъюгированного (-Лиз 6)-ЛГРГ. А 2 6 мг конъюгированного (-Лиз 6)-ЛГРГ. В 1 0,15 мг конъюгированного ЛГРГ. В 2 1,20 мг конъюгированного ЛГРГ. Образование анти-ЛГРГ антител, измеренное по степени связывания ЛГРГ,меченого йодом-125 Определение антител ( Во/Т) в сыворотке (1/100) крыс Группа А 1 50 мкг Группа В 1 Титр Таблица 2 Влияние анти-ЛГРГ иммунизации на концентрацию тестостерона в плазме Определение тестостерона в плазме (нг/мл) у крыс Группа В 1 12 мкг Время Группа А 1 50 мкг -Лиз 6 ЛГРГ//сыв. альбум. чел. ЛГРГ/ЭДК/сыв. альбум. чел. Таблица 3 Образование анти-ЛГРГ антител, измеренное по степени связывания ЛГРГ, меченого йодом-125 Определение анти -ЛГРГ антител в сыворотке (разведение 1/50) Время.2. Сравнительное испытание двух анти-ЛГРГ вакцин, составленных соответственно из ЛГРГ-глобулина, конъюгированного при помощи карбодии мида, и (-Лиз 6)-ЛГРГглобулин, конъюгированного при помощи , введенных в эмульсию масло-в-воде, вводимых внутримышечно (в/м) или чрезкожно.2.1. Приготовление конъюгата (-Лиз 6)-ЛГРГглобулин при помощи . Способ, описанный в примере А.1, используется точно таким же образом, но вместо альбумина в концентрации 10 мг/мл применяется -глобулин в концентрации 6 мг/мл. Общий выход конъюгированного (-Лиз 6)-ЛГРГ порядка 45-50 . Более того, по желанию можно изменить степень замещения -глобулина и, следовательно, уровень конъюгирования, изменяя концентрациюи/или -глобулина во время приготовления МРглобулина..2.2. Приготовление конъюгата ЛГРГ-человеческий -глобулин при помощи карбодиимида (ЭДК). Способ, описанный в примере А.1, используется точно таким же образом, но с заменой человеческого альбумина на человеческий -глобулин. Уровень конъюгации составляет от 24 до 28 мг ЛГРГ, связанного со 100 мг человеческого -глобулина..2.3. Эффективность вакцины, основанной на конъюгате ЛГРГглобулин при помощи карбодиимида,выше, чем второй. Эффективность выражена числом животных, у которых обнаружено полное исчезновение тестостерона из плазмы (табл. 4). Таблица 4.3. Преобладание иммунного ответа кабанов на фракцию ЛГРГ-пептида с карбокси-концом, конъюгированную с помощью карбодиимида или его агониста (-Лиз 6)-ЛГРГ, конъюгированного с помощью ,с человеческим -глобулином. Это определяется сопоставлением процентов, связанных анти-ЛГРГ и анти-(-Лиз 6)-ЛГРГ сывороток двумя мечеными фрагментами ЛГРГ, за исключением соответственно, ЛГРГ (3-10) из-за его фракции с аминоконцом и ЛГРГ (1-10) в форме свободной аминокислоты из-за амидной фракции его естественного карбокси-конца. Эти две фракции распознаются соответственно более специфическими антителами, направленными против карбокси-терминальной фракции, с одной стороны, и амино-терминальной фракции, с другой стороны. Преобладание ответа на карбокситерминальную фракцию пептида проявляется числом животных, у которых образуются антитела, связывающие только пептид ЛГРГ (3-10) по сравнению со связыванием ЛГРГ в форме свободной кислоты (10/58 для сыворотки анти-ЛГРГ и 3/10 для сыворотки анти-(-Лиз 6)-ЛГРГ). Не было сыворотки, на 100 связывающей фракцию ЛГРГ в форме свободной кислоты, что должно отражать исключительное распознавание амино-терминальной фракции. Самые частые смешанные ответы показывают лучшее распознавание амино-терминальной фракции анти(-Лиз 6)-ЛГРГ сыворотками по сравнению с анти-ЛГРГ сыворотками. В последних только 3 сыворотки из 58 выявляли более 40 амино-терминальных фракций против 4 из 10 анти-(-Лиз 6)-ЛГРГ сывороток. В. Большая иммунологическая активность конъюгата ЛГРГглобулин, полученного с помощью карбодиимида, по сравнению с активностью конъюгата, приготовленного с помощью глутаральдегида..1. Приготовление конъюгата ЛГРГглобулин с помощью глутаральдегида. 2,5 мл раствора глутаральдегида, содержащего 10 мг/мл, в течение 30 мин добавляли по каплям к 10 мг ЛГРГ и 50 мг человеческого -глобулина , растворенным в 5 мл 0,1 М фосфатного буфера с рН 7,5,осторожно перемешивая после каждого добавления. Смесь оставляли стоять на 2,5 ч при комнатной темпе 9 3685 1 ратуре, затем реакцию останавливали добавлением 25 мл бисульфита натрия, растворенных в 0,5 мл воды. Конъюгат диализировали против 150 мМ /10 мМ фосфатного буфера с рН 7,5 и концентрировали ультрафильтрацией. В.2. Сравнительное испытание на свиньях анти-ЛГРГ вакцин, приготовленных с равным количеством конъюгированного ЛГРГ. Эффективность выражается количеством животных, у которых полностью исчез тестостерон плазмы(табл. 5). Таблица 5 ЛГРГглоб., полученный с карбодии- ЛГРГглоб., полученный с глутаральмидом в/м или ч/к введение дегидом в/м или ч/к введение Исчезновение тестостерона из плазмы С. Большая иммуногенная активность конъюгата с человеческим -глобулином по сравнению с активностью конъюгата с человеческим альбумином. Эффективность выражается количеством животных, у которых полностью исчез тестостерон плазмы(табл. 6). Таблица 6 Испытания на свиньях - внутримышечная инъекция ЛГРГ-человеческии сывороточный аль- ЛГРГглобулин с карбодиимидом бумин с карбодиимидом Исчезновение тестестерона из плазмы. Иммуногенная активность конъюгата с лошадиным -глобулином, фракцией -1, эквивалентного конъюгату с человеческим -глобулином..1. Приготовление конъюгата ЛГРГ-лошадиный -глобулин при помощи карбодиимида. Способ, описанный в примере А.1, используется точно таким же образом, но вместо человеческого альбумина берется лошадиный -глобулин (фракция -1)..2. Подкожное введение вакцины крысам, дважды с интервалом в 4 недели, в дозе 12 мкг ЛГРГ, конъюгированного с человеческим или лошадиным -глобулином. Таблица 7 Испытания на крысах ЛГРГ-человеческий -глобулин фракция -1 с карбодиимидом Исчезновение тестестерона из плазмы Е. Большая активность адъюванта в эмульсии изобретения вода-в-масле по сравнению с другими эмульсиями (табл. 8). Испытания на свиньях с применением одного и того же конъюгата, состоящего из ЛГРГ и человеческого-глобулина, конъюгированного при помощи карбодиимида и введенного в одной и той же дозе, в одном и том же объеме, в 5 местах чрезкожно. Исследованы следующие эмульсии жидкая эмульсия масло-в-воде (В), эмульсия, согласно изобретению(состав С в таблице), продажная эмульсия, разведенная с антигеном (Е) и масляная фаза, эмульгированная с конъюгатом . Во всех этих составах конечное количество антигена на дозу было тем же самым. Эмульсии получали при обычных условиях, принятых для прописей такого типа. Таблица 8 Эмульсии Исчезновение тестостерона из плазмы Количество животных со снижением концентрации тканевого андростенона ниже 0,5 мкг/г. Эффективность пассивной анти-ЛГРГ иммунизации для улучшения органолептических качеств мяса,определенная по снижению тканевого андростенона. 3685 1 Таблица 9 Содержание андростенона в жировой ткани у контрольных животных и при пассивной анти-ЛГРГ иммунонейтрализации гипериммунной лошадиной анти-(-Лиз 6)-ЛГРГ плазмой, введенной в объеме 300 мл за 16, 13, 9 и 5 дней до забоя Контроль Кол-во животных со снижением концентрации андростенона ниже 0,5 мкг/г жировой ткани. Эффективность и переносимость прописей, содержащих ЛГРГ, конъюгированный с глобулином при помощи карбодиимида, в виде эмульсии вода-в-масле- (1-я вакцина) и в геле гидроксида алюминия и сапонине (2-я вакцина), введенных чрезкожно при одной и той же дозе конъюгированного ЛГРГ, в начале периода откорма и за 18-21 день до забоя соответственно безыгольным инъектором . Проведены 2 испытания в 2 стадии, группы 1, 3 и 5 для первой прописи и группы 2 и 4 для второй, соответственно (табл. 10 и 11)..1. Эффективность анти-ЛГРГ иммунонейтрализаци возрастает при увеличении количества мест чрезкожного введения без изменения объема вакцины. Таблица 10 Группы 1 1-я вакцина 1 мл (5 мест) 2-я вакцина 1 мл (5 мест) Исчезновение или заметное уменьшение 10/12 тестестерона (число животных) Концентрация андростенона в ткани ниже 11/12 0,5 мкг/г (число животных).2. Толерантность к введенным вакцинам оценивалась по развитию воспалительной реакции кожи с градацией от 0 до 4, в зависимости от размера папулы, появляющейся после введения папула развивается в каждой точке введения. Сумма баллов по шкале в каждой группе складывалась следующим образом средняя оценка в баллах к концу первой недели после введения (А.1) и перед забоем (3 б) для каждой вакцины(табл. 12). Самая лучшая переносимость наблюдалась при введении вакцины в группе 5. Таблица 11 Переносимость чрезкожного введения, наблюдавшаяся в испытаниях (испытание 1 группы 1, 3 и 5 испытание 2 группы 2 и 4) Группы вакцины количество мест введения А.1 3 б кол-во животных. Использование пептида (3-10) А. Методики измерения анти-ЛГРГ иммунного ответа и биологической эффективности по оценке тестостерона плазмы и тканевого андростенона. Анти-ЛГРГ иммунный ответ измеряется по титру антител, который определяется по методике, описанной.,. , 1974, 75, 625-635. Связывание с мечеными пептидами определяется после мечения различных пептидов йодом-125 по., , 1979, 104, 1504-1506. Определение сывороток по отношению к этим пептидам проводится по методике., указанной выше. Биологическая активность измеряется по снижению или исчезновению тестостерона из плазмы и андростенона в тканях. Анализ тестостерона в плазме проводится прямым способом радиоиммунным анализом с 11 использованием радиолиганда тестостерона С 19-карбоксиметиловый эфир 125 гистамина ( .., 1972, 16, 415). Определение тканевого андростенона проводится в пробе жировой ткани радиоиммунным методом с радиолигандом 5-3 Нандростеноном, описанным , . ., , 1974, 278, 299-302. В. Преобладание иммунного ответа у кабанов на фракцию с карбокси-концом пептида ЛГРГ, конъюгированного при помощи карбодиимида или его агониста (-Лиз 6)-ЛГРГ, конъюгированного с помощьюс человеческим -глобулином..1. Приготовление конъюгата ЛГРГ с человеческим -глобулином при помощи карбодиимида. Конъюгат предпочтительно получается при добавлении от 0,5 до 2 объемов 2,5 раствора -этил-1-(3 диметиламинопропил)-карбодиимид (ЭДК) гидрохлорида в 0,9 к 1 объему смеси -глобулина с ЛГРГ в растворе, содержащем от 2 до 20 мг на 1 мл 0,9. После перемешивания смесь оставляют на ночь и затем очищают гель-фильтрацией. В.2. Приготовление конъюгатов (-Лиз 6)-ЛГРГ с человеческим -глобулином при помощи . Приготовление конъюгатов (-Лиз 6)-ЛГРГ с человеческим -глобулином проводится в три стадии приготовление -3-(2-пиридилдитио)пропаноил- (-Лиз 6-ЛГРГ, приготовление -(3-меркаптопропаноил) человеческого -глобулина и конъюгирование.-3-(2-Пиридилдитио)пропаноил- (-Лиз 6-ЛГРГ готовится путем реакции избыткас ЛГРГ в водном растворе (6 мольна моль (-Лиз 6)-ЛГРГ) и затем, после стояния при 4 С в течение ночи, получают продукт центрифугированием. Осадок растворяется в 8 М мочевине и определяют присутствие 2 пиридилтио-групп.-(3-Меркаптопропаноил)-человеческий -глобулин получется противодействием 0,2 млна 0,5 г человеческого -глобулина, растворенного в 100 мл 0,1 М фосфатного буфера, и затем, после контакта в течение ночи при 4 С и подкисления до рН 6, восстановлением дитиотреитолом. Затем реагент очищается гель-фильтрационной хроматографией. Определение тиола и протеина дает средний уровень замещения. Конъюгирование осуществляется соединением одной группы 2-пиридилдитио- с 1,25 тиоловых групп. Устанавливается рН на уровне 7-7,5 и через 1 ч определяют выход по измерению освобожденного 2 пиридинтиона. Средний уровень замещения выводится по этому показателю. Наконец, конъюгат очищается хроматографией и концентрируется ультрафильтрацией. Общий выход конъюгированного (-Лиз 6)-ЛГРГ составляет порядка 45-50 . В.3. Преобладание иммунного ответа у кабанов на фракцию с карбокси-концом ЛГРГ-пептида, конъюгированного способом, описанным в А.1 и А.2, определяется путем сравнения связывания анти-ЛГРГ и анти(-Лиз 6)-ЛГРГ сыворотками двух меченых фрагментов ЛГРГ,ЛГРГ (3-10) (ЛГРГ исключается из-за присутствия фракции с аминоконцом) и ЛГРГ (1-10) в форме свободной кислоты (ЛГРГ исключается из-за присутствия амидной фракции карбокси конца) соответственно. Эти фракции распознают более специфически антитела и, соответственно, фракции карбокси-конца, с одной стороны, и фракции аминоконца, с другой стороны. Ответ на фракцию с карбокси концом пептида является общим у всех животных, иммунизированных тем или иным конъюгатом (68/68). Сыворотки 3 из 10 животных, иммунизированных конъюгированным (Лиз 6)-ЛГРГ, и 10 из 68 животных, иммунизированных конъюгированным ЛГРГ, давали исключительное связывание фракции карбокси конца. Другие животные давали смешанный ответ, преимущественно направленный на фракцию карбокси конца. Ответ на фракцию аминоконца давали не все животные (55/68). Ни одна из сывороток не давала исключительного связывания с фракцией ЛГРГ в виде свободной кислоты. С. Испытания активной анти-ЛГРГ иммунонейтрализации конъюгатами ЛГРГ (3-10)-лошадиный глобулин -4 и ЛГРГ (3-10)-яичный альбумин, полученными с помощью карбодиимида..1. Приготовление конъюгата ЛГРГ (3-10)-лошадиный -глобулин -4 при помощи карбодиимида. 85 мг ЛГРГ (3-10) и 170 мг лошадиного -глобулина растворяются в 12,8 мл 0,1 М /0,1 М 2-(морфолино)-этансульфокислотного буфера. Затем добавляют 212 мг-этил-1(3 диметиламинопропил)карбодиимидгидрохлорида, растворенных в 17 мл вышеуказанного раствора. Немедленно доводят рН до 6,0 добавлением 1,3 мл 1 н гидроксида натрия. После перемешивания смесь оставляют стоять 16 ч при комнатной температуре и затем очищают гельфильтрацией, отделяя коньюгированный ЛГРГ от неконъюгированного. Измерение количества последнего дает возможность по разнице определить количество конъюгированного ЛГРГ. Можно определить выход конъюгирования. С.2. Приготовление конъюгата ЛГРГ (3-10)-яичный альбумин с карбодиимидом. 60 мг ЛГРГ (3-10) и 120 мг яичного альбумина растворяют в 9 мл 0,1 М /0,1 М 2-(-мфлин)этнульфкилтнг буфера. 150 мг -этил-1-(3-диметиламинопропил)карбодиимидгидрохлорида, растворенные в 12 мл того же самого буфера добавляются после этого. Добавлением 1 н гидроксида натрия(приблизительно 1,9 мл) доводят рН до 7,0. Смесь оставляют на ночь при комнатной температуре и потом осветляют центрифугированием. Надосадочную жидкость хроматографируют на -геле, чтобы отде 12 3685 1 лить конъюгированный ЛГРГ от неконъюгированного и от продуктов карбодиимида. По измерению количества несвязанного ЛГРГ (3-10) возможно установить выход конъюгирования ЛГРГ (3-10). С.3. Иммунный ответ, биологическая эффективность и толерантность к вакцине анти-ЛГРГ, приготовленной из конъюгата, полученного из фрагментов ЛГРГ (3-10) и лошадиного -глобулина -4 с карбодиимидом. Составы, включающие конъюгированный ЛГРГ (3-10), приготовленные в виде эмульсии вода-в-масле (1 я вакцина) и в виде геля гидроксида алюминия с сапонином (2-ая вакцина) вводилась чрезкожно 6 кабанам в объеме 0,4 мл на дозу, в начале периода откорма и за 17 дней до забоя соответственно при помощи безыгольного инъектора, известного под названием , выделяющего вакцину порциями по 0,2 мл, распределенными по 5 точкам введения для каждой порции. Имунный ответ был максимальным через 10 дней после введения 2-ой вакцины. У отдельных животных титры антител (реципрокные вычисления разведения, при котором связывается 50 йода-125) были соответственно Таблица 12 10 день 280 660 2700 3200 4600 13000 16 день 290 400 2000 2400 3100 8600 Биологическая эффективность этого иммунного ответа проявляется исчезновением тестостерона из плазмы с 10-го дня после введения 2-ой вакцины у всех 11 животных. Исчезновение тестостерона сопровождалось при тех же условиях исчезновением тканевого андростенона. Толерантность к вакцине доказывается развитием воспалительной кожной реакции, градация которой зависит от размера папул, появляющихся в каждом месте введения вакцины. Это местное воспаление полностью исчезает через 10 дней после введения 2-й вакцины. Государственный патентный комитет Республики Беларусь. 220072, г. Минск, проспект Ф. Скорины, 66. 13
МПК / Метки
МПК: A61K 38/09, A61K 39/385, A61K 39/395, C07K 7/23
Метки: органолептических, мяса, животных, домашних, некастрированных, самцов, улучшения, качеств, способ
Код ссылки
<a href="https://by.patents.su/13-3685-sposob-uluchsheniya-organolepticheskih-kachestv-myasa-nekastrirovannyh-samcov-domashnih-zhivotnyh.html" rel="bookmark" title="База патентов Беларуси">Способ улучшения органолептических качеств мяса некастрированных самцов домашних животных</a>
Предыдущий патент: Гетероарилпроизводные и фармацевтические композиции на их основе
Следующий патент: Способ производства восстановленного табачного листа
Случайный патент: Очистной комбайн