Способ диагностики фасциолеза крупного рогатого скота
Номер патента: 15488
Опубликовано: 28.02.2012
Авторы: Якубовский Мирослав Викторович, Трус Иван Анатольевич, Степанова Елена Анатольевна, Мясцова Татьяна Яковлевна
Текст
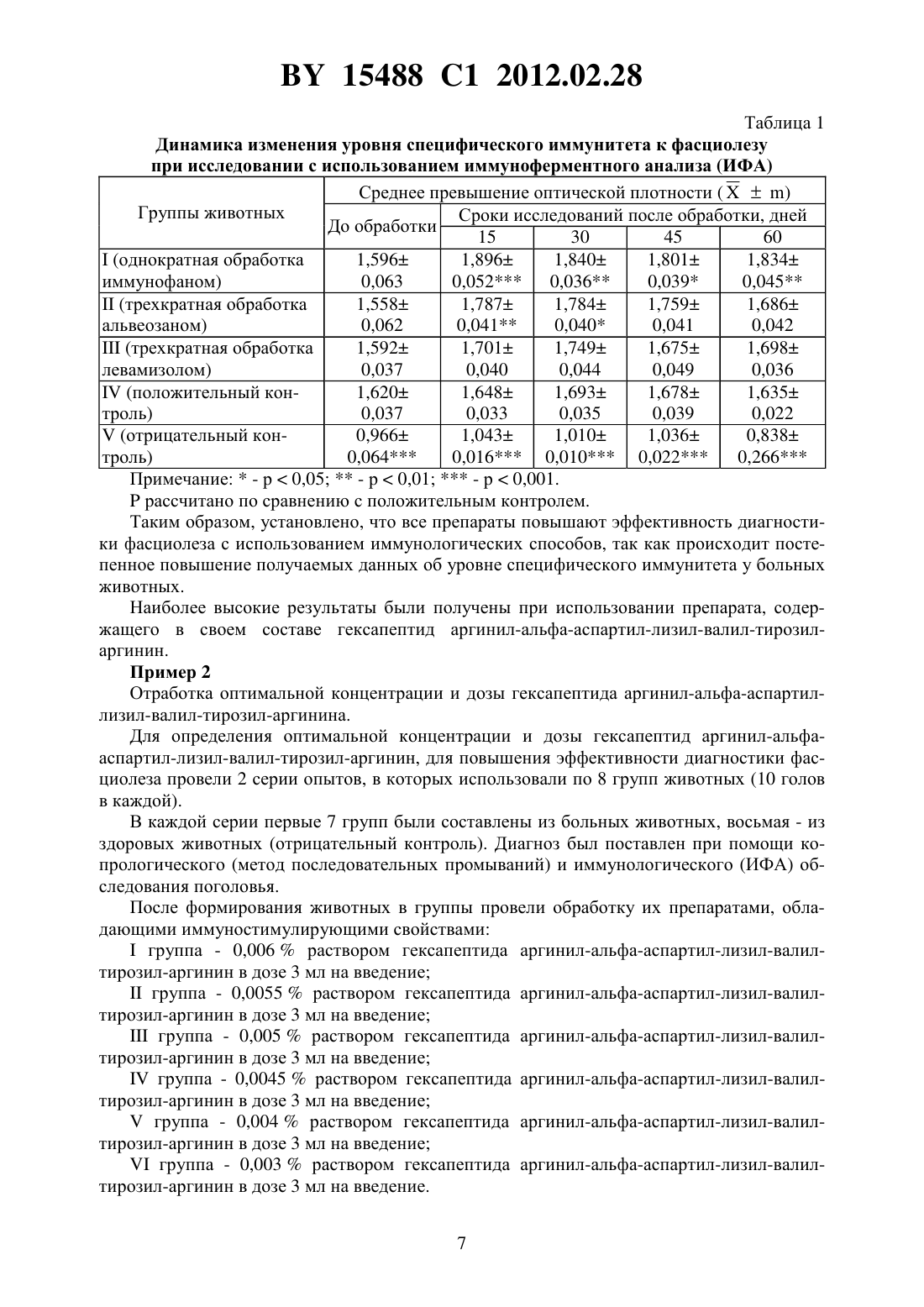
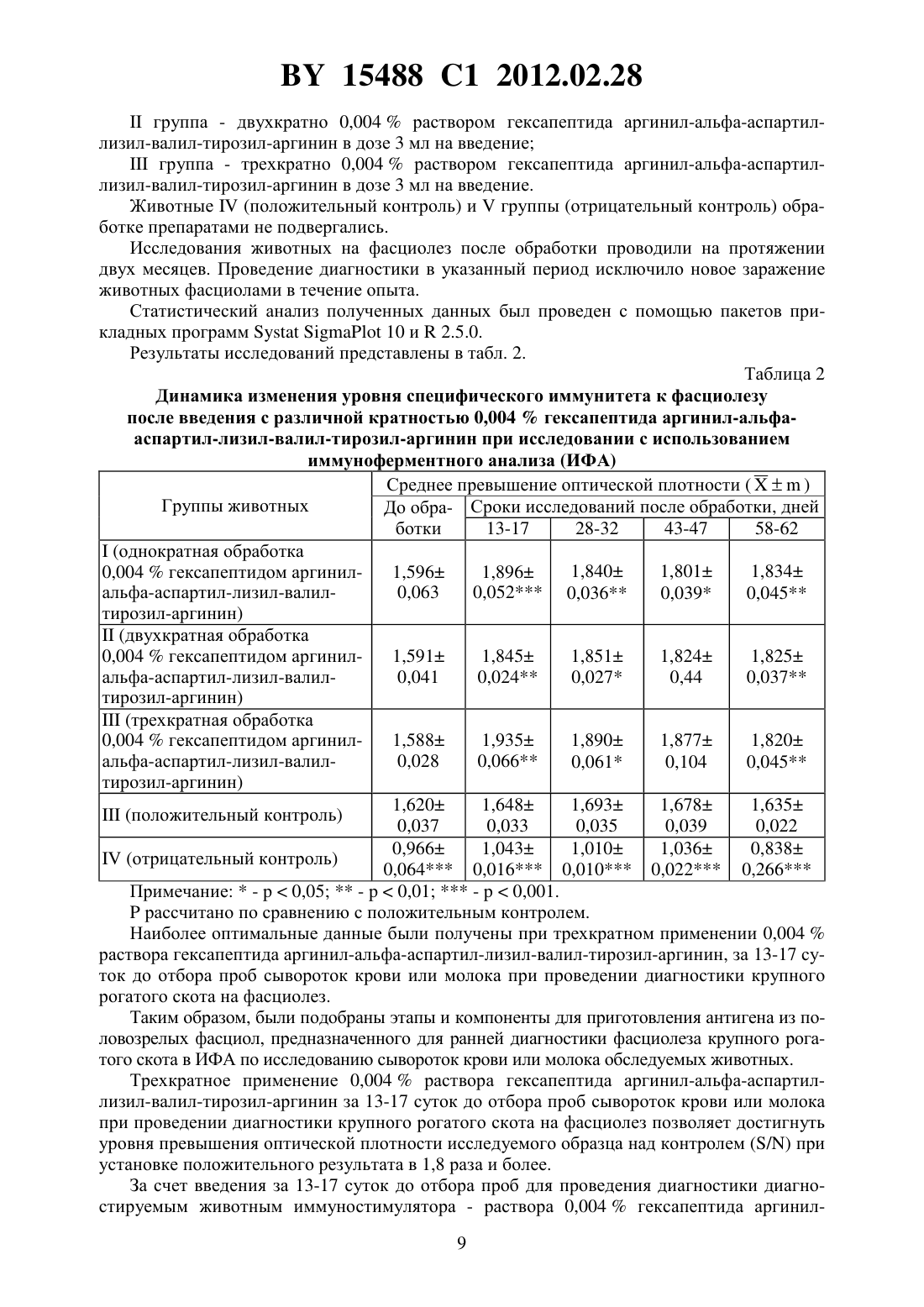
(51) МПК НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СПОСОБ ДИАГНОСТИКИ ФАСЦИОЛЕЗА КРУПНОГО РОГАТОГО СКОТА(71) Заявитель Республиканское научноисследовательское дочернее унитарное предприятие Институт экспериментальной ветеринарии имени С.Н.Вышелесского(72) Авторы Якубовский Мирослав Викторович Степанова Елена Анатольевна Трус Иван Анатольевич Мясцова Татьяна Яковлевна(73) Патентообладатель Республиканское научно-исследовательское дочернее унитарное предприятие Институт экспериментальной ветеринарии имени С.Н.Вышелесского(56)20080301, 2009. СЕМЕНОВА С.К. и др. Достижения и перспективы развития современной паразитологии ТрудыРеспубликанской научно-практической конференции. - Витебск, 2006. - С. 32-36. МУРОМЦЕВ А.Б. и др. Сельское хозяйство - проблемы и перспективы Сборник научных трудов. Т. 1, ч. 2. Гродно, 2003. - С. 226-229. ТРУС И.А. Ветеринарная наука - производству Научные труды. Вып. 39. Минск, 2007. - С. 256-262. ТРУС И.А. Исследования молодых ученых в решении проблем животноводства МатериалыМеждународной научно-практической конференции. - Витебск ВГАВМ, 2008. - С. 348349. ТРУС И.А. // Эпизоотология, иммунобиология, фармакология, санитария. 2007. -3. - С. 24-30.(57) Способ диагностики фасциолеза крупного рогатого скота, заключающийся в том, что диагностируемому животному вводят трехкратно с интервалом в 24 часа по 3 мл внутримышечно 0,004 -ный раствор аргинил-альфа-аспартил-лизил-валил-тирозил-аргинина,через 13-17 суток осуществляют отбор образца сыворотки крови или молока у диагностируемого животного, а также осуществляют отбор образца сыворотки крови или молока у здорового животного и проводят твердофазный иммуноферментный анализ указанных образцов с использованием соматического антигена, при этом антиген разводят 0,15 М карбонатно-бикарбонатным буфером 9,8, фиксируют в лунках иммунологического планшета при 4 , отмывают 0,1 М фосфатным буфером 7,4, содержащим 0,01 Твин-20, после чего в одни лунки планшета с антигеном вносят в качестве контроля сыворотку крови или молоко здорового животного, а в другие - сыворотку крови 15488 1 2012.02.28 или молоко диагностируемого животного, инкубируют при 37 в течение 1 часа, вносят в лунки пероксидазный конъюгат, содержащий антитела кбыка, инкубируют при 37 в течение 1 часа, затем вносят хромогенный субстрат, через 8-10 минут - серную кислоту, определяют интенсивность окраски в лунках при 450 нм и диагностируют фасциолез при превышении интенсивности окраски в лунке с сывороткой крови или молоком диагностируемого животного в 1,8 раза или более по сравнению с интенсивностью окраски в лунке с сывороткой крови или молоком здорового животного. Изобретение относится к области ветеринарной паразитологии, в частности к ранней иммунологической диагностике фасциолеза крупного рогатого скота. Фасциолез широко распространен в большинстве стран мира. На территории Республики Беларусь инвазированность крупного рогатого скота фасциолезом в среднем в 20022005 гг. регистрировалась на уровне 15,27 , в том числе коров - 17,891. Болезнь часто протекает хронически и характеризуется воспалительными явлениями желчных протоков, интерстициальными гепатитами, циррозами печени, общей интоксикацией организма и снижением молочной и мясной продуктивности животных 2. Естественными хозяевами при фасциолезе являются крупный рогатый скот и овцы,однако болезнь регистрируется и у лошадей, коз, свиней и других животных. Болеет фасциолезом и человек. На территории Республики Беларусь зарегистрировано заболевание человека фасциолезом. При сильном заражении крупного рогатого скота нередко наблюдается падеж, снижаются привесы и удои молока. Фасциолез снижает качество животноводческой продукции,понижаются племенные качества животных, молодняк от инвазированных животных рождается ослабленным и более восприимчивым к различным болезням. У инвазированных фасциолами животных снижается уровень иммунитета, в том числе и поствакцинального 3. Особенностью протекания фасциолеза является то, что на первых этапах заражения трудно диагностировать болезнь, так как отсутствуют клинические признаки. Скрытый период болезни продолжается не менее 5-6 недель. Позднее клиническая картина не позволяет ставить точный диагноз, так как симптомы, наблюдаемые при фасциолезе, не являются достаточно специфичными. Копрологические методы постановки диагноза своей целью ставят обнаружение яиц трематоды в кале животных. Однако развивающиеся в дефинитивном хозяине ювенильные формы .не выделяют яиц, что приводит к невозможности копрологической диагностики фасциолеза до развития половозрелых форм фасциол. Следует отметить, что и при эктопической локализации паразита (чаще в органах желудочно-кишечного тракта,реже в лимфоузлах, легких, сердце, кровеносных сосудах, под кожей и др.) также невозможно определение наличия инвазионного начала 4. Гельминты и выделяемые ими продукты жизнедеятельности несут антигенные свойства. Под воздействием этих антигенов в организме происходит ряд ответных иммунных процессов и мобилизация защитных механизмов при регулирующей роли нервной системы воспаление, аллергические реакции быстрого и замедленного типа, изменение функционирования - и -лимфоцитарных систем, активация макрофагов, эозинофилия,фагоцитоз. Происходит сенсибилизация организма, и образуются антитела - иммуноглобулины , ,и . Срок и количество их в крови животного зависит от напряженности иммунитета, интенсивности инвазии, стадии развития паразита, условий кормления и содержания животного, пола, возраста, физиологического состояния, наличия других болезней и т.д. 5, 6, 7. Иммуностимулирующие препараты, применяемые людям и животным, представляют собой класс веществ, способных влиять как на функционирование всей иммунной систе 2 15488 1 2012.02.28 мы, так и на ее отдельные элементы, и вследствие этого могут изменять иммунные реакции организма. В настоящее время неспецифические иммуностимуляторы находят применение в качестве средств для лечения заболеваний различной этиологии, патологических состояний и для их профилактики. Однако примеры использования иммуностимуляторов в качестве средства, способного повысить эффективность диагностики различных паразитарных болезней и фасциолеза в частности, отсутствуют в доступной нам литературе 8. Методы иммунодиагностики базируются на установлении изменений, развившихся в организме хозяина при его контакте с паразитом. В связи с тем, что паразитологические,посмертные и другие способы не всегда позволяют точно выявить наличие инвазионного заболевания, во многих странах мира ведутся работы по разработке высокоэффективных иммунологических способов их диагностики. Известен способ диагностики фасциолеза крупного рогатого скота с помощью реакции непрямой гемагглютинации 9. Принцип данного способа основан на том, что эритроциты, на которых предварительно адсорбированы антигены или антитела, способны агглютинироваться в присутствии гомологичных антител или антигенов 10. Для этого получают суспензию эритроцитов барана, отмывают физраствором, стабилизируют их 3 раствором формалина, танизируют раствором танина для повышения сорбционной способности и осаждаемости, сенсибилизируют раствором антигена 11,5 11. Исследуемые сыворотки разводят (15 - 15120) нормальной сывороткой, разведенной физраствором, и вносят по 0,5 мл каждого разведения в луночки пластин, добавляют 0,025 мл диагностикума. Реакцию учитывают спустя 2 часа по характеру осадка на дне лунок 12. Недостатком данного способа, несмотря на его достаточно высокую эффективность(80-100 ), является трудоемкость способа подготовки сенсибилизированных эритроцитов и других компонентов для реакции непрямой гемагглютинации. Недостатками данного способа также являются необходимость использования только сывороток крови обследуемых животных и невозможность постановки диагноза с использованием молока от инвазированных животных. Известен способ диагностики фасциолеза крупного рогатого скота с помощью непрямого неконкурентного твердофазного иммуноферментного анализа (ИФА) 13. Этот способ включает в себя разведение очищенного антигена 110 в 0,05 М фосфатносолевом буфере с 7,2-7,4. При инкубировании в течение 1 часа при температуре 37 или 10-12 часов при температуре 4 проводится фиксация в лунках пластикового планшета разведенного на фосфатно-солевом буфере белкового антигена. Отмывают фосфатно-солевым буфером с добавлением твина (ФСБТ) 0,05-0,1 . Вносят в лунки исследуемые сыворотки крови 140 - 1160. Повторно инкубируют в течение 1 часа при температуре 37 . Отмывают ФСБТ. Вносят пероксидазный конъюгат (антитела кбыка, меченые пероксидазой хрена). Инкубируют планшет в течение 45 минут при температуре 37 и, промыв планшет, определяют активность пероксидазы, входящей в состав конъюгата, с помощью хромогенного субстрата при длине волны 449 нм, остановив реакцию добавлением стоп-реагента (1 н ) после 15-30 минут инкубирования при комнатной температуре 14. Недостатком данного способа диагностики является то, что планшет инкубируют на начальном этапе 10-12 часов в холодильнике при 4 , столь короткий временной интервал не позволяет закрепиться полностью специфичным белкам антигена. Для разведения антигена используется ФСБ 110, при использовании которого не достигается максимально возможный уровень закрепления белка на пластике и происходит большой расход антигена. Для промывки планшета используется 0,05 М фосфатно-солевой буфер с 7,27,4, также раствор готовят с большой концентрацией твина. Приготовление ФСБ с приве 3 15488 1 2012.02.28 денными компонентами приводит к низкой буферной емкости полученного раствора, повышает его пенообразование, что понижает качество отмывки планшета (остатки пены на планшете и т.д.) и ухудшает конечную диагностическую значимость теста. Ферментативная реакция хромогенного субстрата останавливается спустя 15-30 минут добавлением стоп-реагента (1 н ), что удлиняет время постановки реакции и указывает на неоптимальные соотношения состава субстратной смеси. Добавление стоп-реагента с низкой концентрациейне останавливает реакцию полностью, что вносит ошибку в результаты окончательного измерения оптической плотности. Также недостатком данного способа является то, что в качестве исследуемого материала используется только сыворотка крови и не используется молоко обследуемых животных, так как предложенный в прототипе способ получения антигена не позволяет применить его для диагностики фасциолеза с использованием молока (недостоверные результаты). Мероприятие, связанное с взятием крови от исследуемых животных, требует дополнительных людских затрат, необходимых для фиксации крупного рогатого скота. Взятие крови оказывает негативное действие на самих животных, способствуя возникновению стресса, что приводит у них к снижению продуктивности. Ближайшим аналогом, т.е. прототипом, можно считать способ диагностики фасциолеза крупного рогатого скота с помощью непрямого неконкурентного твердофазного иммуноферментного анализа (ИФА) 15. Этот способ включает в себя получение антигена для диагностики фасциолеза и способ диагностики фасциолеза крупного рогатого скота. Для приготовления антигена половозрелых фасциол 5-6 раз отмывают в физиологическом растворе. Фасциол гомогенизируют в течение 15-25 мин при 4-10 , гомогенат центрифугируют при 5000 в течение 20 минут. Далее полученный раствор подвергают ультразвуковой дезинтеграции на УЗДН-1 при 35 кГц. Содержание белка в антигене определяют методом осаждения ТХУ и спектрофотометрии при 540 нм. Доводят содержание белка в полученном растворе до 1,2 мг/мл (физиологическим раствором). Готовят рабочее разведение антигена для иммобилизации панелей (разводят антиген 1100 до концентрации белка 12 мкг/мл). Антиген разводят на карбонатно-бикарбонатном буфере 9,8 (0,15 ). В лунки иммунологического планшета вносят 0,1 мл антигена, разведенного 0,15 КББ 9,8. Планшет с антигеном инкубировали 18-24 ч при 4 , после этого удаляют избыток антигена пятикратной отмывкой ФСБТ (0,1 фосфатный буфер на бидистиллированной воде, 0,05 Твин-20,7,4). Вносят в лунки 0,1 мл сыворотки крови (разведение 1100) или молока (разведение 125) в растворе ФСБ (0,1 фосфатный буфер на бидистиллированной воде,7,4). Инкубируют 1 ч при 37 , промывают лунки ФСБТ и добавляют 0,05 мл меченных пероксидазой антител ккрупного рогатого скота в растворе ФСБ. Через 1 ч инкубации отмывают планшет ФСБТ и вносят в лунки 0,05 мл субстратного раствора перекиси водорода с ортофенилендиамином (ОФД). Инкубируют 10 минут при комнатной температуре и останавливают реакцию добавлением 0,1-0,15 мл 324. Интенсивность окраски в лунках определяют на спектрофотометре при 450 нм (450). Превышение оптической плотности исследуемого образца над контролем (/) в 1,5 раза и более свидетельствует об инвазировании крупного рогатого скота фасциолами - больное животное. Недостатком данного способа является низкий уровень превышения оптической плотности исследуемого образца над контролем (/) при установке положительного результата, что повышает количество сомнительных результатов при постановке диагноза на фасциолез, так как на отрицательно реагирующих животных в ИФА приходится незначительный диапазон значений / от 1,0 до 1,49. 4 15488 1 2012.02.28 Задачей, на решение которой направлено заявленное изобретение, является создание дешевого, более эффективного способа диагностики фасциолеза крупного рогатого скота,позволяющего более эффективно диагностировать болезнь на начальных этапах развития заболевания. Поставленная задача достигается тем, что способ диагностики фасциолеза крупного рогатого скота заключается в том, что диагностируемому животному вводят трехкратно с интервалом в 24 часа по 3 мл внутримышечно 0,004 -ный раствор аргинил-альфааспартил-лизил-валил-тирозил-аргинина, через 13-17 суток осуществляют отбор образца сыворотки крови или молока у диагностируемого животного, а также осуществляют отбор образца сыворотки крови или молока у здорового животного и проводят твердофазный иммуноферментный анализ указанных образцов с использованием соматического антигена, при этом антиген разводят 0,15 карбонатно-бикарбонатным буфером 9,8, фиксируют в лунках иммунологического планшета при 4 , отмывают 0,1 фосфатным буфером 7,4, содержащим 0,01 Твин-20, после чего в одни лунки планшета с антигеном вносят в качестве контроля сыворотку крови или молоко здорового животного, а в другие - сыворотку крови или молоко диагностируемого животного,инкубируют при 37 в течение 1 часа, вносят в лунки пероксидазный конъюгат, содержащий антитела кбыка, инкубируют при 37 в течение 1 часа, затем вносят хромогенный субстрат, через 8-10 минут - серную кислоту, определяют интенсивность окраски в лунках при 450 нм и диагностируют фасциолез при превышении интенсивности окраски в лунке с сывороткой крови или молоком диагностируемого животного в 1,8 раза или более по сравнению с интенсивностью окраски в лунке с сывороткой крови или молоком здорового животного. Таким образом, за счет введения за 13-17 суток до отбора проб сывороток крови или молока для проведения диагностики диагностируемым животным раствора 0,004 гексапептида аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин трехкратно с интервалом 24 часа в дозе 3 мл/гол. внутримышечно позволило увеличить показатель / до 1,8, что, в свою очередь, увеличивает интервал значений для отрицательно реагирующих в ИФА животных (1,0-1,79), что уменьшает процент неправильно поставленных диагнозов за счет снижения процента сомнительных результатов. Готовят антиген для диагностики фасциолеза. Для приготовления антигена половозрелых фасциол 5-6 раз отмывают в физиологическом растворе. Фасциол гомогенизируют в течение 15-25 мин при 4-10 , гомогенат центрифугируют при 5000 в течение 20 минут. Далее полученный раствор подвергают ультразвуковой дезинтеграции на УЗДН-1 при 35 кГц. Содержание белка в антигене определяют методом осаждения ТХУ и спектрофотометрии при 540 нм. Доводят содержание белка в полученном растворе до 1,2 мг/мл (физиологическим раствором). Готовят рабочее разведение антигена для иммобилизации панелей (разводят антиген 1100 до концентрации белка 12 мкг/мл). Антиген разводят на карбонатно-бикарбонатном буфере 9,8 (0,15 ). Для диагностики фасциолеза крупного рогатого скота применяют непрямую гетерогенную твердофазную модификацию ИФА. В лунки иммунологического планшета вносят 0,1 мл антигена, разведенного 0,15 КББ 9,8. Планшет с антигеном инкубируют 18-24 ч при 4 , после этого удаляют избыток антигена пятикратной отмывкой ФСБТ (0,1 фосфатный буфер на бидистиллированной воде, 0,05 Твин-20, рН 7,4). Вносят в лунки 0,1 мл сыворотки крови (разведение 1100) или молока (разведение 125) в растворе ФСБ (0,1 фосфатный буфер на бидистиллированной воде,7,4). Инкубируют 1 ч при 37 , промывают лунки ФСБТ и добавляют 0,05 мл меченных пероксидазой антител ккрупного рогатого скота в растворе ФСБ. Через 1 ч инкубации отмывают планшет ФСБТ и вносят в лунки 0,05 мл 5 15488 1 2012.02.28 субстратного раствора перекиси водорода с ортофенилендиамином (ОФД). Инкубируют 10 минут при комнатной температуре и останавливают реакцию добавлением 0,1-0,15 мл 324. Интенсивность окраски в лунках определяют на спектрофотометре при 450 нм(450). Превышение оптической плотности исследуемого образца над контролем (/) в 1,8 раза и более свидетельствует об инвазировании крупного рогатого скота фасциолами больное животное. При показателе / менее 1,8 - здоровое животное. Сущность изобретения иллюстрируется следующими примерами. Пример 1 Выбор действующего вещества в качестве иммуностимулятора. В качестве иммуностимулирующих препаратов были использованы препараты, содержащие в своем составе различные действующие вещества иммунофан (содержащий в своем составе 0,005 гексапептид аргинил-альфа-аспартил-лизил-валил-тирозиларгинин), альвеозан (липополисахаридная фракция бактериальной массы возбудителя европейского гнильца пчел Вас. ) и левамизол (7,5 раствор левамизола гидрохлорида). Согласно литературным данным, эти вещества способны усиливать фагоцитарную активность нейтрофилов и моноцитов, стимулируют лейкопоэз, способствуют более длительной циркуляции специфических антител, увеличивая их титр, восстанавливают клеточный и гуморальный иммунитет. Сформировали 5 групп животных по 10 голов в каждой. Первые четыре группы были составлены из больных животных, пятая - из здоровых животных (отрицательный контроль). Диагноз был поставлен при помощи копрологического (метод последовательных промываний) и иммунологического (ИФА) обследования поголовья. После формирования животных в группы провели обработку их препаратами, обладающими иммуностимулирующими свойствамигруппа - однократно иммунофаном, содержащим в своем составе 0,005 гексапептид аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин в дозе 3 мл на введениегруппа - трехкратно альвеозаном, содержащим в своем составе липополисахаридную фракцию бактериальной массы возбудителя европейского гнильца пчел . , в дозе 3 мл на введение с интервалом 24 часагруппа - трехкратно левамизолом в дозе 16 мл на введение с интервалом 24 часа. Животные(положительный контроль) игруппы (отрицательный контроль) обработке препаратами не подвергались. Исследования животных на фасциолез после обработки проводили с интервалом 15 суток на протяжении двух месяцев (4 исследования). Проведение диагностики в указанный период исключило новое заражение животных фасциолами в течение опыта. Статистический анализ полученных данных был проведен с помощью пакетов прикладных программ 10 и 2.5.0. Изучение полученных показателей при иммунодиагностике фасциолеза у больных животных, обработанных иммуностимуляторами, позволяет обнаружить закономерное превышение оптической плотности в ИФА (табл. 1). 15488 1 2012.02.28 Таблица 1 Динамика изменения уровня специфического иммунитета к фасциолезу при исследовании с использованием иммуноферментного анализа (ИФА) Среднее превышение оптической плотности Группы животных Сроки исследований после обработки, дней До обработки 15 30 45 60(однократная обработка 1,596 1,896 1,840 1,801 1,834 иммунофаном) 0,063 0,052 0,036 0,039 0,045(трехкратная обработка 1,558 1,787 1,784 1,759 1,686 альвеозаном) 0,062 0,041 0,040 0,041 0,042(трехкратная обработка 1,592 1,701 1,749 1,675 1,698 левамизолом) 0,037 0,040 0,044 0,049 0,036(положительный кон 1,620 1,648 1,693 1,678 1,635 троль) 0,037 0,033 0,035 0,039 0,022(отрицательный кон 0,966 1,043 1,010 1,036 0,838 троль) 0,064 0,016 0,010 0,022 0,266 Примечание- р 0,05- р 0,01- р 0,001.рассчитано по сравнению с положительным контролем. Таким образом, установлено, что все препараты повышают эффективность диагностики фасциолеза с использованием иммунологических способов, так как происходит постепенное повышение получаемых данных об уровне специфического иммунитета у больных животных. Наиболее высокие результаты были получены при использовании препарата, содержащего в своем составе гексапептид аргинил-альфа-аспартил-лизил-валил-тирозиларгинин. Пример 2 Отработка оптимальной концентрации и дозы гексапептида аргинил-альфа-аспартиллизил-валил-тирозил-аргинина. Для определения оптимальной концентрации и дозы гексапептид аргинил-альфааспартил-лизил-валил-тирозил-аргинин, для повышения эффективности диагностики фасциолеза провели 2 серии опытов, в которых использовали по 8 групп животных (10 голов в каждой). В каждой серии первые 7 групп были составлены из больных животных, восьмая - из здоровых животных (отрицательный контроль). Диагноз был поставлен при помощи копрологического (метод последовательных промываний) и иммунологического (ИФА) обследования поголовья. После формирования животных в группы провели обработку их препаратами, обладающими иммуностимулирующими свойствамигруппа - 0,006 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 3 мл на введениегруппа - 0,0055 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 3 мл на введениегруппа - 0,005 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 3 мл на введениегруппа - 0,0045 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 3 мл на введениегруппа - 0,004 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 3 мл на введениегруппа - 0,003 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 3 мл на введение. 7 15488 1 2012.02.28 Животные(положительный контроль) игруппы (отрицательный контроль) обработке препаратами не подвергались. Исследования животных на фасциолез после обработки проводили с интервалом 15 суток на протяжении двух месяцев (4 исследования). Проведение диагностики в указанный период исключило новое заражение животных фасциолами в течение опыта. Статистический анализ полученных данных был проведен с помощью пакетов прикладных программ 10 и 2.5.0. В результате проведенных исследований установлено, что наиболее высокое превышение оптической плотности в ИФА наблюдалось при введении 0,0045-0,0040 растворов гексапептида аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин в дозе 3 мл на введение. Во второй серии опыта провели исследования по определению оптимальной дозы введения раствора гексапептида аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин. После формирования животных в группы провели обработку их препаратами, обладающими иммуностимулирующими свойствамигруппа - 0,0045 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 2 мл на введениегруппа - 0,0045 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 3 мл на введениегруппа - 0,0045 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 4 мл на введениегруппа - 0,004 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 2 мл на введениегруппа - 0,004 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 3 мл на введениегруппа - 0,004 раствором гексапептида аргинил-альфа-аспартил-лизил-валилтирозил-аргинин в дозе 4 мл на введение. Животные(положительный контроль) игруппы (отрицательный контроль) обработке препаратами не подвергались. Исследования животных на фасциолез после обработки проводили с интервалом 15 суток на протяжении двух месяцев (4 исследования). Проведение диагностики в указанный период исключило новое заражение животных фасциолами в течение опыта. Статистический анализ полученных данных был проведен с помощью пакетов прикладных программ 10 и 2.5.0. В результате исследований установлено, что наиболее высокое превышение оптической плотности в ИФА наблюдалось при введении 0,0040 раствора гексапептида аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин в дозе 3 мл на введение. Пример 3 Отработка кратности и сроков введения 0,0040 раствора гексапептида аргинилальфа-аспартил-лизил-валил-тирозил-аргинин. Для определения оптимальной кратности введения 0,004 раствора гексапептида аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин для повышения эффективности диагностики фасциолеза сформировали 5 групп животных по 10 голов в каждой. Первые четыре группы были составлены из больных животных, пятая - из здоровых животных (отрицательный контроль). Диагноз был поставлен при помощи копрологического (метод последовательных промываний) и иммунологического (ИФА) обследования поголовья. После формирования животных в группы провели обработку их препаратами, обладающими иммуностимулирующими свойствамигруппа - однократно 0,004 раствором гексапептида аргинил-альфа-аспартил-лизилвалил-тирозил-аргинин в дозе 3 мл на введение 8 15488 1 2012.02.28 группа - двухкратно 0,004 раствором гексапептида аргинил-альфа-аспартиллизил-валил-тирозил-аргинин в дозе 3 мл на введениегруппа - трехкратно 0,004 раствором гексапептида аргинил-альфа-аспартиллизил-валил-тирозил-аргинин в дозе 3 мл на введение. Животные(положительный контроль) игруппы (отрицательный контроль) обработке препаратами не подвергались. Исследования животных на фасциолез после обработки проводили на протяжении двух месяцев. Проведение диагностики в указанный период исключило новое заражение животных фасциолами в течение опыта. Статистический анализ полученных данных был проведен с помощью пакетов прикладных программ 10 и 2.5.0. Результаты исследований представлены в табл. 2. Таблица 2 Динамика изменения уровня специфического иммунитета к фасциолезу после введения с различной кратностью 0,004 гексапептида аргинил-альфааспартил-лизил-валил-тирозил-аргинин при исследовании с использованием иммуноферментного анализа (ИФА) Среднее превышение оптической плотности Группы животных До обра- Сроки исследований после обработки, дней ботки 13-17 28-32 43-47 58-62(однократная обработка 1,840 1,801 1,834 0,004 гексапептидом аргинил 1,596 1,896 альфа-аспартил-лизил-валил 0,063 0,052 0,036 0,039 0,045 тирозил-аргинин)(двухкратная обработка 1,851 1,824 1,825 0,004 гексапептидом аргинил 1,591 1,845 альфа-аспартил-лизил-валил 0,041 0,024 0,027 0,44 0,037 тирозил-аргинин)(трехкратная обработка 1,890 1,877 1,820 0,004 гексапептидом аргинил 1,588 1,935 альфа-аспартил-лизил-валил 0,028 0,066 0,061 0,104 0,045 тирозил-аргинин) 1,693 1,678 1,635 1,620 1,648(положительный контроль) 0,037 0,033 0,035 0,039 0,022 1,010 1,036 0,838 0,966 1,043(отрицательный контроль) 0,064 0,016 0,010 0,022 0,266 Примечание-0,05-0,01-0,001.рассчитано по сравнению с положительным контролем. Наиболее оптимальные данные были получены при трехкратном применении 0,004 раствора гексапептида аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин, за 13-17 суток до отбора проб сывороток крови или молока при проведении диагностики крупного рогатого скота на фасциолез. Таким образом, были подобраны этапы и компоненты для приготовления антигена из половозрелых фасциол, предназначенного для ранней диагностики фасциолеза крупного рогатого скота в ИФА по исследованию сывороток крови или молока обследуемых животных. Трехкратное применение 0,004 раствора гексапептида аргинил-альфа-аспартиллизил-валил-тирозил-аргинин за 13-17 суток до отбора проб сывороток крови или молока при проведении диагностики крупного рогатого скота на фасциолез позволяет достигнуть уровня превышения оптической плотности исследуемого образца над контролем (/) при установке положительного результата в 1,8 раза и более. За счет введения за 13-17 суток до отбора проб для проведения диагностики диагностируемым животным иммуностимулятора - раствора 0,004 гексапептида аргинил 9 15488 1 2012.02.28 альфа-аспартил-лизил-валил-тирозил-аргинин трехкратно с интервалом 24 часа в дозе 3 мл/гол. внутримышечно увеличивают показатель / до 1,8, что, в свою очередь, увеличивает интервал значений для отрицательно реагирующих в ИФА животных (1,0-1,79),что уменьшает процент неправильно поставленных диагнозов за счет снижения процента сомнительных результатов. Использование вышеуказанных параметров в их совокупности позволило подобрать наиболее оптимальные этапы и компоненты для ранней диагностики фасциолеза крупного рогатого скота в ИФА. Источники информации 1. Якубовский М.В. Методические рекомендации. Фасциолез крупного рогатого скота(эпизоотология, иммунитет, иммунодиагностика и меры борьбы)/Якубовский М.В., Мясцова Т.Я., Лавор С.И., Щурова Н.Ю., Трус И.А. Утв. ГУВ МСХП 05.09.2006 г.10-15884. -Мн., 2007. - С. 6. 2. Скрябин К.И. Краткий курс паразитологии домашних животных Учебное пособие для с.-х. техникумов/К.И. Скрябин, А.М. Петров, И.О. Орлов и др. под ред. К.И. Скрябина. - Москва Гос. Изд-во с.-х. лит., 1950. - С. 214-224. 3. Ятусевич А.И. Паразитология и инвазионные болезни животных/А.И. Ятусевич,Н.Ф. Карасев, М.В. Якубовский. - Минск ИВЦ Минфина, 2007. - С. 56-64. 4./ (.),, ,1999. - Р. 544. 5. Демидов Н.В. Фасциолез / Н.В. Демидов//Итоги науки и техн. ВИНИТИ АН СССР. Сер. Зоопаразитология. - Москва, 1979, Т. 6. - С. 48. 6. Онуфриенко М.Э. Фасциолез крупного рогатого скота в Северо-Западном регионе России дис. д-ра вет. 03.00.19 16.00.04/М.Э. Онуфриенко. - СПб., 2004. - С. 67-87. 7. Онуфриенко М.Э. Фасциолез крупного рогатого скота в Северо-Западном регионе России дис. д-ра вет. 03.00.19 16.00.04/М.Э. Онуфриенко. - СПб., 2004. - С. 81-85. 8. Онуфриенко М.Э. Фасциолез крупного рогатого скота в Северо-Западном регионе России дис. д-ра вет. 03.00.19 16.00.04/М.Э. Онуфриенко. - СПб., 2004. - С. 81-85. 9. Онуфриенко М.Э. Фасциолез крупного рогатого скота в Северо-Западном регионе России дис. д-ра вет. 03.00.19 16.00.04/М.Э. Онуфриенко. - СПб., 2004. - С. 81-85. 10. Практикум по вирусологии / Под редакцией В.М. Жавненко. - Мн. ДизайнПРО,1998. - С. 144, ил. 11. Онуфриенко М.Э. Фасциолез крупного рогатого скота в Северо-Западном регионе России дис. д-ра вет. 03.00.19 16.00.04/М.Э. Онуфриенко. - СПб., 2004. - С. 81-85. 12. Онуфриенко М.Э. Фасциолез крупного рогатого скота в Северо-Западном регионе России дис. д-ра вет. 03.00.19 16.00.04/М.Э. Онуфриенко. - СПб., 2004. - С. 81-85. 13. Онуфриенко М.Э. Фасциолез крупного рогатого скота в Северо-Западном регионе России дис. д-ра вет. 03.00.19 16.00.04/М.Э. Онуфриенко. - СПб., 2004. - С. 85-86. 14. Онуфриенко М.Э. Фасциолез крупного рогатого скота в Северо-Западном регионе России дис. д-ра вет. 03.00.19 16.00.04/М.Э. Онуфриенко. - СПб., 2004. - С. 85-86. 15. Заяв.20080301 от 14.03.2008 г. на изобретение Способ получения антигена для диагностики фасциолеза и способ диагностики фасциолеза крупного рогатого скота/М.В. Якубовский, Е.А. Степанова, И.А. Трус, Т.Я. Мясцова заявитель РУП ИЭВ им. С.Н.Вышелесского//Афцыйны бюлетэнь. Вынаходствы, карысныя мадэл, прамысловыя зоры. - 2009. -5(70). - 30.10.09 (прототип). Национальный центр интеллектуальной собственности. 220034, г. Минск, ул. Козлова, 20. 10
МПК / Метки
МПК: G01N 33/543
Метки: скота, способ, фасциолеза, диагностики, крупного, рогатого
Код ссылки
<a href="https://by.patents.su/10-15488-sposob-diagnostiki-fascioleza-krupnogo-rogatogo-skota.html" rel="bookmark" title="База патентов Беларуси">Способ диагностики фасциолеза крупного рогатого скота</a>
Предыдущий патент: Способ индивидуального подбора химиопрепарата или комбинации химиопрепаратов для лечения астроцитомы у ребенка
Следующий патент: Способ хондропластики при рассекающем остеохондрите мыщелка бедренной кости коленного сустава
Случайный патент: Подпочвенная увлажнительно-осушительная система