Стероиды, обладающие противовоспалительной, иммуносупрессивной и противоаллергической активностью, способ их получения, фармацевтическая композиция на их основе
Номер патента: 4481
Опубликовано: 30.06.2002
Авторы: Бернар Ивон Жак ВАШЕ, Майкл Томас ВИТНЭЛЛ, Майкл Джон ЭШТОН, Свен Ян-Андерс КАРЛССОН
Текст
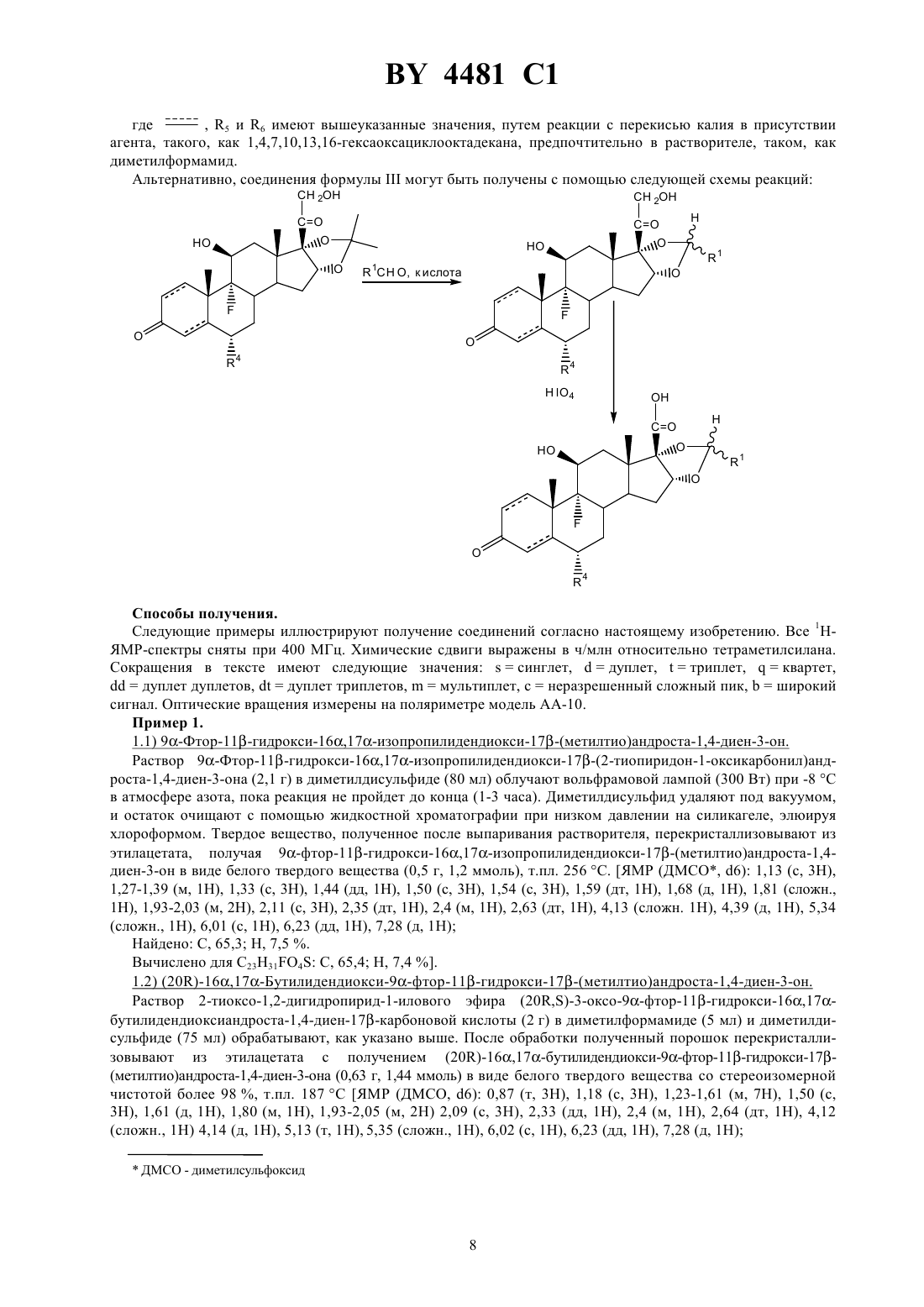
НАЦИОНАЛЬНЫЙ ЦЕНТР ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ СТЕРОИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ,ИММУНОСУПРЕССИВНОЙ И ПРОТИВОАЛЛЕРГИЧЕСКОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ(72) Авторы Майкл Джон ЭШТОН , Свен Ян-Андерс КАРЛССОН , Бернар Ивон Жак ВАШЕ , Майкл Томас ВИТНЭЛЛ(57) 1. Стероиды общей формулы 3 где независимо в каждом из положений 1,2 4,5 и 6,7 представляет собой простую или двойную связь 1 - линейный или разветвленный С 1-С 4-алкил или С 2-С 4-алкенил 2 - водород или метил 3 - 1-7-алкил, пиридил или -2, где- галоген, гидрокси, С 1-С 5-алкокси или С 1-С 10-алканоилокси в положении 6,7 является простой 4 - водород, галоген, гидрокси, кето или С 1-С 3-алкокси, когда связью, или водород, галоген или С 1-С 3-алкокси, когда 5 - водород или галоген в положении 1,2 является простой связью, или водород или хлор, когда 6 - водород, когда в положении 1,2 является двойной связью 0 - 2,их рацемические смеси или диастереоизомеры. 2. Соединение по п. 1, где представляет собой двойную связь в положениях 4,5 и простую связь в положении 1,2 и 6,7 4481 1 1 - линейный или разветвленный С 1-С 4-алкил 2 - водород или метил 3 - С 1-С 7-алкил, галоидметил или пиридил 4 - водород, галоген или кетогруппа 5 - галоген 6 - водород 0 - 2. 3. Соединение по п. 1, где представляет собой двойную связь в положениях 4,5 и простую связь в положении 1,2 и 6,7 1 - метил, пропил или транс-проп-1-енил 2 - водород или метил 3 - метил, фторметил или пиридил 4 - водород, фтор или кетогруппа 5 - фтор 6 - водород 0 - 2. 4. Соединение по любому из пп. 1-3, которое является (20) диастереоизомером. 5. Соединение по п. 1, выбранное из группы, включающей 9-фтор-11-гидрокси-16,17-изопропилидендиокси-17-(метилтио)андроста-1,4-диен-3-он 9-фтор-11-гидрокси-16,17-изопропилидендиокси-17-(метилсульфонил)андроста-1,4-диен-3-он 9-фтор-11-гидрокси-16,17-изопропилидендиокси-17-(2-пиридилтио)андроста-1,4-диен-3-он 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-17-(метилтио)андроста-1,4-диен-3-он и 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-17-(фторметилтио)андроста-1,4-диен-3 он. 6. Соединение по п. 1, выбранное из группы, включающей(20)-16,17-бутилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андрост-4-ен-3,6-дион. 8. (20)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-17-(метилтио)андрост-4-ен-3-он. 9. (20)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-17-(метилтио)андростан-3-он. 10. Фармацевтическая композиция для лечения и/или профилактики воспалительных заболеваний, аллергических заболеваний, иммунологических заболеваний, заболеваний кожи и желудочно-кишечного тракта,включающая терапевтически эффективное количество активного ингредиента и фармацевтически приемлемый носитель или покрытие, отличающаяся тем, что в качестве активного ингредиента она включает соединение формулыпо п. 1. 11. Стероид по п. 1, обладающий противовоспалительной, иммуносупрессивной и противоаллергической активностью. 12. Способ получения соединения формулыпо п. 1, включающий реакцию радикального замещения соединения формулы, 1, 2, 4, 5, 6 имеют указанные в п. 1 значения, - подходящая группа, такая как 2-тиоксо-1,2-дигидропирид-1-илоксикарбонил,путем облучения соединения формулыв присутствии соединения общей формулы 38,где 3 имеет значения, указанные в п. 1,8 - водород или 1-7-алкил,0 или 2,в атмосфере инертного газа, с последующим, если желательно, когда 1 или 2, окислением полученного соединения и, если необходимо, превращение полученного соединения в другие соединения формулыпо п. 1. 7 Настоящее изобретение относится к новым противовоспалительным, иммуносупрессивным и противоаллергическим соединениям и способам их получения. Изобретение также относится к фармацевтическим композициям, содержащим эти соединения. Изобретение также относится к фармакологическому использованию этих соединений. Более конкретно, настоящее изобретение относится к новым терапевтически полезным стероидам, способам их получения, фармацевтическим композициям, содержащим их, и способам их использования, в особенности в качестве противовоспалительных средств. Предметом изобретения являются стероиды, обладающие высокой противовоспалительной, иммуносупрессивной и противоаллергической активностью, или фармацевтическая композиция, содержащая их, с высокой активностью в месте нанесения, например, в дыхательных путях, на коже, в суставах, в кишечнике или в глазу, сочетаемой с низкой глюкокортикоидной системной активностью. Известно большое количество природных и синтетических стероидов, и многие из них полезны в лечении человека и животных. Стероиды, имеющие противовоспалительные свойства, известны, но они страдают тем недостатком, что, после их приема, они оказывают нежелательные побочные действия за пределами органа или ткани, которые нуждаются в лечении. Хорошо известно, что в фармацевтической области и, в частности,в области стероидов, небольшие различия в химическом строении могут давать соединения с совершенно различным фармакологическим действием. Настоящее изобретение предлагает соединения, которые никогда не были описаны до сих пор и которые обладают замечательным сочетанием полезной противовоспалительной активности с очень малой способностью давать нежелательные побочные эффекты. Номенклатура, используемая в настоящей заявке, следующая 20 4481 1 Положение 1,2 или положение 4,5 кольца А и положение 6,7 кольца В могут быть насыщены или иметь двойную связь. Соединения, согласно настоящему изобретению, могут быть описаны общей формулой 3 где независимо в каждом из положений 1,2 4,5 и 6,7 представляет собой простую или двойную связь 1 представляет собой прямой или разветвленный С 1-4 алкил или С 2-4 алкенил 2 представляет собой водород или метил 3 представляет собой 1-7 алкил, пиридил или -2, гдеобозначает гало, гидрокси, С 1-5 алкокси или С 1-10 алканоилокси в положении 6,7 об 4 представляет собой водород, гало, гидрокси, кето или С 1-3 алкокси, когда разует простую связь или водород, гало или С 1-3 алкокси, когда связь. 5 представляет собой водород или гало 6 представляет собой водород, когда в положении 1,2 является двойной связью и хлор, когдаравно 0-2 и их рацемические смеси или диастереоизомеры. Предпочтительные соединения настоящего изобретения описаны формулой , где представляет собой двойную связь в положениях 1,2 и 4,5 и простую связь в положении 6,7 или двойную связь в положении 4,5 и простые связи в положениях 1,2 и 6,7. Более предпочтительные соединения описываются формулой , где представляет собой двойную связь в положении 4,5 и простые связи в положениях 1,2 и 6,7 1 представляет собой алкил 2 представляет собой водород или метил 3 представляет собой алкил, галоалкил или пиридил 4 представляет собой водород, гало или кето 5 представляет собой гало 6 представляет собой водород иравно 0-2. Наиболее предпочтительные соединения, согласно настоящему изобретению, описываются формулой ,где представляет собой двойную связь в положении 4,5 и простые связи в положениях 1,2 и 6,7 1 представляет собой метил, пропил или транс-проп-1-енил 2 представляет собой водород или метил 3 представляет собой метил, фторметил или пиридил 4 представляет собой водород, фтор или кето 5 представляет собой фтор 6 представляет собой водород иравно 0-2. Описывается вариант настоящего изобретения, в котором ся простыми связями. в положениях 1,2 4,5 и 6,7 все являют 4481 1 Соединения формулымогут существовать в двух диастереоизомерных формах, так как возможны две различные конфигурации при углеродном атоме в положении 20. В результате, изобретение включает (20)и (20)-диастереоизомеры соединений формулыи их смеси, когда 1 и 2 различны. Предпочтительные диастереоизомерные компоненты находятся в (20)-конфигурации. Конкретнее, следующие соединения являются предметом настоящего изобретения 9-фтор-11-гидрокси-16,17-изопропилидендиокси-17-(метилтио)андроста-1,4-диен-3-он(20)-16,17-бутилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андрост-4-ен-3,6-дион. Соединения по настоящему изобретению чрезвычайно ценны в местном лечении воспалительных, аллергических и иммунологических заболеваний. Указанные виды лечения включают лечение таких заболеваний,которые в настоящее время лечатся известными стероидами, например, болезни дыхательной системы, та 5 4481 1 кие, как астма и ринит, болезни кожи, такие, как экзема, и болезни желудочно-кишечного тракта, такие, как воспалительное кишечное заболевание. Однако благодаря незначительному побочному действию или его полному отсутствию, соединения, согласно настоящему изобретению, значительно более желательны, чем ранее известные соединения. Использование соединений формулыи фармацевтических композиций, содержащих их, в лечении указанных болезней составляет предмет настоящего изобретения. Эта эффективность продемонстрирована в фармакологических испытаниях, которые, надо полагать, хорошо коррелируют с активностью в человеке и других млекопитающих. Соединения формулымогут быть получены путем применения или видоизменения известных способов,под которыми подразумеваются способы, использовавшиеся до сих пор или описанные в литературе. Соединения, согласно настоящему изобретению, могут быть получены, например, с помощью следующих реакций. Согласно настоящему изобретению, соединения формулы , гдепредставляет собой нуль, а, 1,2, 3, 4, 5 и 6 имеют вышеуказанные значения, получают реакцией радикального замещения из соединений формулы 7, 1, 2, 4, 5 и 6 имеют вышеуказанное значение,7 представляет собой подходящую группу, такую, как 2-тиоксо-1,2-дигидропирид-1-илоксикарбонильную группу, путем облучения в присутствии соединения общей формулы 38 ,где 3 имеет вышеуказанное значение, 8 представляет собой атом водорода или алкильную группу, содержащую до приблизительно 7 атомов углерода,равно 0 или 2, в атмосфере инертного газа. Согласно еще одному варианту настоящего изобретения соединения формулы , где 3 представляет со, 1, 2, 4, 5 и 6 имеют вышеуказанное значение, полубой пиридильную группу,равен нулю, а чают аналогичной реакцией радикальной фрагментации из соединений формулы , указанной выше, где, 1, 2, 4, 5 и 6 имеют вышеуказанное значение,7 представляет собой 2-тиоксо-1,2 дигидропирид-1-илоксикарбонильную группу, путем облучения в отсутствие указанных соединений общей формулы 38 . Согласно еще одному варианту изобретения, соединения формулымогут быть получены путем взаимопревращения других соединений формулы . Например, соединения формулы , где, 1, 2, 3, 4, 5 и 6 имеют равно 1 или 2, получают путем окисления соединений формулы , где вышеуказанное значение именьше, чем в желаемом продукте. Окисление может быть осуществлено путем использования обычного окислителя, такого, как пероксимоносульфат калия для получения продуктов, гдеравно 1, или перкислоты для получения продуктов, гдеравно 2. В качестве другого примера следует указать, что соединения формулы , где, 1, 2, 4, 5 и 6 имеют вышеуказанное значение,равно нулю,3 представляет собой галоидметильную группу, получа, 1, 2, 4, 5 и 6 имеют вышеуказанное ются путем галоидирования соединений формулы , где значение,равно нулю,3 представляет собой метильную группу. Например, когда 3 представляет собой фторметильную группу, реакция может проводиться под действием ксенондифторида, предпочтительно в присутствии активированного молекулярного сита и не-нуклеофильного основания. Еще один пример показывает, что соединения формулы , где, , 1, 2, 3, 5 и 6 имеют вышеуказанное значение,4 представляет собой алкоксигруппу, получают алкилированием соединений формулы , где, , 1, 2, 3, 5 и 6 имеют вышеуказанное значение,4 представляет собой гидрокси 6 4481 1 группу, известными способами, например, по реакции с основанием с последующей реакцией с алкилгалоидом, например, метилиодидом, где 4 является метокси. Согласно следующему примеру, соединения формулы , где один или более символов обозначают простую связь, при этом другие символы имеют вышеуказанные значения, получают из соединений формуобозначают двойные связи, путем гидрирования в присутст лы , где указанный символ или символы вии катализатора. Например, соединения формулы , где символ обозначает простую связь в положении 1,2, другие символы имеют вышеуказанные значения, получают из соединений формулы , где указанный символ обозначает двойную связь, путем гидрирования в присутствии соединения родия, например, бис(трифенилфосфин)хлорида родия. Диастереоизомеры общей формулымогут быть выделены из их смесей с помощью известных способов или их модификаций, например, хроматографическими или перекристаллизационными методами, или они могут быть приготовлены отдельно из соответствующих изомеров их промежуточных соединений, например, с помощью известных способов или их модификаций, описанных здесь. Исходные материалы и промежуточные соединения могут быть приготовлены путем применения известных способов или их модификаций, например способов, описанных в ссылочных примерах, или их очевидных химических эквивалентов. Например, соединения формулымогут быть получены из соединений формулы, 1, 2, 4, 5 и 6 имеют вышеуказанные значения, путем превращения карбоксигруппы в указанную группу 7 с помощью известных способов или их модификаций. Соединения формулымогут быть получены из соединений общей формулы, 4, 5 и 6 имеют вышеуказанные значения, реакцией с соединениями общей формулы 12 или 12(9)2 ,где 1 и 2 имеют вышеуказанные значения,9 представляет собой метильную или этильную группу, в присутствии протонной кислоты, например перхлорной кислоты. Соединения формулы , где 4 представляет собой гидроксильную группу,шеуказанные значения, могут быть приготовлены из соединений общей формулы, 5 и 6 имеют вышеуказанные значения, путем реакции с перекисью калия в присутствии где агента, такого, как 1,4,7,10,13,16-гексаоксациклооктадекана, предпочтительно в растворителе, таком, как диметилформамид. Альтернативно, соединения формулымогут быть получены с помощью следующей схемы реакций 2 Способы получения. Следующие примеры иллюстрируют получение соединений согласно настоящему изобретению. Все 1 НЯМР-спектры сняты при 400 МГц. Химические сдвиги выражены в ч/млн относительно тетраметилсилана. Сокращения в тексте имеют следующие значениясинглет,дуплет,триплет,квартет,дуплет дуплетов,дуплет триплетов,мультиплет, снеразрешенный сложный пик,широкий сигнал. Оптические вращения измерены на поляриметре модель -10. Пример 1. 1.1) 9-Фтор-11-гидрокси-16,17-изопропилидендиокси-17-(метилтио)андроста-1,4-диен-3-он. Раствор 9-Фтор-11-гидрокси-16,17-изопропилидендиокси-17-(2-тиопиридон-1-оксикарбонил)андроста-1,4-диен-3-она (2,1 г) в диметилдисульфиде (80 мл) облучают вольфрамовой лампой (300 Вт) при -8 С в атмосфере азота, пока реакция не пройдет до конца (1-3 часа). Диметилдисульфид удаляют под вакуумом,и остаток очищают с помощью жидкостной хроматографии при низком давлении на силикагеле, элюируя хлороформом. Твердое вещество, полученное после выпаривания растворителя, перекристаллизовывают из этилацетата, получая 9-фтор-11-гидрокси-16,17-изопропилидендиокси-17-(метилтио)андроста-1,4 диен-3-он в виде белого твердого вещества (0,5 г, 1,2 ммоль), т.пл. 256 С. ЯМР (ДМСО, 6) 1,13 (с, 3),1,27-1,39 (м, 1), 1,33 (с, 3), 1,44 (дд, 1), 1,50 (с, 3), 1,54 (с, 3), 1,59 (дт, 1), 1,68 (д, 1), 1,81 (сложн.,1), 1,93-2,03 (м, 2), 2,11 (с, 3), 2,35 (дт, 1), 2,4 (м, 1), 2,63 (дт, 1), 4,13 (сложн. 1), 4,39 (д, 1), 5,34(сложн., 1), 6,01 (с, 1), 6,23 (дд, 1), 7,28 (д, 1) Найдено С, 65,3 , 7,5 . Вычислено для 23314 С, 65,4 , 7,4 . 1.2) (20)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андроста-1,4-диен-3-он. Раствор 2-тиоксо-1,2-дигидропирид-1-илового эфира (20,)-3-оксо-9-фтор-11-гидрокси-16,17 бутилидендиоксиандроста-1,4-диен-17-карбоновой кислоты (2 г) в диметилформамиде (5 мл) и диметилдисульфиде (75 мл) обрабатывают, как указано выше. После обработки полученный порошок перекристаллизовывают из этилацетата с получением (20)-16,17-бутилидендиокси-9-фтор-11-гидрокси-17(метилтио)андроста-1,4-диен-3-она (0,63 г, 1,44 ммоль) в виде белого твердого вещества со стереоизомерной чистотой более 98 , т.пл. 187 С ЯМР (ДМСО, 6) 0,87 (т, 3), 1,18 (с, 3), 1,23-1,61 (м, 7), 1,50 (с,3), 1,61 (д, 1), 1,80 (м, 1), 1,93-2,05 (м, 2) 2,09 (с, 3), 2,33 (дд, 1), 2,4 (м, 1), 2,64 (дт, 1), 4,12 4481 1 Найдено С, 65,87,6 . Вычислено для С 24 Н 334 С, 66,0 , 7,6 . 1.3) (20)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-17-(метилтио)андроста-1,4-диен-3 он (20)-16,17-Бутилидендиокси-6,9-дифтор-11-гидрокси-17-(метилтио)андроста-1,4-диен-3-он. 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-3-оксо-6,9-дифтор-11-гидрокси-16,17-бутилидендиоксиандроста-1,4-диен-17-карбоновой кислоты (19,5 г), растворенной в дихлорметане (40 мл) и диметилдисульфиде (430 мл), облучают, как описано выше. Реакционную смесь концентрируют в вакууме,остаток помещают в этилацетат (400 мл) и промывают последовательно хлористоводородной кислотой (1,два раза, 200 мл), водой (200 мл) и рассолом (два раза по 200 мл). Этилацетатную фазу сушат над сульфатом натрия, и после фильтрации осушающего средства и концентрирования в вакууме получают бледножелтую пену (13,1 г), из которой смесь эпимеров (20,) в пропорции 80 к 20 разделяют с помощью препаративной жидкостной хроматографии высокого давления с использованием колонки-18 и смеси метанол/вода в качестве подвижной фазы. (20)-16,17-бутилидендиокси-6,9-дифтор-11 гидрокси-17-(метилтио)андроста-1,4-диен-3-он получают в виде твердого вещества белого цвета (6,55 г,14,4 ммоль), т.пл. 204-206 С а 26108, с 0,067 (3) ЯМР (ДМСО, 6) 0,87 (т, 3), 1,16 (с, 3),1,33-1,43 (м, 3), 1,43-1,54 (м, 1), 1,50 (с, 3), 1,54-1,63 (м, 3), 1,73 (д, 1), 1,97-2,08 (м, 2), 2,10 (с, 3),2,26 (сложн. 1), 2,48-2,63 (м, 1), 4,14 (сложн. 1), 4,16 (д, 1), 5,12 (т, 1), 5,43 (сложн., 1), 5,63 (м, 1),6,11 (с, 1), 6,30 (дд, 1), 7,26 (дд, 1) Найдено С, 63,4 , 7,3 . Вычислено для 243224 С, 63,47,1 . И с получением (20)-6,9-дифтор-11-гидрокси-16,17-бутилидендиокси-17-метилтиоандроста 1,4-диен-3-она в виде твердого вещества белого цвета (0,6 г), т.пл. 198-199 С ЯМР (ДМСО, 6) 0,87 (т,3), 1,08 (с, 3), 1,3-1,4 (м, 3), 1,49 (с, 3), 1,5-1,65 (м, 3), 1,59 (д, 1), 1,75-1,9 (м, 2), 1,95 (дт, 1), 2,05(с, 3), 2,25 (сложн., 1), 2,4-2,51 (м, 1), 4,1-4,2 (сложн., 1), 4,78 (д, 1), 5,11 (т, 1), 5,44 (сложн.,1), 5,63 (м, 1), 6,1 (с, 1), 6,28 (дд, 1), 7,25 (дд, 1) Найдено С, 63,9 , 7,2 . Вычислено для 243224 С, 63, 4, , 7,1 . 1.4) (20)-16,17- -2-Бутенилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андроста-1,4-диен 3-он. Аналогичным образом 2-тиоксо-1,2-дигидропиридиловый эфир (20,)-3-оксо-9-фтор-11-гидрокси 16,17 бут-2-енил-идендиоксиандроста-1,4-диен-17-карбоновой кислоты (1,85 г) в качестве исходного материала дает после перекристаллизации в диэтиловом эфире (20)-16,172 бутенилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андроста-1,4-диен-3-он в виде твердого вещества белого цвета (0,25 г, 0,57 ммоль) со стереоизомерной чистотой более чем 96 , т.пл. 204-206 С ЯМР(ДМСО, 6) 1,17 (с, 3), 1,33 (м, 1), 1,44 (дд, 1), 1,50 (с, 3), 1,57 (дт, 1), 1,69 (дд, 3), 1,71 (д, 1),1,80 (м, 1), 1,92-2,04 (м, 2), 2,10 (с, 3) 2,33 (дд, 1), 2,30-2,50 (м, 1), 2,63 (дт, 1), 4,11 (сложн., 1),4,18 (д, 1), 5,35 (сложн., 1), 5,37-5,45 (м, 2), 5,96 (м, 1), 6,02 (с, 1), 6,24 (дд, 1), 7,28 (д, 1) Найдено С, 66,5 , 7,30 . Вычислено для 24314 С, 66,33 , 7,19 . 1.5) 6,9-Дифтор-11-гидрокси-16,17-изопропилидендиокси-17-(метилтио)андроста-1,4-диен-3 он. Аналогичным образом 2-тиоксо-1,2-дигидропирид-1-иловый эфир 3-оксо-6,9-дифтор-11-гидрокси 16,17-изопропилидендиоксиандроста-1,4-диен-17-карбоновой кислоты (2,5 г) дает после очистки с помощью жидкостной хроматографии низкого давления на силикагеле при элюировании смесью дихлорметана(95 ) и метанола (5 ) с последующей перекристаллизацией твердого вещества белого цвета, полученного из ацетонитрила, 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-17-(метилтио)андроста-1,4-диен 3-он (0,46 г, 1,0 ммоль), т. пл. 255-256 С ЯМР (ДМСО, 6) 1,13 (с, 3), 1,33 (с, 3), 1,45 (м, 2) 1,50 (с,3), 1,55 (с, 3), 1,64 (дд, 1), 1,70 (д, 1) 1,96-2,09 (м, 2) 2,12 (с, 3), 2,26 (м, 1), 2,45-2,62 (м, 1) 4,13(сложн., 1), 4,42 (д, 1), 5,41 (сложн., 1), 5,63 (м, 1), 6,10 (с, 1), 6,29 (дд, 1), 7,25 (дд, 1) Вычислено С, 62,6 , 6,92 . Рассчитано для 233024 С, 62,71 , 6,86 . Пример 2. 2.1) (20,)-16,17-Бутилидендиокси-17-этилтио-9-фтор-11-гидроксиандроста-1,4-диен-3-он. 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-3-оксо-9-фтор-11-гидрокси-16,17-бутилидендиоксиандроста-1,4-диен-17-карбоновой кислоты (1 г), растворенный в диметилформамиде (5 мл) и диэтилсульфиде (35 мл), облучают при -40 С в течение 3 ч в атмосфере азота. Растворители удаляют под вакуумом (70 С, 0,4 мм рт.ст.), и остаток очищают с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя хлороформом. Твердое вещество, полученное после выпаривания растворителя, пе 9 4481 1 рекристаллизовывают из смеси этилацетата и гексана, получая (20,)-16,17-бутилидендиокси-17 этилтио-9-фтор-11-гидроксиандроста-1,4-диен-3-он в виде твердого вещества белого цвета (0,30 г, 0,66 ммоль) в эпимерной пропорции 85/15 , т.пл. 228-229 С ЯМР (ДМСО, 6) 0,87 (т, 2,55), 0,89 (т, 0,45),1,07 (с, 0,45), 1,17 (м, 5,55), 1,27-1,46 (м, 4), 1,49 (с, 0,45), 1,50 (с, 2,55 Н), 1,50-1,60 (м, 3), 1,73 (д,1), 1,80 (м, 1), 1,95 (дт, 1), 2,02 (дт, 1), 2,33 (дд, 1), 2,33-2,47 (м, 1), 2,64 (дт, 1), 2,68 (кв, 2), 4,11(сложн., 0,15), 6,0 (с, 1), 6,22 (дд, 1), 7,28 (д, 1) Найдено С, 66,3 , 7,90 . Вычислено для 25354 С, 66,6 , 7,80 . 2.2) (20,)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-17-(изопропилтио)андроста-1,4-диен-3 он. 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-3-оксо-9-фтор-11-гидрокси-16,17-бутилидендиоксиандроста-1,4-диен-17-карбоновой кислоты (2,40 г), растворенный в диметилформамиде (10 мл) и диизопропилдисульфиде (40 мл), обрабатывают, как описано выше. Перекристаллизация из смеси этилацетата и уайт-спирита дает (20,)-9-фтор-11-гидрокси-16,17-бутилидендиокси-17-изопропилтиоандроста-1,4 диен-3-он в виде твердого вещества белого цвета (0,60 г, 1,29 ммоль) в эпимерной пропорции 8515 , т.пл. 235 С ЯМР (ДМСО, 6) 0,88 (т, 2,55), 0,92 (т, 0,45), 1,05 (с, 0,45), 1,17 (с, 2,55), 1,23 (д, 3), 1,28 (д,3), 1,30-1,45 (м, 4), 1,49 (с, 0,45), 1,50 (с, 2,55), 1,50-1,63 (м, 3), 1,67-1,84 (м, 2), 1,95 (дт, 1), 2,07(дт, 1), 2,32 (дд, 1), 2,35-2,50 (м, 1), 2,63 (дт, 1) 3,42 (м, 1), 4,08 (д, 0,85), 4,15 (сложн., 1), 4,73 (д,0,15), 5,08 (т, 0,15), 5,16 (т, 0,85), 5,37 (сложн., 1), 6,02 (с, 1), 6,23 (дд, 1), 7,28 (д, 1) Найдено С, 66,6 , 8,10 . Вычислено для 26374 С, 67,2 , 8,00 . Пример 3. 3.1) 6,9-Дифтор-11-гидрокси-16,17-изопропилидендиокси-17-(фторметилтио)андроста-1,4-диен 3-он. Смесь 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-17-метилтиоандроста-1,4-диен-3 она (5,06 г, 11,5 ммоль), 2,6-ди-трет-бутил-4-метилпиридина (5,19 г, 25,3 ммоль) и активированного молекулярного сита (тип 4 А, 7,5 г) в сухом дихлорметане (250 мл) перемешивают в течение 1,5 ч в атмосфере аргона при 20 С. Добавляют дифторид ксенона (2,15 г, 12,7 ммоль) одной порцией и перемешивают при 20 С в течение 3 ч. После отфильтровывания молекулярных сит однородный раствор выливают в ледяную воду(500 мл), декантируют и водную фазу экстрагируют дихлорметаном (200 мл). Объединенные органические фазы промывают рассолом (100 мл) и концентрируют в вакууме. Остаток собирают в этилацетат (500 мл),промывают хлористоводородной кислотой (1, три раза по 250 мл), водой (250 мл), рассолом (250 мл) и затем органическую фазу сушат над сульфатом магния. После отфильтровывания осушителя и концентрирования в вакууме получают твердое вещество белого цвета (3,6 г), которое очищают с помощью препаративной жидкостной хроматографии высокого давления с использованием колонки-18 и смеси метанолвода в качестве подвижной фазы. Получают 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-17-(фторметилтио)-андроста-1,4-диен-3-он (2,4 г, 5,23 ммоль) в виде твердого вещества белого цвета, которое перекристаллизовывают из ацетонитрила, т.пл. 268-269 С а 26162, с 0,057 (3) ЯМР (ДМСО, 6) 1,06 (с, 3), 1,36 (с, 3), 1,45 (с, 3), 1,46-1,57 (м, 2), 1,50 (с, 3), 1,69 (дт, 1), 1,73 (д,1), 1,82 (дт, 1), 2,05 (дт, 1), 2,29 (сложн., 1), 2,47-2,63 (м 1), 4,15 (сложн. 1), 4,63 (д, 1), 5,52(20)-9-Фтор-11-гидрокси-16-17-бутилидендиокси 17-метилтиоандроста-1,4-диен-3-он (2,0 г, 4,58 ммоль) обрабатывают 2,6-ди-трет-бутил-4-метилпиридином (2,05 г, 10 ммоль) и дифторидом ксенона (0,85 г,5,0 ммоль) в дихлорметане (100 мл), как описано выше. После обработки остаток очищают с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя хлороформом, полученное твердое вещество белого цвета (0,6 г) перекристаллизовывают из смеси этилацетата и уайт-спирита с получением(1,7 г, 3,5 ммоль) обрабатывают 2,6-ди-трет-бутил-4-метилпиридином (1,57 г, 7,66 ммоль) и дифторидом ксенона (0,65 г, 3,8 ммоль) в дихлорметане (100 мл), как описано выше. После обработки полученный белый порошок (1,3 г) очищают с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя хлороформом с получением (20)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-17-(фторметилтио)андроста-1,4-диен-3-она в виде твердого вещества белого цвета (0,32 г, 0,68 ммоль), т.пл. 145-146 С ЯМР (ДМСО, 6) 0,88 (т, 3), 1,08 (с, 3), 1,31-1,50 (м, 3), 1,50 (с, 3), 1,50-1,55 (м, 1), 1,53-1,68 (м,3), 1,75 (д, 1), 1,89 (дт, 1), 2,03 (дт, 1), 2,27 (сложн., 1), 2,50-2,66 (м, 1), 4,17 (сложн., 1), 4,40 (д,1), 5,09 (т, 1), 5,53-5,10 (м, 1,5), 5,58 (дд, 1), 5,65-5,74 (м, 0,5), 5,73 (дд, 1), 6,11 (с, 1), 6,30 (дд,1), 7,24 (дд, 1) Найдено С, 61,2 , 6,70 Вычислено для 243134 С, 60,99 , 6,60 . Пример 4. 4.1) (20,)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-17-(2-пиридилтио)андроста-1,4-диен-3 он. 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-3-оксо-9-фтор-11-гидрокси-16,17-бутилидендиоксиандроста-1,4-диен-17-карбоновой кислоты (0,60 г), растворенной в дихлорметане (50 мл), облучают в атмосфере азота, как описано выше. Температуру поддерживают при 20 С с наружным охлаждением, и облучение продолжают, пока реакционная смесь не станет бесцветной (45 мин). Реакционную смесь концентрируют в вакууме, и продукт выделяют с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя хлороформом. После перекристаллизации из смеси этилацетата и уайт-спирита получают(20,)-16-17-бутилидендиокси-9-фтор-11-гидрокси-17-(2-пиридилтио)-андроста-1,4-диен-3-он в виде твердого вещества белого цвета (0,15 г, 0,30 ммоль) в эпимерной пропорции 8515 , т.пл. 215 С ЯМР(дт, 1), 8,48 (ддд, 1) Найдено С, 67,0 , 6,87 2,70 . Вычислено для 28344 С, 67,30 , 6,80,2,80 . 4.2) 9-Фтор-11-гидрокси-16,17-изопропилидендиокси-17-(2-пиридилтио)андроста-1,4-диен-3-он Обрабатывая аналогичным образом 2-тиоксо-1,2-дигидропирид-1-иловый эфир 9-фтор-11-гидрокси 16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (9 г), получают после обработки твердое вещество белого цвета (2,9 г). Перекристаллизация из диэтилового эфира дает 9-фтор-11 гидрокси-16,17-изопропилидендиокси-17-(2-пиридилтио)андроста-1,4-диен-3-он гидрат в виде твердого вещества желтого цвета (0,63 г). Т.пл. 183-186 С ЯМР, (ДМСО, 6) 1,14-1,22 (м, 4), 1,25-1,42 (м, 1),1,38 (с, 3), 1,47 (с, 3), 1,47-1,55 (м, 1), 1,59 (с, 3), 1,62-1,75 (м, 1), 1,78-1,92 (м, 2), 1,93-2,05 (м, 1),2,29-2,48 (м, 2), 2,55-2,67 (м, 1), 3,98 (сложн., 1), 4,69 (д, 1), 5,29 (сложн., 1), 6,0 (с, 1), 6,19 (дд,1), 7,2 (д, 1), 7,24 (м, 1), 7,67-7,75 (м, 2), 8,45 (м, 1),Найдено С, 64,1 , 6,492,50 . Вычислено для 2732420 С, 64,39 , 6,402,78 . Пример 5. 5.1)(20,)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андроста-1,4-диен-3,6 дион. Облучение 2-тиоксо-1,2-дигидропирид-1-илового эфира (20,)-3,6-диоксо-9-фтор-11-гидрокси 16,17-бутилидендиоксиандроста-1,4-диен-17-карбоновой кислоты (1,83 г, 3,28 ммоль) в присутствии диметилдисульфида в соответствии с вышеописанной методикой дает твердое вещество бледно-кремового цвета (1,36 г), которое перекристаллизовывают из диэтилового эфира, получая твердое вещество белого цвета с желтоватым оттенком (1,1 г), которое перекристаллизовывают второй раз из ацетонитрила, получают (20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андроста-1,4-диен-3,6-дион в виде твердого вещества белого цвета (0,33 г, 0,73 ммоль) с диастереоизомерной чистотой большей чем 95 , т.пл. 241-243 С ЯМР (ДМСО, 6) 0,88 (т, 3), 1,19 (с, 3), 1,33-1,47 (м, 3), 1,49 (с, 3), 1,551,64 (м, 3), 1,82 (д, 1), 2,07 (м, 2), 2,10 (с, 3), 2,29 (дд, 1), 2,73 (дд, 1), 2,73-2,95 (м, 1), 4,17 (д, 1),4,23 (сложн., 1), 5,13 (т, 1), 5,61 (сложн., 1) 6,29 (д, 1), 6,40 (дд, 1), 7,43 (д, 1) Найдено С, 64,0 , 7,00 . 11 4481 1 Вычислено для 24315 С, 64,0 , 6,93 . Пример 6. 6.1) (20,)-16,17-Бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандрост-4-ен-17-карбоновая кислота. К дегазированному (2) раствору метанола (250 мл) и воды (15 мл) добавляют таблетки гидроксида натрия (5,52 г, 138 ммоль). После гомогенизации добавляют одной порцией (20,)-16,17-бутилидендиокси 6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновую кислоту (12,48 г, 27,6 ммоль) и суспензию перемешивают, пока не будет получен раствор желтого цвета. Реакционную смесь обрабатывают по каплям при комнатной температуре пентакарбонилом железа (36,31 мл, 276 ммоль), затем нагревают до 50 С и выдерживают при этой температуре 20 ч в атмосфере азота. Охлажденную реакционную смесь выливают в ледяной водный раствор серной кислоты (4 н. 1000 мл) и затем добавляют дихлорметан (750 мл) и после декантации прозрачный водный слой отделяют. Органическую фазу промывают рассолом (500 мл), сушат над сульфатом натрия, фильтруют и концентрируют до половины первоначального объема упариванием в вакууме. Получающийся в результате остаток отфильтровывают через слой на силикагеле, промывая сначала дихлорметаном, затем этилацетатом и, наконец, смесью этилацетатметанол (11). Концентрирование в вакууме дает белую пену, которую растирают в порошок с диизопропиловым эфиром и получают (20,)16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандрост-4-ен-17-карбоновую кислоту в виде твердого вещества белого цвета с желтоватым оттенком (12,7 г, 27,7 ммоль), т.пл. 210 С (разл.) ЯМР(ДМСО, 6) 0,87 (т, 3), 0,93 (с, 2,7), 0,96 (с, 0,3), 1,25-1,60 (м, 6), 1,49 (с, 3), 1,75 (д, 2) 1,91-2,0 (м,2), 2,0-2,1 (м, 1), 2,16 (сложн., 1), 2,22-2,37 (м, 2), 2,37-2,55 (м, 2), 4,15 (сложн., 1), 4,68 (т, 0,9),4,89 (сложн., 0,9 ), 5,10 (д, 0,1), 5,15 (сложн., 1), 5,21 (т, 0,1), 5,50 (сложн., 1), 5,70 (с, 0,1), 5,81 (с,0,9) 6.2) Диэтилфосфорный ангидрид (20,)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты. Способом, описанным в ссылочных примерах, получают из (20,)-16,17-бутилидендиокси-6,9 дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (12,6 г, 27,7 ммоль) диэтилфосфорный ангидрид (20,)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17 карбоновой кислоты (17,2 г сырца), который используют без дальнейшей очистки в следующей стадии. 6.3) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-6,9-дифтор-11 гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты. Способом, описанным в ссылочных примерах, получают из диэтилфосфорного ангидрида (20,)16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты(17,2 г) после обработки 2-тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси 6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (16,6 г), который используют как таковой на следующей стадии. 6.4) (20,)-6,9-Дифтор-11-гидрокси-16,17-бутилидендиокси-17-метилтиоандрост-4-ен-3-он. Способом, описанным в примере 1, получают из 2-тиоксо-1,2-дигидропирид-1-илового эфира (20,)-3 оксо-6,9-дифтор-11-гидрокси-16,17-бутилидендиоксиандрост-4-ен-17-карбоновой кислоты (16,6 г) в качестве исходного материала, после обработки, белый порошок с желтоватым оттенком (12 г), который очищают с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя смесью диэтиловый эфируайт-спирит (7525). Полученное твердое вещество белого цвета (6 г) перекристаллизовывают из ацетонитрила,получая(20,)-6,9-дифтор-11-гидрокси-16,17-бутилидендиокси-17 метилтиоандрост-4-ен-3-он (4 г) в виде смеси эпимеров (20,) в пропорции 9010, которую разделяют с помощью препаративной жидкостной хроматографии высокого давления, используя колонку-18 и смесь метанола и воды в качестве подвижной фазы. (20)-эпимер получают в виде твердого вещества белого цвета (3,4 г, 7,45 ммоль), т.пл. 180 С ЯМР (ДМСО, 6) 0,90 (т, 3), 1,15 (с, 3), 1,36-1,54 (м, 7), 1,49 (с,3), 1,72 (д, 1), 1,93-2,10 (м, 3), 2,09 (с, 3), 2,16 (сложн., 1), 2,23-2,38 (м, 2), 2,28-2,54 (м, 2), 4,13(сложн., 1), 4,17 (д, 1), 5,12 (сложн., 1), 5,15 (т, 1), 5,50 (сложн., 1), 5,81 (с, 1). Найдено С, 63,3 , 7,60 . Вычислено для 243424 , 63,1 , 7,51 . 6.5) (20,)-9-Фтор-11-гидрокси-16,17-бутилидендиокси-17-метилтиоандрост-4-ен-3-он. Аналогичным способом получают из 2-тиоксо-1,2-дигидропирид-1-илового эфира (20,)-3-оксо-9 фтор-11-гидрокси-16,17-бутилидендиоксиандрост-4-ен-17-карбоновой кислоты (2,41 г), после очистки с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя смесью диэтиловый эфируайт-спирит (91), и перекристаллизации из циклогексана, (20,)-9-фтор-11-гидрокси-16,17 бутилидендиокси-17-метилтиоандрост-4-ен-3-он в виде твердого вещества белого цвета (0,58 г, 1,32 ммоль) в стереоизомерном соотношении 9010, т.пл. 161-163 С ЯМР (ДМСО, 6) 0,89 (т, 3), 1,05 (с, 0,3), 1,14 4481 1 2,60 (м, 6, 4,10 (сложн., 1), 4,13 (д, 0,9), 4,75 (д, 0,1), 5,03 (сложн., 0,9), 5,06 (сложн., 0,1), 5,10 (т,0,1), 5,14 (т, 0-9), 5,68 (с, 1) Найдено С, 65,4 , 8,10 . Вычислено для 24354 С, 65,72 , 8,04 . 6.6) (20)-6,9-Дифтор-11-гидрокси-16,17-бутилидендиокси-17-фторметилтиоандрост-4-ен-3 он. Аналогичным способом получают из (20)-6,9-дифтор-11-гидрокси-16,17-бутилидендиокси-17 метилтиоандрост-4-ен-3-она (1,04 г, 2,28 ммоль) после обработки белую пену (1,05 г), которую очищают с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя смесью дихлорметанметанол (991), получая (20)-6,9-дифтор-11-гидрокси-16,17-бутилидендиокси-17-фторметилтиоандрост-4-ен-3-он (0,11 г, 0,23 ммоль). Т.пл. 185-188 С ЯМР (ДМСО, 6) 0,89 (т, 3), 1,05 (с, 3), 1,331,66 (м, 7), 1,49 (с, 3), 1,73 (д, 1), 1,85-2,0 (м, 2), 2,08 (дт, 1), 2,19 (сложн. 1), 2,03-2,36 (м, 2), 2,402,52 (м, 2), 4,15 (сложн., 1), 4,39 (д, 1), 5,10 (т, 1), 5,25 (д, 1), 5,50 (сложн., 1), 5,60 (дд, 1), 5,73(20)-16,17-Бутилидендиокси-6,9-дифтор-11-гидрокси-17-метилтиоандроста-1,4-диен-3-он (3 г, 6,6 ммоль) в растворе в ацетоне (90 мл) обрабатывают по каплям раствором пероксимоносульфата калия(2,1 г, 3,36 ммоль) в воде (18 мл). После перемешивания в течение 40 мин реакционную смесь фильтруют и фильтрат концентрируют в вакууме с получением бледно-желтой смолы. Эту смолу собирают в хлороформе(200 мл), промывают водой (два раза по 200 мл) и рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме, получая бледно-желтую пену. Эту пену очищают с помощью жидкостной хроматографии низкого давления на силикагеле, получая (20)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси 17-(метилсульфинил)андроста-1,4-диен-3-он в виде твердого вещества белого цвета (0,65 г, 1,4 ммоль),т.пл. 179-180 С ЯМР (ДМСО, 6) 0,87 (т, 3), 1,03 (с, 3), 1,30-1,48 (м, 3), 1,49 (с, 3), 1,49-1,82 (м,5), 1,85-2,0 (м, 2), 2,29 (сложн., 1), 2,54-2,70 (м, 1), 2,63 (с, 3), 4,15 (сложн., 1), 5,12 (д, 1), 5,41(20)-9-фтор-11-гидрокси-16,17-бутилидендиокси-17-метилсульфиниландроста-1,4-диен-3-он в виде твердого вещества белого цвета (0,25 г, 0,55 ммоль), т.пл. 175 С ЯМР (ДМСО, 6) 0,87 (т, 3), 1,04(20)-6,9-Дифтор-11-гидрокси-16,17-бутилидендиокси-17-метилсульфиниландроста-1,4-диен-3 он (0,3 г, 0,64 ммоль) в растворе хлороформа (20 мл) обрабатывают при 25 С 3-хлорпероксибензойной кислотой (0,24 г, 1,4 ммоль) и смесь перемешивают в течение 1 ч. Реакционную смесь обрабатывают водным раствором сульфита натрия, затем промывают последовательно водой (два раза по 25 мл), водным раствором карбоната натрия (2 М, два раза по 25 мл), водой (25 мл) и рассолом (25 мл), затем сушат над сульфатом магния и концентрируют в вакууме, получая бесцветную пену, которую растирают в порошок в горячем диизопропиловом эфире, получая (20)-6,9-дифтор-11-гидрокси-16,17-бутилидендиокси-17-метилсульфониландроста-1,4-диен-3-он в виде твердого вещества белого цвета (0,2 г, 0,41 ммоль), т.пл. 149-150 С ЯМР (ДМСО, 6) 0,87 (т, 3), 1,29 (с, 3), 1,29-1,48 (м, 3), 1,50 (с, 3), 1,53-1,60 (м, 2), 1,66-1,77 (м,2), 1,87 (д, 1), 1,90-2,05 (м, 2), 2,29 (сложн., 1), 2,60-2,76 (м, 1), 3,0 (с, 3), 4,20 (сложн., 1), 4,49 (д,1), 5,46 (т, 1), 5,50 (сложн., 1) 5,65 (сложн., 1), 6,12 (с, 1), 6,30 (дд, 1), 7,27 (дд, 1) Найдено С, 58,8 , 6,61 . Вычислено для 243226 С, 59,2 , 6,63 . 13 4481 1 Пример 9. 9.1) 9-Фтор-11-гидрокси-16,17-изопропилидендиокси-17-метилсульфониландроста-1,4-диен-3 он. 9-Фтор-11-гидрокси-16,17-изопропилидендиокси-17-метилтиоандроста-1,4-диен-3-он (1,4 г, 3,3 ммоль) в растворе в хлороформе (150 мл) обрабатывают 3-хлорпероксибензойной кислотой (2,2 г, 6,8 ммоль) при 25 С. По завершении реакции (контроль ) реакционную смесь обрабатывают, как описано выше, и полученный остаток очищают с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя смесью хлороформметанол (955). Перекристаллизация из смеси ацетона и гексана дает 9 фтор-11-гидрокси-16,17-изопропилидендиокси-17-метилсульфониландроста-1,4-диен-3-он в виде белого порошка (0,24 г, 0,53 ммоль), т.пл. 180 С (разл.) ЯМР (ДМСО, 6) 1,29 (с, 3), 1,29-1,42 (м, 1),1,44 (с, 3), 1,50 (с, 3), 1,52 (с, 3), 1,59 (дд, 1), 1,73-1,88 (м, 3), 1,99 (дт, 1), 2,10 (дт, 1), 2,35 (дд,1), 2,49-2,70 (м, 2), 2,96 (с, 3), 4,18 (сложн., 1), 5,15 (сложн., 1), 5,40 (сложн., 1), 6,03 (с, 1), 6,24(20)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-17-(метилтио)андроста-1,4-диен-3-она (0,16 г) в этаноле (2 мл) продувают азотом, затем обрабатывают каталитическим количеством бис-(трифенилфосфин)хлорида родия. Реакционную смесь перемешивают при избыточном давлении водорода, пока не будет поглощен один эквивалент. Реакционную смесь промывают водой (50 мл) и концентрируют в вакууме. Остаток очищают с помощью жидкостной хроматографии низкого давления на силикагеле, элюируя смесью этилацетатциклогексан (11), и получают (20)-16,17-бутилидендиокси 6,9-дифтор-11-гидрокси-17(метилтио)-андрост-4-ен-3-он (0,15 г) в виде не совсем белого порошка. Найдено С, 63,3, , 7,6 . Вычислено для 243424 С, 63,1 , 7,51 . Пример 11. 11.1) (20)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-17-(метилтио)андростан-3-он. Аналогично методике примера 1 получают из 2-тиоксо-1,2-дигидропирид-1-илового эфира (20)16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандростан-17-карбоновой кислоты в качестве исходного материала, после обработки и жидкостной хроматографии низкого давления на силикагеле с элюированием смесью этилацетатциклогексан 11, (20)-16,17-бутилидендиокси-6,9-дифтор-11 гидрокси-17-(метилтио)андростан-3-он (в виде твердого вещества белого цвета с желтоватым оттенком). Найдено С, 62,6 , 7,9 . Вычислено для 243624 С, 62,9 , 7,9 . Пример 12. 12.1) (20)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андрост-4-ен-3,6-дион. Раствор(20)-16,17-бутилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андроста-1,4-диен-3,6 диона (0,15 г) в толуоле (2 мл) и этанола (2 мл) продувают азотом, обрабатывают бис(трифенилфосфин)хлоридом родия (0,015 г) и гидрируют при 0,3 бар в течение ночи, нагревают до 50 С и поддерживают при этой температуре 6 ч и оставляют стоять на 3 дня. Реакционную смесь концентрируют под вакуумом и хроматографируют на силикагеле, элюируя смесью этилацетатциклогексан в соотношении 12, и получают (20)-16,17-бутилидендиокси-9-фтор-11-гидрокси-17-(метилтио)андрост-4-ен-3, 6 дион (0,08 г) в виде белого порошка с желтоватым оттенком. Найдено С, 64,0 , 7,5. Вычислено для С 24 Н 33 О 5 С, 63,7 , 7,35. Ссылочный пример 1. С.П. 1.1) (20,)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-3-оксоандроста-1,4-диен-17 карбоновая кислота. К хорошо перемешанной суспензии 9-фтор-11,16,17-тригидрокси-3-оксоандроста-1,4-диен-17 карбоновой кислоты (7,9 г, 20 ммоль) в тетрагидрофуране (65 мл) при 25 С добавляют масляный альдегид(9,2 мл, 100 ммоль) и перхлорную кислоту (0,2 г, 1,97 ммоль). Когда реакционная смесь станет однородной(1-5 ч), перхлорную кислоту нейтрализуют добавлением триэтиламина (0,2 г, 1,97 ммоль). После выпаривания растворителя в вакууме получают твердое вещество, которое растворяют в гидроксиде натрия (2), и получающийся в результате водный раствор промывают несколько раз диэтиловым эфиром. Нейтрализация этого водного раствора хлористоводородной кислотой (10 н.) дает белый осадок, который отфильтровывают,14 4481 1 промывают водой и сушат под вакуумом при 80 С в течение ночи (20,)-16,17-бутилидендиокси-9 фтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновая кислота (8,5 г, 18,3 ммоль), т.пл. 205 С (разл.) ЯМР (ДМСО, 6) 0,85 (м, 3), 0,96 (с, 3), 1,22-1,46 (сложн., 4), 1,50 (с, 3), 1,49-1,61 (м, 3), 1,70-1,97(м, 4), 2,33 (дд, 1), 2,34-2,50 (м, 1), 2,62 (дт, 1), 4,15 (сложн., 1), 4,67 (т, 0,9), 4,85 (д, 0,9 ), 5,08 (д,0,1), 5,16 (т, 0,1), 5,89 (м, 1), 6,01 (с, 1), 6,23 (дд, 1), 7,29 (д, 1). Это соединение используется в следующей стадии без дальнейшей очистки. Ссылочный пример 2. С.П. 2.1) (20,)-16,17-Бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17 карбоновая кислота. К перемешанной суспензии 6,9-дифтор-11,16,17-тригидрокси-3-оксоандроста-1,4-диен-17 карбоновой кислоты (50 г, 126 ммоль) в тетрагидрофуране (2 л) при 25 С в атмосфере азота добавляют масляный альдегид (59,2 г, 820 ммоль) и перхлорную кислоту (1,2 г, 11,8 ммоль). Реакционную смесь перемешивают в течение 16 часов, затем обрабатывают по каплям триэтиламином (1,2 г, 11,8 ммоль). После выпаривания растворителя в вакууме получают желтое масло, которое разделяют на части между этилацетатом (1 л) и карбонатом натрия (2 н.). Водную фазу декантируют, промывают большим количеством этилацетата(400 мл), подкисляют до рН 2 хлористоводородной кислотой (10 н.) перед экстракцией диэтиловым эфиром(1 л). Объединенные диэтилэфирные вытяжки промывают водой, рассолом, затем сушат над сульфатом магния. Фильтрация осушителя и выпаривание растворителя в вакууме дают белое твердое вещество, которое растирают в порошок с циклогексаном перед сушкой под вакуумом при 80 С в течение ночи (20,)16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновая кислота(м, 3), 1,79 (сложн., 1), 1,90-2,06 (м, 3), 2,26 (сложн., 1), 2,45-2,67 (м, 1), 4,17 (сложн., 1), 4,68 (т,0,8), 4,88 (д, 0,8), 5,10 (д, 0,2), 5,19 (т, 0,2), 5,45 (д, 1), 5,63 (сложн., 1), 6,10 (с, 1), 6,29 (дд, 1),7,35 (д, 1). Это соединение используется в следующей стадии без дальнейшей очистки. С.П. 2.2) (20,)-16,172-Бутенилидендиокси-9-фтор-11-гидрокси-3-оксоандроста-1,4-диен 17-карбоновая кислота. Аналогичным образом, используя 9-фтор-11,16,17-тригидрокси-3-оксоандроста-1,4-диен-17 карбоновую кислоту (8,9 г, 23,4 ммоль) и кротоновый альдегид (7,4 г, 105,3 ммоль) в качестве исходных материалов, получают после обработки (20,)-16,172-бутенилидендиокси-9-фтор-11-гидрокси-3 оксоандроста-1,4-диен-17-карбоновую кислоту (9,1 г, 21 ммоль) ЯМР (ДМСО, 6) 0,96 (с, 3), 1,30-1,43(м, 1), 1,50 (с, 3), 1,47-1,60 (м, 2), 1,64 (дд, 0,6), 1,68 (дд, 2,4 ), 1,68-2,0 (м, 5), 2,34 (дд, 1), 2,352,52 (м, 1), 2,64 (дт, 1), 4,15 (сложн., 1), 4,85 (д, 0,8 ), 4,97 (д, 0,8 Н), 5,07 (д, 0,2), 5,28 (ддд, 0,2),5,33-5,40 (м, 1,8), 5,46 (д, 0,2), 5,85 (м, 0,2), 5,92 (м, 0,8), 6,03 (с, 1), 6,23 (дд, 1), 7,29 (д, 1). Это соединение используется как таковое в следующей стадии. С.П. 2.3) (20,)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-3,6-диоксоандроста-1,4-диен-17 карбоновая кислота. Аналогичным образом, но используя 9-фтор-11,16,17-тригидрокси-3,6-диоксоандроста-1,4-диен 17-карбоновую кислоту (2,1 г), получают после обработки (20,)-16,17-бутилидендиокси-9-фтор 11-гидрокси-3,6-диоксоандроста-1,4-диен-17-карбоновую кислоту (1,6 г) ЯМР (ДМСО, 6) 0,8-0,9 (м,3), 0,97 (с, 3), 1,2-1,45 (м, 3), 1,47 (с, 3), 1,48-1,65 (м, 3), 1,8-1,9 (м, 1), 2-2,2 (м, 2), 2,25-2,35 (м,1), 2,6-2,95 (м, 2), 4,2-4,3 (сложн., 1), 4,68 (т, 0,8), 4,88 (д, 0,8), 5,1 (д, 0,2), 5,23 (т, 0,2), 5,52(сложн., 0,2), 5,62 (сложн., 0,8), 6,29 (д, 1), 6,4 (дд, 1), 7,41 (2 д, 1). С.П. 2.4) (20,)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-3-оксоандрост-4-ен-17-карбоновая кислота. 9-Фтор-11,16,17-тригидрокси-3-оксоандрост-4-ен-17-карбоновая кислота (2,4 г) при обработке способом, аналогичным вышеописанному, дает (20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси-3 оксоандрост-4-ен-17-карбоновую кислоту (2,15 г). Ссылочный пример 3. С.П. 3.1) 9-Фтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновая кислота. 9-Фтор-11,16,17-тригидрокси-3-оксоандроста-1,4-диен-17-карбоновую кислоту (7,9 г, 20 ммоль) суспендируют в ацетоне (100 мл), затем добавляют перхлорную кислоту (0,2 г, 1,97 ммоль) при 25 С. 9 Фтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновую кислоту выделяют, после обработки, в виде твердого вещества белого цвета (7 г, 16,7 ммоль) способом, аналогичным вышеописанному. .пл. 316 С (разл.) ЯМР (ДМСО, 6) 0,94 (с, 3), 1,15 (с, 3), 1,20 (с, 3), 1,26-1,40 (м,1), 1,49 (с, 3), 1,47-1,51 (м, 1), 1,53-1,62 (дт, 1), 1,68 (д, 1), 1,69-1,95 (м, 3), 2,33 (дд, 1), 2,35-2,52(м, 1), 2,64 (дт, 1), 4,15 (сложн., 1), 4,95 (д, 1), 6,34 (м, 1), 6,02 (с, 1), 6,21 (дд, 1), 7,27 (д, 1), и используют без очистки на следующей стадии. 15 4481 1 С.П. 3.2) 6,9-Дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17 карбоновая кислота. Аналогичным образом из 6,9-дифтор-11,16,17-тригидрокси-3-оксоандроста-1,4-диен-17 карбоновой кислоты (45,0 г, 112,9 ммоль), после обработки, получают 6,9-дифтор-11-гидрокси-16,17 изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновую кислоту (40,9 г, 93,3 ммоль). Т.пл. 285287 С (разл.) ЯМР (ДМСО, 6) 0,93 (с, 3), 1,15 (с, 3), 1,31 (с, 3), 1,40-1,67 (м, 4), 1,50 (с, 3), 1,69 (д,1), 1,80-2,02 (м, 2), 2,26 (сложн., 1), 2,48-2,65 (м, 1), 4,17 (сложн., 1), 4,97 (д, 1), 5,43 (сложн., 1),5,64 (м, 1), 6,10 (с, 1), 6,28 (дд, 1), 7,27 (дд, 1), которую используют как таковую в следующей стадии. Ссылочный пример 4. С.П. 4.1) Диэтилфосфорный ангидрид 9-фтор-11-гидрокси-16,17-изопропилидендиокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты. К перемешанному раствору 9-фтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4 диен-17-карбоновой кислоты (1,05 г, 2,5 ммоль) в тетерагидрофуране (35 мл), содержащему активированное молекулярное сито (типа 4 А, 1 г), при 25 С в атмосфере азота прибавляют триэтиламин (0,7 мл, 5 ммоль). После перемешивания в течение 0,5 часа реакционную смесь обрабатывают диэтиловым эфиром хлорфосфорной кислоты (0,54 мл, 3,75 ммоль) в течение периода 45 минут и перемешивают еще 90 минут. Получающуюся в результате смесь профильтровывают через целитовую прокладку, и тетрагидрофуран выпаривают в вакууме, полученное сырое масло собирают в этилацетат (50 мл), промывают хлористоводородной кислотой (1, 25 мл), затем водой (два раза по 25 мл) и рассолом (два раза по 25 мл). Этилацетатную фазу сушат над сульфатом натрия, осушитель затем отфильтровывают и после концентрирования в вакууме получают диэтилфосфорный ангидрид 9-фтор-11-гидрокси-16,17-изопропилидендиокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты в виде желтого масла-сырца (1,5 г), которое используют на следующей стадии без дальнейшей очистки. С.П. 4.2) Диэтилфосфорный ангидрид 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты. Из 6,9-Дифтор-11-гидрокси-16,17-изопропилиден-диокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (7,04 г, 16 ммоль) получают по способу, аналогичному вышеописанному, диэтилфосфорный ангидрид 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты в виде белой пены-сырца (9,8 г), которую используют без дальнейшей очистки на следующей стадии. С.П. 4.3) Диэтилфосфорный ангидрид (20,)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты. Из (20,)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (14,5 г, 32 ммоль), работая по способу, аналогичному вышеописанному, получают диэтилфосфорный ангидрид (20,)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен 17-карбоновой кислоты (19,5 г сырца), который используют как таковой на следующей стадии. С.П. 4.4) Диэтилфосфорный ангидрид (20,)-16,172-бутенилидендиокси-9-фтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты.(20,)-16,172-Бутенилидендиокси-9-фтор-11-гидрокси-3-оксоандроста-1,4-диен-17 карбоновая кислота (10,0 г, 23,1 ммоль) дает по способу, аналогичному вышеописанному, диэтилфосфорный ангидрид (20,)-16,172-бутенилидендиокси-9-фтор-11-гидрокси-3-оксоандроста-1,4-диен-17 карбоновой кислоты (13 г сырца), который используют без дальнейшей очистки на следующей стадии. С.П. 4.5) Диэтилфосфорный ангидрид (20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты. Аналогичным способом,используя(20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси-3 оксоандроста-1,4-диен-17-карбоновую кислоту (6,4 г 15,2 ммоль) в качестве исходного материала, получают сырой диэтилфосфорный ангидрид (20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты в виде желтого масла-сырца (7,5 г), которое используют без очистки на следующей стадии. С.П. 4.6) Диэтилфосфорный ангидрид (20,)-16,17-Бутилидендиокси-9-фтор-11-гидрокси-3,6 диоксоандроста-1,4-диен-17-карбоновой кислоты. Аналогичным образом,используя(20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси-3,6 диоксоандроста-1,4-диен-17-карбоновую кислоту (1,46 г), получают диэтилфосфорный ангидрид (20,)16,17-бутилидендиокси-9-фтор-11-гидрокси-3,6-диоксоандроста-1,4-диен-17-карбоновой кислоты 4481 1 По способу, аналогичному вышеописанному, из (20)-16,17-бутилидендиокси-6,9-дифтор-11 гидрокси-3-оксоандростан-17-карбоновой кислоты (2 г) получают диэтилфосфорный ангидрид (20)6,9-дифтор-11-гидрокси-16,17-бутилидендиокси-3-оксоандростан-17-карбоновой кислоты. С.П. 4.8) Диэтилфосфорный ангидрид (20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси-3 оксоандрост-4-ен-17-карбоновой кислоты. По способу, аналогичному вышеописанному, из (20,)-16,17-бутилидендиокси-9-фтор-11 гидрокси-3-оксоандрост-4-ен-17-карбоновой кислоты (2,1 г) получают диэтилфосфорный ангидрид (20,)16,17-бутилидендиокси-9-фтор-11-гидрокси-3-оксоандрост-4-ен-17-карбоновой кислоты (2,8 г). Ссылочный пример 5. С.П. 5.1) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир 9-фтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты. В светозащищенном реакторе перемешиваемый раствор диэтилфосфорного ангидрида 9-фтор-11 гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (3,4 г) в диметилформамиде (30 мл), содержащем активированное молекулярное сито (тип 4 А, 5 г) и поддерживаемый при 20 С в атмосфере азота, обрабатывают натриевой солью -оксида 2-меркаптопиридина (1,13 г, 7,6 ммоль). После завершения реакцииреакционную смесь фильтруют и фильтрат выливают в ледяную воду (150 мл). Образовавшийся желтый осадок собирают фильтрованием, промывают холодной водой и затем собирают в дихлорметане (100 мл), промывают холодной водой, рассолом и затем сушат над сульфатом натрия. Осушитель отфильтровывают, прозрачный желтый раствор концентрируют в вакууме (20 С, 13 мм рт.ст.), получая ярко-желтый осадок 2-тиоксо-1,2-дигидропирид-1-илового эфира 9-фтор-11-гидрокси 16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (2,5 г), который используется как таковой на следующей стации. Все вышеописанные процедуры проводятся при исключении света,насколько это возможно. С.П. 5.2) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты. По способу, аналогичному вышеописанному, из 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3-оксоандроста-1,4-диен-17-карбоксильного диэтилфосфорного ангидрида (9,7 г) получают 2 тиоксо-1,2-дигидропирид-1-иловый эфир 6,9-дифтор-11-гидрокси-16,17-изопропилидендиокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты (8,41 г), который используют как таковой на следующей стадии. С.П. 5.3) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-6,9-дифтор 11-гидрокси-3-оксоандроста-1,4-17-карбоновой кислоты. Из диэтилфосфорного ангидрида (20,)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты (19,5 г) после обработки получают 2-тиоксо-1,2 дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (19,5 г), который используют на следующей стадии без дальнейшей очистки. С.П. 5.4) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,172-бутенилидендиокси-9 фтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты. Из диэтилфосфорного ангидрида (20,)-16,172-бутенилидендиокси-9-фтор-11-гидрокси-3 оксоандроста-1,4-диен-17-карбоновой кислоты (2 г) получают после обработки 2-тиоксо-1,2-дигидропирид 1-иловый эфир (20,)-16,172-бутенилидендиокси-9-фтор-11-гидрокси-3-оксоандроста-1,4-диен 17-карбоновой кислоты (1,90 г), который используют как таковой на следующей стадии. С.П. 5.5) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-9-фтор-11 гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты. Аналогичным способом, используя диэтилфосфорный ангидрид (20,)-16,17-бутилидендиокси-9 фтор-11-гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (4,2 г) в качестве исходного материала, получают 2-тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-9-фтор-11 гидрокси-3-оксоандроста-1,4-диен-17-карбоновой кислоты (3 г), который используют на следующей стадии без дальнейшей очистки. С.П. 5.6) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-9-фтор-11 гидрокси-3,6-диоксоандроста-1,4-диен-17-карбоновой кислоты. После обработки аналогичным способом из диэтилфосфорного ангидрида (20,)-16,17 бутилидендиокси-9-фтор-11-гидрокси-3,3-диоксоандроста-1,4-диен-17-карбоновой кислоты (2,0 г) получают 2-тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси 3,6-диоксоандроста-1,4-диен-17-карбоновой кислоты (1,83 г). С.П. 5.7) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20)-16,17-бутилидендиокси-6,9-дифтор-11 гидрокси-3-оксоандростан-17-карбоновой кислоты. 17 4481 1 По способу, аналогичному вышеописанному, из диэтилфосфорного ангидрида (20)-16,17 бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандростан-17-карбоновой кислоты получают 2 тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3 оксоандростан-17-карбоновой кислоты. С.П. 5.8) 2-Тиоксо-1,2-дигидропирид-1-иловый эфир (20,)-16,17-бутилидендиокси-9-фтор-11 гидрокси-3-оксоандрост-4-ен-17-карбоновой кислоты. По способу, аналогичному вышеописанному, из диэтилфосфорного ангидрида (20,)-16,17 бутилидендиокси-9-фтор-11-гидрокси-3-оксоандрост-4-ен-17-карбоновой кислоты (2,8 г) получают 2 тиоксо-1,2-дигидропирид-1-иловый эфир(20,)-16,17-бутилидендиокси-9-фтор-11-гидрокси-3 оксоандрост-4-ен-17-карбоновой кислоты (2,4 г). Ссылочный пример 6. С.П. 6) 9-Фтор-11,16,17-тригидрокси-3,6-диоксоандроста-1,4-диен-17-карбоновая кислота. К перемешанной смеси 9-фтор-11,16,17,21-тетрагидропрегна-1,4-диен-3,6,20-триона (2,4 г) в сухом диметилформамиде прибавляют перекись калия (1,68 г) и затем 18-краун-6 (1,56 г). Температуру реакции, повысившуюся до 48 С, снижают до 40 С. Реакционную смесь прибавляют к воде (300 мл), подкисляют до рН 9,промывают этилацетатом (2 раза) и подкисляют до рН 2 (используя концентрированную хлористоводородную кислоту), затем экстрагируют в этилацетат (3 раза). Объединенные органические экстракты промывают рассолом, затем сушат над сульфатом магния. Фильтрование осушителя и концентрирование в вакууме дают 9-фтор-11,16,17-тригидрокси-3,6-диоксоандроста-1,4-диен-17-карбоновую кислоту в виде оранжевого порошка после растирания в порошок с этилацетатом (0,7 г), которую используют как таковую на следующей стадии. Ссылочный пример 7. С.П. 7.1) 9-фтор-11,16,17,21-тетрагидроксипрегна-1,4-диен-3,6,20-трион. Перемешиваемую суспензию 21-ацетилокси-9-фтор-11,16,17-тригидроксипрегна-1,4-диен-3,6,20 трион (4,32 г) в дегазированном метаноле (200 мл) и тетрагидрофуране (50 мл) в атмосфере инертного газа обрабатывают раствором карбоната калия (0,62 г) в воде (10 мл) в течение одного часа. Реакционную смесь подкисляют до рН 6 (разбавленной хлористоводородной кислотой), охлаждают до 0 С и выпавшее в осадок твердое вещество отфильтровывают и промывают холодным метанолом, получая 9-фтор-11,16,17-21 тетрагидроксипрегна-1,4-диен-3,6,20-трион (2,78 г) в виде желтовато-коричневого порошка. .пл. 255256 С. Ссылочный пример 8. С.П. 8.1) 21-Ацетилокси-9-фтор-11,16,17-тригидроксипрегна-1,4-диен-3,6,20-трион. Перемешиваемый раствор 21-ацетилокси-9-фтор-11-гидрокси-16,17-изопропилидендиоксипрегна 1,4-диен-3,6,20-триона (6,7 г) в муравьиной кислоте (200 мл), в атмосфере инертного газа нагревают до 7075 С, выдерживают при этой температуре в течение 6 часов и оставляют стоять на ночь. Реакционную смесь концентрируют в вакууме, помещают в толуол и снова концентрируют в вакууме. Остаток суспендируют в метаноле (40 мл) и медленно обрабатывают концентрированным раствором аммиака, пока рН реакционной смеси не станет равным 9 или 10. Смесь охлаждают до 0 С и выпавшее в осадок твердое вещество отфильтровывают, промывают холодным метанолом, отсасывают досуха, получая 21-ацетилокси-9-фтор 11,16,17-тригидроксипрегна-1,4-диен-3,6,20-трион (4,32 г) в виде бледно-желтого порошка. Ссылочный пример 9. С.П. 9.1) (20)-6,9-дифтор-11-гидрокси-16,17-бутилидендиокси-3-оксоандростан-17-карбоновая кислота. Перемешанную смесь (20)-16,17-бутилидендиокси-6,9-дифтор-11-гидрокси-3-оксоандрост-4-ен 17-карбоновой кислоты (5 г) в этаноле (100 мл) продувают азотом, обрабатывают 5 -ным палладием на активированном угле (5 г) и затем гидрируют при 0,3 бар в течение нескольких часов. Реакционную смесь фильтруют через целит и фильтрат концентрируют в вакууме с получением (20)-6,9-дифтор-11 гидрокси-16,17-бутилиден-диокси-3-оксоандростан-17-карбоновой кислоты (4,7 г) в виде белой пены. Ссылочный пример 10. С.П. 10.1) 9-Фтор-11,16,17-тригидрокси-3-оксоандрост-4-ен-17-карбоновая кислота. К перемешанной смеси 9-фтор-11,16,17,21-тетрагидроксипрегн-4-ен-3,20-дион (2 г) в сухом диметилформамиде (30 мл) прибавляют пероксид калия (1,4 г) и затем 18-краун-6 (1,3 г), и используется охлаждение для поддержания температуры при 25-38 С. Реакционную смесь перемешивают в течение 1/2 часа,обрабатывают водой (300 мл), подкисляют до рН 9, промывают этилацетатом (2 раза), затем подкисляют до рН 2 (используя концентрированную хлористоводородную кислоту) и экстрагируют этилацетатом (3 раза). Объединенные органические вытяжки промывают рассолом и сушат над сульфатом магния. После отфильт 18 4481 1 ровывания осушителя и концентрирования в вакууме получают 9-фтор-11,16,17-тригидрокси-3-оксоандрост-4-ен-17-карбоновую кислоту (0,9 г) в виде твердого вещества белого цвета. Настоящее изобретение включает фармацевтические композиции, содержащие эффективное количество по меньшей мере одного из соединений формулысовместно с фармацевтически приемлемым носителем или покрытием. Фармакологическое применение. Цель изобретения состоит в том, чтобы создать противовоспалительный, иммуносупрессивный и противоаллергический стероид местного применения или его фармацевтическую композицию для следующего местное лечение заболеваний кожи, таких, как дерматит, псориаз, солнечная эритема, нейродерматит и аногенитальный зуд ингаляционное лечение заболеваний дыхательных путей, таких, как аллергия, астма и ринит, хроническое закупоривающее легочное заболевание, интенстинальное легочное заболевание и фиброз местное лечение воспалительных кишечных заболеваний, таких, как неспецифический язвенный колит и болезнь Крона и местное лечение конъюнктивы и конъюнктивита. Местное лечение таких заболеваний стероидными соединениями, согласно настоящему изобретению,связано с отсутствием побочных действий или с минимальными побочными действиями, связанными с типичной системной стероидной активностью, такой, как подавление функции гипоталамуса-гипофизанадпочечника, мобилизация резервов глюкозы, коллагеновые расстройства, минералокортикоидная функция,атрофия надпочечников, остеопороз и подавление роста костей и атрофия тимусной ткани. Это может быть достигнуто комбинацией непосредственной подачи стероида к месту применения и уменьшенной системной активностью, вызванной ограниченным поглощением или быстрым ин-виво метаболизмом стероида. Таким образом, инактивация стероида может быть путем метаболизма в целевом органе или после попадания его в общую систему кровообращения, путем метаболизма или путем экскреции. Такие соединения часто обозначаются как мягкие стероиды. Фармакологические тестовые системы. Результаты биологических испытаний соединений, согласно настоящему изобретению, представлены в нижеследующих примерах Глюкокортикоидная агонистическая активность. Связывание стероида с глюкокортикоидным рецептором вилочковой железы крысы. У самцов крысы с надрезанным надпочечником удаляли вилочковые железы (тимус) и гомогенизировали в 3-(-морфолино)пропансульфокислотно-дитиотреитольном буфере и центрифугировали при 100000 . Надосадочную жидкость используют как источник рецептора. Стероид (1-16 нМ в двойных разбавлениях) и 3 дексаметазон (4 нМ) уравновешивают с рецептором в течение 24 ч при 4 С. Связанный 3 дексаметазон отделяют от свободного дексаметазона по методу покрытого декстраном активированного угля, и его количество определяют сцинтилляционным считыванием в жидкости. 50 (концентрацию уменьшения 3 дексаметазона на 50 связывание подсчитывают из зависимости связанной фракции от концентрации добавленного стероида. Следующие результаты демонстрируют эффективность соединений настоящего изобретения при их испытании на связывание глюкокортикоидного рецептора. 9-фтор-11-гидрокси-16,17-изопропилидендиокси-17-метилтиоандроста-1,4-диен-3-он Эффективность соединений, согласно настоящему изобретению, демонстрируют также следующие тесты. Следующее представленное соединение иллюстрирует фармакологическую активность, которой обладают соединения настоящего изобретения. Ингибирование выделения фактора опухолевого омертвления (-) из периферийных кровя ных моноцитов человека. Моноциты получают из образцов крови, взятых от нормальных доноров-людей. Популяцию лейкоцитов промывают, наносят на прерывистый метризамидный градиент и фракционируют центрифугированием. Обогащенную моноцитами внутреннюю поверхность аспирируют, клетки промывают и проводят полный и дифференциальный подсчет для определения числа моноцитов. Клетки помещают для прилипания в 96 ячеечный планшет на 1-2 часа и затем инкубируют (8 х 105 моноцитов/ячейка) со стероидом в течение 18 часов (37 С в 5 -ном СО 2). Провоцируют клетки путем введения 10 нг/мл липополисахарида в течение 4 часов и - анализируют с помощью иммуносорбентного анализа с ферментной меткой. Количественное определение - осуществляют козьим анти-человеческим -, используемым в качестве покрывающего антитела, кроличьим анти-человеческим - в качестве второго антитела и козьей анти-кроличьейхрен-пероксидазой в качестве выявляющего антитела. 50 - это концентрация стероида, уменьшающая на 50 выделение - 500,25 нМ. 20 4481 1 Возбуждение активности тирозинаминотрансферазы. Н 411 Е клетки крысиной печени выращивают в течение 4 дней, пока клетки не сольются. Среду заменяют на свежую, содержащую испытуемой стероид (0-100 нМ), которую добавляют в тройные лунки. После инкубации в течение ночи, как указано выше, среду удаляют и клетки лизируют и экстракт уравновешивают при 37 С с -кетоглутаратом и пиридоксальфосфатом в фосфатном буфере, рН 7,3, в конечном объеме 1 мл. Активность тирозинаминотрансферазы инициируют, добавляя тирозин и инкубируя при 37 С в течение 10 минут. Реакцию прекращают, добавляя водный раствор гидроксида натрия (10 ). Измеряют ультрафиолетовое поглощение пара-гидрокси-бензальдегида с помощью аппарата для прочтения планшетов при 340 нм. Максимальное изменение поглощения, достигаемое со стандартом (дексаметазон), служило эталоном. Изменение поглощения для каждой концентрации испытуемого стероида подсчитывается как доля от достигаемого максимального поглощения и наносится на график против концентрации стероида. Определяют 50 как концентрацию, вызывающую повышение активности тирозинаминотрансферазы на 50 от максимальной достижимой. 500,3 нМ. Подавление отека легких у крысы ин-виво. Испытуемые соединения суспендируют в 1 карбоксиметил-целлюлозе (0,2 Твин 80 при двойной, по сравнению с требуемой, крепости и обрабатывают ультразвуком для образования суспензии. Суспензию вводят внутритрахейно самцам крысы (линия, 6 в каждой группе, каждый весит приблизительно 350 г) в 0 часов и 24 часа, причем первую дозу вводят вместе с солевым раствором, а вторую с 200 сшитый декстран (10 мг/мл), что приводит к окончательной концентрации а 5 мг/мл). Внутритрахейное введение осуществляют под галотановой анестезией (4 в кислороде,по 4 литра в минуту в течение 3 минут). Точно через 48 часов крыс убивают, окончательный вес тела регистрируют, удаляют легкие и тимус и взвешивают. Подсчитывают дозы, уменьшающие вызываемыйотек и вес тимуса на 30(30). Селективность дыхательных путей определяют как отношение инволюции тимуса (30) и подавления отека легкого (30). Отек легкого 300,003 мг/кг. Инволюция тимуса 302,2 мг/кг. Селективность дыхательных путей 733 Подавление отека уха у мыши ин-виво. Стероиды растворяют в ацетоне и вводят надкожно на вентральную и дорсальную поверхности правого наружного уха самки мыши (С 1-линия, 5 в каждой группе, каждая весит приблизительно 20 г). Через 18 ч форболмиристатацетат (, 1,25 мкг/ухо) в ацетоне вводили надкожно в правое ухо. Мышь убивают через 4 ч, выбивают 5-миллиметровый диск из каждого уха и взвешивают. Дозу, снижающую вызываемыйотек на 50(50), определяют методом линейной регрессии. Подавление отека уха, вызываемого 500,0082 мкг/ухо Мышь, сенсибилизированную яичным альбумином, провоцируют антигеном, вводимым в правое ухо внутрикожно под анестезией 4 -ным галотаном (4 в кислороде, 4 л в минуту - в течение 2 мин) 18 ч спустя после местного лечения стероидами, как указано выше в (1). Мышей убивают спустя 1 ч, и из каждого уха выбивают 5-миллиметровый диск и взвешивают. Дозу, снижающую отек на 50(50), определяют,как указано выше. Подавление отека уха у мыши, вызванного антигеном 500,026 мкг/ухо. Результаты, полученные в вышеприведенных испытаниях соединений, согласно настоящему изобретению, показывают, что эти соединения обладают ценными свойствами облегчения воспалений. В клинической практике соединения вводятся в форме, подходящей для того места тела, которое подлежит лечению. Например, для лечения заболеваний дыхательной системы они вводятся обычно в виде аэрозолей или, предпочтительно, в виде сухих порошковых составов, а для лечения заболеваний кожи их обычно применяют в виде кремов, мазей или лосьонов. Такие составы готовятся путем применения или приспособления известных способов, таких, как, например, следующие. Фармацевтические композиции. Для местного лечения заболеваний кожи стероиды могут быть введены в организм в обычном фармацевтическом носителе, таком, как кремы, мази, лосьоны, эмульсии, растворы, пены и т.п. Стероидные композиции, согласно настоящему изобретению, могут быть использованы для местного лечения кожных болезней в пределах от приблизительно 0,0001 до приблизительно 5 , предпочтительно приблизительно от 0,01 до приблизительно 2 по весу от наполнителя. Для местного лечения аллергии и астмы стероиды могут вводиться в виде сухого порошка, например, в ингаляторе однократной дозы или многократной дозы, или в виде суспензии или раствора в аэрозольном приборе с измеренной дозой или в распылителе, с подходящим носителем, или т.п. Такие устройства хорошо известны в медицине и могут быть использованы стандартные или модифицированные режимы приготовления. 21 4481 1 Такие составы для ингаляции обычно содержат от приблизительно 10 до приблизительно 4000, предпочтительно от приблизительно 100 до приблизительно 1600 мкг на дозу. Далее, стероиды, согласно настоящему изобретению, могут вводиться в анальных или перианальных составах, например в пенах, растворах или суспензиях и суппозиториях. Такие технологии приготовления лекарственного средства хорошо известны в медицине. Пример состава для задерживающей клизмы для лечения язвенного колита (это может быть также непрерывная капельная клизма, т.е. состав в растворе) может быть найден в описании к патенту США 4710495. Рецептура в качестве липосом может быть использована, как описано в описании к 92/13873. Пероральные составы медленного выделения, такие, как составы для выделения в кишечник или в ободочную кишку или в тот и другую, например, таблетки медленного выделения, также могут быть применены. Такие пероральные и анальные или перианальные составы обычно вводятся так, чтобы обеспечить поступление в организм от приблизительно 0,1 до приблизительно 100, предпочтительно от приблизительно 5 до приблизительно 50 мг в день. Следующий пример на композицию иллюстрирует фармацевтические композиции согласно настоящему изобретению. Пример 1 на композицию.(средний размер частиц 3,5 микрон) и лактоза (99 г) (средний размер частиц 72 микрона) смешивают вместе в течение 30 мин в механической мешалке-встряхивателе. Образующейся смесью заполняют желатиновые капсулы 3, по 25 мг в каждой, получая продукт, пригодный для использования с ингалятором сухого порошка. Национальный центр интеллектуальной собственности. 220072, г. Минск, проспект Ф. Скорины, 66.
МПК / Метки
МПК: C07J 71/00, A61P 37/02, A61K 31/56, A61P 29/00, A61P 37/08
Метки: противоаллергической, основе, активностью, получения, композиция, обладающие, фармацевтическая, иммуносупрессивной, стероиды, противовоспалительной, способ
Код ссылки
<a href="https://by.patents.su/22-4481-steroidy-obladayushhie-protivovospalitelnojj-immunosupressivnojj-i-protivoallergicheskojj-aktivnostyu-sposob-ih-polucheniya-farmacevticheskaya-kompoziciya-na-ih-osnove.html" rel="bookmark" title="База патентов Беларуси">Стероиды, обладающие противовоспалительной, иммуносупрессивной и противоаллергической активностью, способ их получения, фармацевтическая композиция на их основе</a>
Предыдущий патент: Производные бензола
Следующий патент: Способ формирования оптических солитонов и устройство для его осуществления
Случайный патент: Планетарная мельница